 |
|
Асоціація поліелектролітів з низькомолекулярними речовинами.
Макромолекули поліелектролітів в водних розчинах здатні до асоціації з низькомолекулярними речовинами (іонами перехідних металів, поверхнево-активними речовинами, барвниками та ін.).
Метало-полімерні комплекси.
Метало-полімерні асоціати (комплекси) утворюються в результаті донорно-акцепторної взаємодії іону металу з полімерним лігандом з утворенням координаційного зв'язку або заміщенням іоном металу протона, що входить до складу ліганду, з утворенням іонного зв'язку. Як акцептор діє іон металу, а донором є атом, що надає пару електронів для утворення зв'язку (O, N, S та ін.). Сполуки, що окрім груп (-COOH, -SO3H, -PO(OH)2) з рухливим атомом водню, здатним заміщатися на іон металу, мають донорні групи з неподіленою парою електронів (-NH2, -NR3, R- органічний радікал, >C=O, -CN та інш.), також відносяться до хелатоутворюючих лігандів.
Такі комплекси утворюються різними шляхами, рис.68:

- при внутрішньомолекулярній, або міжмолекулярній "зшивці", відповідно (схема 1 та 2);
- при формуванні полімервмісної сполуки у боковому ланцюзі, яка містить мультидентатний ліганд, наприклад, імінодиацетатну групу (схема 3);
- при взаємодії полімерного ліганду з стабільним низькомолекулярним комплексом, центральний іон металу якого замаскований низькомолекулярним лігандом. Тут утворюється „підвішений” (пендантний) тип метало-полімерного комплексу (схема 4);
- при полімеризації суміші мономер-метал (схема 5);
- при включенні іону металу у сітку полімеру, що зв’язана хімічними зв’язками, і утворення паркетоподібних метало-полімерних комплексів, (наприклад, поліметалтетрацианетиленів) ( схема 6 та 7).
Фізична картина взаємодії іонів металів із гнучкими макромолекулами полімерів досить складна. Функціональні групи полімерного ланцюга не можуть діяти як незалежні ліганди, їх локальна концентрація поблизу комплексоутворюючого іона відрізняється від середньої концентрації в об’ємі розчину, а рухливість в полімерному клубку обмежена. Сам ланцюг синтетичного полімеру в більшості випадків не є жорстким і може зазнавати конформаційних змін при зв’язуванні іонів металів внаслідок "зшивання" різних ділянок макромолекули або зміни щільності заряду на ній.
Взаємодію макромолекулярних лігандів з іонами металів найчастіше розглядають з позиції координаційної хімії низькомолекулярних сполук. Центральною частиною комплексу є іон металу, до якого послідовно або одночасно приєднуються декілька функціональних груп полімерного ланцюга. Ці функціональні групи приймаються незалежними одна від одної. Такий підхід дає можливість охарактеризувати структуру і стійкість комплексів, а також оточення координованого іону металу.
Мірою міцності зв'язування іонів металів з лігандами є константа bn або ступінчасті константи комплексоутворення Kn:

Для визначення константи bn метало-полімерних комплексів експериментальні дані їх потенціометричного титрування обробляють методами Григора, Менделя, Б’єрума та рядом інших методів, основаних на порівнянні кривих потенціометричного титрування чистого ліганду та ліганду у присутності іонів металу.
Зокрема Б’єрум запропонував математичний метод визначення констант стійкості комплексів по даних кривої потенціометричного титрування за допомогою функції утворення  .
.
Ця функція є відношенням концентрації ліганду, що зв’язаний в комплекс, до загальної концентрації іону металу – комплексоутворювача:
 , (44)
, (44)
де СL, CMe – загальні концентрації ліганду та металу, що присутні в розчині, [L] – рівноважна концентрація вільного ліганду.
У випадку утворення стійких комплексів концентрацією вільного ліганду [L] можна знехтувати, тоді:
 ,
,
де  відповідає числу координованих лігандів у комплексі, а для монодентантних лігандів – координаційному числу центрального іону.
відповідає числу координованих лігандів у комплексі, а для монодентантних лігандів – координаційному числу центрального іону.
Експериментальне визначення середнього координаційного числа (  ) та bn основане на припущенні конкуренції протона та іону металу за лігандні місця, а також уявленні про ліганд як кислоту Б’єрума – сполуку, що здатна відщеплювати протон і при комплексоутворенні віддавати протон у розчин.
) та bn основане на припущенні конкуренції протона та іону металу за лігандні місця, а також уявленні про ліганд як кислоту Б’єрума – сполуку, що здатна відщеплювати протон і при комплексоутворенні віддавати протон у розчин.
Для полімерного ліганду (РоℓН+) реакції комплексоутворення з іоном металу (М) по Б’єруму записуються таким чином:
Mm+ + РоℓН+ <=> [M(Роℓ)]m+  + Н+
+ Н+
[M(Роℓ)]m+ +РоℓН+ <=> [M(Роℓ)2]m++ Н+
........
[M(Роℓ)n-1]m+ +РоℓH+ <=> [M(Роℓ)n]m+ +H+
з константами комплексоутворення К1,К2,..........Кn.
 Зв’язок між функцією утворення
Зв’язок між функцією утворення  та концентрацією вільних лігандів [L] передає крива в координатах
та концентрацією вільних лігандів [L] передає крива в координатах  . Приклад такого графіку (система полігексаметилен-гуанідин – іони цинку) наведено на рис.69.
. Приклад такого графіку (система полігексаметилен-гуанідин – іони цинку) наведено на рис.69.
Ступінчасті константи комплексоутворення (ступінчасті константи стійкості) при умові суттєвої різниці в їх значеннях у випадку багатоступінчатого процесу комплексоутворення знаходять за виразом:
 , при
, при  ,
,
т.б. ступінчасті константи дорівнюють зворотнім значенням концентрації полімерного ліганду при половинних значеннях  .
.
Утворення метало-полімерного комплексу змінює реологічні характеристики водного розчину полімеру, навіть якщо розчин по вмісту металу є дуже розведеним. Так, при концентрації 0,1М солі, яка містить багатозарядні катіони, що здатні до утворення комплексу з макромолекулами, концентраційні залежності приведеної в’язкості в усьому інтервалі концентрацій полімеру розташовані вище, ніж для розчинів полімеру без цих солей або для розчинів полімеру, що включають індиферентний електроліт, рис.70.

| Для прикладу, що наведений на цьому рисунку, хлорид барію подібно до NaCl є індиферентним електролітом для розчину полігесаметилен-гуанідину солянокислого (ПГМГ). При концентрації 0,1М ця сіль адекватно іншім солям з багатозарядними катіонами збільшує в розчині кількість протиіонів (хлору) і зберігає постійною іонну силу розчину. |
Приведена в’язкість розчинів ПГМГ з ВаСl2, як і з NaCl розташована нижче за криву для розчинів ПГМГ. Це пов’язано з ущільненням макромолекулярних клубків завдяки зменшенню дисоціації функціональних груп макромолекул цього поліелектроліту. Ця дисоціація викликала електростатичне відштовхування між однойменно зарядженими ланками і спричиняла розгортання ланцюгів.
Комлексоутворення в водному розчині катіонів інших солей з ПГМГ обмежує вільне обертання ланок макромолекул (збільшує жорсткість їх ланцюга) і створює стеричні перепони щільному згортанню макроланцюгів в статистичні макроклубки. До того покращується в цих системах якість розчинника. Наслідком є те, що статистичні клубки стають більш розпушеними і збільшується гідродинамічний опір потоку розчину в капілярі віскозиметру через збільшення діаметру макроклубків. Цей висновок базується на данних, що наведені в табл.2.
Так, середньоквадратична відстань між кінцями ланцюга (‹ h2›1/2), та значення середнього квадрату радіусу інерції (<R2>) збільшуються при введенні в розчин ПГМГ солей, що є неіндиферентними електролітами (комплексоутворювачами). Збільшуються і кількість мономерних ланок в сегменті та значення параметра жорсткості ланцюга макромолекули.
Для солей, що є індиферентними електролітами ( хлориди барію та натрію) і не містять катіонів, здатних приєднуватися до макромолекул, наведені в таблиці параметри зменшують своє значення в порівнянні з ПГМГ. Це відбувається завдяки аніонам хлору, які компенсують позитивний заряд макромолекул.
Не всі функціональні групи макроланцюгів спроможні зв’язуватися з іонами металу через внутрішньомолекулярні взаємодії макромолекул та стеричні перешкоди. Для визначення ефективності участі цих груп поліелектроліту в комплексоутворенні з іонами металів застосовується метод зняття ізотерм поверхневого натягу та адсорбції полімеру на межі рідина-повітря. Цей метод також дає інформацію про зміну полярності і гідрофільності макромолекул при приєднанні до них іонів металів.
Таблиця 2. Розміри середньоквадратичної відстані між кінцями ланцюга в статистичному макроклубку ‹h2›1/2, значення середнього квадрату радіусу інерції <R2> та параметри гнучкості (жорсткості) макромолекул ПГМГ та його сполук з хлоридами металів.
| Склад водного розчину | ‹h2›1/2,нм | <R2>,нм2 | nеф | [‹ h2› / М] 103 нм2(моль/г) |
| ПГМГ ПГМГ +NaCl(0,2M) ПГМГ+BaCl2(0,1M) ПГМГ+CuCl2(0,1M) ПГМГ+ NiCl2(0,1M) ПГМГ+ZnCl2(0,1M) ПГМГ+CoCl2(0,1M) | 35,5 33,3 34,4 35,7 36,3 36,5 36,9 | 209,6 184,9 197,1 212,2 219,9 222,5 249,5 | 15,3 13,5 14,5 15,5 16,1 16,3 18,2 |
nеф- кількість мономерних ланок в сегменті, [‹ h2› / М]·103 –параметр жорсткості ланцюга макромолекули ПГМГ.
Водний розчин поверхнево-активного поліелектроліту складається з речовин, молекули яких різняться інтенсивністю силових полів міжмолекулярної взаємодії (полярністю), тому величина вільної поверхневої енергії знижується через перерозподіл молекул в розчині, що веде до зміни складу поверхневого шару в порівнянні з об’ємом. Менш полярний компонент водного розчину (поліелектроліт) переходить з об’єму в поверхневий шар. Збільшення концентрації поліелектроліту в поверхневому шарі в порівнянні з об’ємом є позитивною адсорбцією.
Низькомолекулярні солі в водному розчині гідратовані і взаємодіють з водою сильніше, ніж молекули води між собою. Вони є поверхнево –
інактивними, володіють більшою поверхневою енергією в порівнянні з водою, оскільки для утворення одиниці нової поверхні розчину потрібно витратити додаткову роботу проти кулонівських сил взаємодії між іонами в розчині електроліту. Іони видаляються з поверхневого шару в об’єм у відповідності з фундаментальним адсорбційним рівнянням Гібса для розведених розчинів електролітів  , де
, де  – середня іонна концентрація електроліту, ν- стехіометричний коефіцієнт електроліту (ν=ν++ν-), ν+ та ν- - стехіометричні коефіцієнти іонів електроліту.
– середня іонна концентрація електроліту, ν- стехіометричний коефіцієнт електроліту (ν=ν++ν-), ν+ та ν- - стехіометричні коефіцієнти іонів електроліту.
Відносною характеристикою адсорбції є поверхнева активність g, фізичний зміст якої полягає в тому, що вона представляє силу, що утримує речовину на поверхні, і розраховану на одиницю Гібсовської адсорбції. g виражена найбільшою величиною похідної, що відповідає області достатньо малих концентрацій (с→0 ):
g =–(  σ/
σ/  c)с→0 для неелектролітів
c)с→0 для неелектролітів
g =–(  σ/
σ/ 
 )
)  →0 для електролітів
→0 для електролітів
Співвідношення справедливе для неелектролітів так і для електролітів. Поверхнева активність входить складовою в фундаментальне адсорбційне рівняння Гібса для розведених розчинів. Величини g пропорційні значенням Гібсовської адсорбції при однаковій концентрації і зв’язані з хімічним складом речовини, що адсорбується. Для водних розчинів ця величина , як правило, збільшується з зменшенням полярності цієї речовини.
В водних розчинах поліелектролітів величина поверхневої активності є мірою погіршення спорідненості розчиненої речовини до розчинника, тобто зменшення гідрофільності структурних ланок макромолекул.
При малих концентраціях солі металу, в який іон металу є комплексоутворювачем, поліелектроліт в водному розчині залишається поверхнево-активним, рис.71.

 Ізотерми цих водно-соляних розчинів ПГМГ розташовані вище за ізотерму водного розчину самого полімеру. Поверхнева активність менша. Для хлоридів металів, що наведені, покращення спорідненості макромолекул (збільшення гідрофільності їх ланок) до розчинника - води викликане приєднанням гідратованих катіонів до макромолекул ПГМГ. Приєднуючись до комплексоутворюючих функціональних груп макромолекул багатозарядні гідратовані катіони міді, нікелю, цинку, кобальту утворюють з макромолекулами полі-комплексні іони і підсилюють гідрофільність ланок цих макромолекул у водному розчині, що перешкоджає їх переходу в адсорбційний шар. Слід зазначити, що ефект збільшення гідрофільності ланок макромолекул ПГМГ через утворення гідратованих полікомплексних іонів превалює над ефектом зменшення гідрофільності макромолекул, який викликає дія аніонів хлору, що додатково з’явилися в розчині при введенні в нього відповідної солі.
Ізотерми цих водно-соляних розчинів ПГМГ розташовані вище за ізотерму водного розчину самого полімеру. Поверхнева активність менша. Для хлоридів металів, що наведені, покращення спорідненості макромолекул (збільшення гідрофільності їх ланок) до розчинника - води викликане приєднанням гідратованих катіонів до макромолекул ПГМГ. Приєднуючись до комплексоутворюючих функціональних груп макромолекул багатозарядні гідратовані катіони міді, нікелю, цинку, кобальту утворюють з макромолекулами полі-комплексні іони і підсилюють гідрофільність ланок цих макромолекул у водному розчині, що перешкоджає їх переходу в адсорбційний шар. Слід зазначити, що ефект збільшення гідрофільності ланок макромолекул ПГМГ через утворення гідратованих полікомплексних іонів превалює над ефектом зменшення гідрофільності макромолекул, який викликає дія аніонів хлору, що додатково з’явилися в розчині при введенні в нього відповідної солі.
Ефективність участі функціональних груп макромолекул, що здатні до комплексоутворення, в процесі зв’язування іонів металів у водному розчині можна оцінити з ізотерм поверхневого натягу через розрахунок максимальної кількості ланок макромолекул, які змінили cвій енергетичний стан при утворенні з одним іоном солі полікомплексного іону. Таку можливість надає формула:  ,
,
де α- кількість енергетично змінених ланок, що припадає на взаємодіючий з макроіоном іон солі в кмоль-ланок/кмоль. Со – початкова концентрація полімеру в розчині, кмоль-ланок/м3 , Ср –рівноважна концентрація полімеру після введення відповідної солі, кмоль-ланок/м3, υ - об’єм розчину в м3, n – кількість відповідних іонів , кмоль. З графіку
Ср/a – f (Ср) можна розрахувати величину аm – максимальну кількість ланок макромолекули, які змінились енергетично і припадають на іон низькомолекулярного електроліту. Розрахунки показують, що в водному розчині полімеру, зокрема, ПГМГ на один іон Cu2+ припадає 10 ланок полімерного ланцюга, а заміна іонів міді в полікомплексному іоні на іон нікеля змінює кількість зв’язаних ланок до 12. Для іонів цинку, кобальту така кількість ланок відповідно складає 14 та 16.
Дані, що одержані при вимірі поверхневого натягу безсольового та водно-сольових розчинів поліелектроліту узгоджуються з тим, що не всі функціональні групи макромолекул, що здатні до комплексоутворення, приймають участь в зв’язуванні іонів металів. Причиною є частково згорнута конформація макромолекул в водному розчині.
Ізотерми поверхневого натягу водного розчину поліелектроліту з індиферентними електролітами, наприклад, для наведеного вище катіоноактивного ПГМГ з солями – хлоридами барію (0,01М) та натрію (0,2М) наведені на рис.72, криві 2,3.
 Відрізняє їх різке зменшення поверхневого натягу розчину при малих концентраціях полімеру в порівнянні з розчином полімеру без солі. При порівнянні цих ізотерм з ізотермою водного розчину ПГМГ (рис.72 крива 1) видно, що поверхнева активність ПГМГ у водно - соляному розчині збільшується. Це підтверджують значення поверхневої активності водного та водно-сольових розчинів полімеру, що наведені в табл.3.
Відрізняє їх різке зменшення поверхневого натягу розчину при малих концентраціях полімеру в порівнянні з розчином полімеру без солі. При порівнянні цих ізотерм з ізотермою водного розчину ПГМГ (рис.72 крива 1) видно, що поверхнева активність ПГМГ у водно - соляному розчині збільшується. Це підтверджують значення поверхневої активності водного та водно-сольових розчинів полімеру, що наведені в табл.3.
Спричинене це частковою компенсацією заряду на макромолекулах при збільшенні кількості аніонів хлору в розчині, яке погіршує гідрофільність макромолекул через утруднення їх дисоціації. Перехід макромолекул в адсорбційний шар полегшується і в інтервалі малих концентрацій полімеру адсорбція ПГМГ збільшується.
В умовах пригнічення поліелектролітного ефекту, наприклад введенням в водний розчин ПГМГ 0,2М NaCl, взаємне розташування ізотерм поверхневого натягу такого розчину з солями, катіони яких є комплексоутворюючими, змінюється мало, рис.73.

Тобто, механізм утворення полікомплексних іонів в умовах пригнічення поліелектролітного ефекту при введенні в полімерний розчин NaCI суттєво не змінюється. Але як і для ПГМГ без солей зменшення заряду на макромолекулах в присутності NaCI веде до збільшення поверхневої активності і збільшенню величини адсорбції макромолекул на границі поділу фаз в інтервалі малих концентрацій полімеру.
В водному розчині, що містить NaCI, ущільнення статистичних макроклубків ПГМГ , які вміщують комплексоутворюючі іони солей, збільшує максимальну кількість ланок на іон , які змінились енергетично. Так, в водному розчині ПГМГ з хлоридом міді на один іон Cu2+ припадає вже 22 ланки полімерного ланцюга, а заміна іонів міді в полікомплексному іоні на іони нікелю змінює кількість зв’язаних ланок до 23. Для інших іонів- цинку кобальту кількість зв’язаних ланок лежить в межах 24-28.
Вплив конформації ланцюга макромолекули на комплексоутворення з іонами металів яскраво проявляється і для поліамфолітів. Так, для деяких типів поліамфолітів спостерігається вивільнення іонів металів з полікомплеку в ізоелектричній точці, тобто зв’язування іонів металів в цій точці є мінімальним. Це є наслідком того, що при рН ізоелектричної точки електростатичні сили протягування кислотних та основних груп конкурують з іонно-координаційним зв’язком метал-полімерний ліганд.
 Стійкість полімерних координаційних сполук залежить від розміру хелатного циклу. Найбільш стійкі п’ятичленні та шестичленні хелатні цикли. Прикладом такого комплексу є полікомплекс полівініламіну з іонами міді:
Стійкість полімерних координаційних сполук залежить від розміру хелатного циклу. Найбільш стійкі п’ятичленні та шестичленні хелатні цикли. Прикладом такого комплексу є полікомплекс полівініламіну з іонами міді:
 Такі полікомплекси утворюються навіть тоді, коли комплексоутворюючі функціональні групи макромолекул розташовані статистично вздовж ланцюга .
Такі полікомплекси утворюються навіть тоді, коли комплексоутворюючі функціональні групи макромолекул розташовані статистично вздовж ланцюга .
Більш високу виборчу здатність зв’язувати іони металів мають полімерні ланцюги з функціональними групами, які заздалегідь формують структуру, що відповідає розміру іону металу, що сорбується. Один з таких полімерних цикламів наведено на схемі.
На відміну від полікислот та поліосновв поліамфолітах є два типи функціональних груп здатних до комплексоутворення з іонами металів –кислотні та основні групи. Спроможність цих груп приймати участь в комплексоутворенні визначається структурою та складом макромолекул поліамфоліту, ступенем іонізації кислотних та основних груп, конформацією ланцюгів. Остання визначається значенням рН та іонною силою розчину. Як зазначено вище, зв’язування іонів металів буде найменшим в ізоелектричній точці поліамфоліту.
Процес комплексоутворення та руйнування полікомплексу поліамфоліту з іонами металу наведено на схемі:

Випадання осаду перехідного металу у вигляді гідроксиду відбувається тільки коли ізоелектрична точка розташована в лужній області рН. Поліамфолит при цьому залишається в розчині.
Асоціація поліелектролітів з малими молекулами.
Асоціація поліелектролітів з малими молекулами (молекулами поверхнево-активних речовин, барвниками та інш.) відбувається завдяки встановленню іонних контактів, водневих зв’язків, гідрофобних взаємодій, сил Ван-дер-Ваальсу.
Зв’язування поліелектролітами поверхнево-активних речовин.
З іонними поверхнево-активними речовинами (ПАР) взаємодія поліелектроліту має електростатичну природу. Вона може доповнюватися гідрофобними взаємодіями. Для зарядженої макромолекули поліоснови схема її взаємодії з молекулами іоногенного ПАР виглядає таким чином:

Профіль реакції утворення комплексу поліелектроліт –ПАР подібний до профілю реакції утворення полікомплексу з слабких полікислоти та поліоснови, що наведений на рис.61. Крутизна профілю залежності θ─рН відображує кооперативність процесу.
Молекули іоногенного ПАР послідовно нейтралізують заряди макромолекули поліелектроліту, оскільки включають протилежно заряджені іони. Внаслідок цього відбувається суттєва зміна конформації ланцюга макромолекули. Таким чином, нейтралізація зарядів макромолекул призводить до утворення компактних частинок комплексу, які стабілізуються гідрофобними взаємодіями дифільних іонів ПАР, що зв’язані з поліелектролітом. В подальшому відбувається утворення більш великих за розміром агрегатів, які випадають в осад.
Цей осад може знову переходити в розчин, якщо відбувається зміна заряду полімерного ланцюга на протилежний до заряду вихідного поліелектроліту. Схема такої перезарядки полімерного ланцюга при додатковій сорбції молекул ПАР полікомплексом має наступний вигляд:
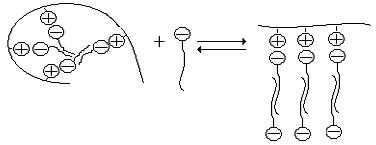
Розгортання макромолекул, що утворювали комплекс з молекулами ПАР, відображується на в’язкості розчину, що ілюструє рис.74. Перезарядка ланцюгів поліелектроліту викликає ріст в’язкості при додатковій сорбції полікомплексом молекул ПАР.
Подібний вигляд залежності приведеної в’язкості мають і водні розчини неіоногенних ПАР з поліелектролітами. Прикладом такої системи є суміші водних розчинів поліакрилової кислоти і полігліколевих етерів додецилового спирту з високим ступенем оксиетилювання. Але для цієї системи ефект збільшення в’язкості при значному вмісті ПАР викликане появою сильної гідрофобної взаємодії між компонентами комплексу в додаток до водневих зв’язків, що утворилися.
Можлива і тільки гідрофобна взаємодія молекул ПАР з поліелектролітами. В цьому випадку така взаємодія стимулює розгортання макромолекулярного клубка і покращення розчинності поліелектроліту. Але ступінь проявлення цього ефекту залежить від багатьох факторів - природи (дифільності, типу функціональних груп) поліелектроліту і ПАР, молекулярної маси полімеру , співвідношення концентрацій поліелектроліту та ПАР в розчині, температури, рН, тощо.
Взаємодія поліелектролітів з барвниками.
 Ряд катіонних барвників змінюють своє забарвлення в розчині при збільшенні концентрації останнього. Причиною цього є утворення димерів та мультимерів з молекул барвника. Така ж зміна забарвлення водного розчину катіонних барвників має місце при додаванні до них водного розчину поліелектроліту, макромолекули якого є поліаніонами. Це явище носить назву метахромазія і пояснюється агрегуванням молекул барвника на полімерному ланцюгу. Метахроматичний зсув і доля молекул барвника, що агрегує на полімері, залежить не тільки від співвідношення кількостей барвника та полімеру, але й і від будови макромолекул.
Ряд катіонних барвників змінюють своє забарвлення в розчині при збільшенні концентрації останнього. Причиною цього є утворення димерів та мультимерів з молекул барвника. Така ж зміна забарвлення водного розчину катіонних барвників має місце при додаванні до них водного розчину поліелектроліту, макромолекули якого є поліаніонами. Це явище носить назву метахромазія і пояснюється агрегуванням молекул барвника на полімерному ланцюгу. Метахроматичний зсув і доля молекул барвника, що агрегує на полімері, залежить не тільки від співвідношення кількостей барвника та полімеру, але й і від будови макромолекул.
Так, наприклад, концентрація поліметакрилової кислоти впливає на інтенсивність люмінесценції водного розчину барвника – родаміну 6Ж, що ілюструє рис.75.
Зміна оптичних властивостей розчинів іоногенного барвника, що люмінесцює, при зміні концентрації кислого поліелектроліту пов’язана з утворенням сумісних агрегатів полімеру та барвника різної будови, один з яких люмінесцює інтенсивно, а інші до люмінесценції не здатні.
Роль будови макромолекул можна простежити на зв’язуванні метил-, етил- та пропілоранжу полікатіонами в залежності від природи бокового замісника.
Полікатіони, що досліджувалися, мають структуру:

де R1 та R2 відповідно -СН3 та -СН3, -С2Н5 та -С2Н5, -СН3 та -СН2С6Н5,
-СН3 та -СН2С6Н4С12Н25.
Зв’язування полікатіону з R1 та R2 , які є, відповідно, -СН3 та -СН3 групами , при рН=7 росте при переході від метил- до етил- і далі до пропілоранжу. Підсилення зв’язування метилоранжу при переході до полі катіону з більш гідрофобними групами відображується в збільшенні константи зв’язування. Спектр поглинання метилоранжу в комплексі з полікатіоном, що містить групи -СН2С6Н4С12Н25 , різко відрізняється від спектрів іншіх комплексів наявністю нового піку при ≤ 437 нм, який інтерпретується як прояв кооперативності зв’язування через асоціацію барвника та підсилення взаємодії компонентів за рахунок додецилбензильних груп. Наведені дані показують важливу роль гідрофобних взаємодій поруч з електростатичними в процесах асоціації полікатіону з барвником.
Застосування поліелектролітів.
Поліелектроліти використовують як реагенти в процесах збагачення мінеральної сировини, речовини для стабілізації бурових рідин та підвищення нафтовіддачі, для боротьби з ерозією грунтів.
Широке застосування поліелектроліти знайшли як стабілізатори колоїдних систем у харчовій та парфумерній промисловості, для покращення властивостей волокон та паперу через високу їх спорідненість з текстильними барвниками, як повітропроникні покриття та шпалери, для вирішення екологічних проблем, наприклад, для очистки промислових та побутових стічних вод.
В медицині поліелектроліти використовують для хірургічного одягу, а також як ефективні фізіологічно активні сполуки, наприклад, при конструюванні високоактивних штучних антигенів та створення на їх основі вакцин. Крім того, ряд поліелектролітів (зокрема, полівінілпіролідон) використовують для детоксикації крові від іонів важких металів. На основі полімерів, що містять гуанідинові групи, створено високоефективні антисептики, що набули широкого вжитку як самі по собі, так і в різноманітних композиціях. Біологічна сумісність поліелектролітів дозволяє використовувати їх при створені штучних судин, клапанів серця, контактних лінз, як м’язово-тканинні замінювачі, а також як перев’язуючи матеріали.
Широко використовуються поліелектроліти в процесах очистки та знезараження води. В цій галузі вони застосовуються як флокулянти (поліакрилова кислота, поліакриламід), іонообмінні матеріали, поверхнево-активні речовини (в процесі флотаційної очистки води), знезаражуючі реагенти та реагенти комплексної дії. Наприклад, полігексаметиленгуанідин знайшов широке використання як знезаражуючий флокулянт з комплексоутворюючими властивостями.
Полікомплекси на основі поліелектролітів мають значну проникність для води і контрольовану селективну проникність для інших речовин, що знаходяться в розчині. Це дає можливість застосовувати їх як мембрани при ультрафільтрації. Плівки з полікомплексів, що мають високу електропровідність, застосовують в електротехнічній промисловості як антистатичні покриття. Крім цього такі плівки можуть використовуватися як детектори вологи.
Перспективні застосування поліелектролітів і для створення пошарових покриттів. Для цього заряджений об’єкт вносять в розчин поліелектроліту з протилежним зарядом. Поліелектроліт починає осаджуватися на поверхню доки не відбудеться перезарядка поверхні. Після чого об’єкт переносять в розчин іншого поліелектроліту, що має протилежний заряд. Процес повторюють стільки разів, скільки потрібно для одержання багатошарового покриття. Перевагою цього методу є те, що можна досить точно регулювати товщину шару покриття.
Література.
1.Цветков В.Н., Эскин В.Е., Френкель С.Я. Структура макромолекул в растворах.- М., 1964, 720с.
2. Твердохлебова И.И. Конформация макромолекул (вискозиметрический метод оценки)- М.:Химия,1981.-284с.
3. Тагер А.А. Физико-химия полимеров.-3-е изд.,-М.:Химия,-1978. -544с.
4. Е.А.Бектуров, Р.Е.Легкунец Ассоциация полимеров с малыми молекулами.
-Алма-Ата:Наука,1983.-208с.
5. С.Кудайбергенов,Е.Бектуров,Ш.Шаяхметов Физическая химия растворов полимеров.-Алматы: Санат,1995.-244с.
6. Будов В.П. Физическая химия растворов полимеров.- Санкт-Петербург:1992, 384с.
7. ГросбергА.Ю.,Хохлов А.Р. Статистическая физика макромолекул.-М.:Наука,1989,344с.
8. Моравец Г. Макромолекулы в растворе.М.:Мир,1967,398с.
9. Вшивков С.А. Методы исследования фазового равновесия растворов полимеров.-Свердловск,1991,98с.
10. Нестеров А.Е., Липатов Ю.С. Термодинамика растворов и смесей полимеров. – Киев.Наукова Думка,1984,300с.
11. Нестеров А.Е., Липатов Ю.С. Фазовое состояние растворов и смесей полимеров. –Киев.Наукова Думка,1987,167с.
12. Эскин В.Е. Рассеяние света растворами полимеров.-М.:Наука,1973,350с.
13. Платэ Н.А., Литманович А.Д., Ноа О.В. Макромолекулярные реакции.-М.:Химия,1977.272с.
14. Хартли Ф., Бергес., Очкок Р. Равновесия в растворах.-М.:Мир,1983,360с.
15. Зезин А.Б., РогачеваО.А. Полиелектролитные комплексы. В кн.Успехи химии и физики полимеров.-М.Химия, 1973.-С.3-23.
16. Бектуров Е.А., Бимендина Л.А. Интерполимерные комплексы.-Алма-Ата: Наука (Каз.ССР).-1977.-С.5-43.
