 |
|
Комплексные соединения.
Комплексные соединения образуются в результате соединения нескольких молекул сложных веществ в одну.
CO2+H2O=H2CO3
Cr(OH)3+3KOH=K3[Cr(OH)6]
Согласно координационной теории К. С. Варнера в каждом КС различают центральный атом или ион (комплексообразователь КО), вокруг которого располагаются (координируются) несколько молекул или ионов противоположного знака (лиганды)
КО с расположенными вокруг него лигандами составляют внутреннюю сферу КС, ей обычно заключают в []; число, показывающее сколько лигандов расположено вокруг КО называется координационным числом (КЧ), КЧ=2,4,6, реже 3,5,8,12, оно обычно чётное, реже нечётное или больше 6
Поляризующее действие (ПД) – способность ионов данной частицы притягивать электронную оболочку другой частицы. Сильнее всего ПД у положительных ионов. 
Тип i 8e (8+n)e (18+n)e 18c
 ПД
ПД
Комплексообразователи могут быть:
1.Mez+ с большим ПД: Cd2+, Fe3+, Pt4+, Al3+, Hg2+, Ag+…
2.атомы неметаллов положительных степеней окисления: B3+, N5+, S6+, Cl7+ (BO33-, NO3-, SO42-, ClO4-)
3.редко отрицательные ионы: N3-, O2-, (NH4+, H3O+)
4.редко атомы d-электриков: Cr, Fe, V, Ni, [Fe(CO)5]
Лигандами являются:
1.отрицательные ионы: OH-, CN2-, SCN-, Г- (F-, Cl-, Br-, I-), S2-, CO3, SO42-.
2.полярные молекулы: NH4, H2O, NO, CO, PH3…
3.редко положительные ионы: H+ (NH4, H3O+)
Диссоциация КС.
КС могут быть электролитами или неэлектролитами. К неэлектролитам относят соединения без внешней сферы. [Pt(NH3)2Br4], [Fe(SCN)3]
Комплексные электролиты в водных растворах диссоциируют на комплексный ион и ионы внешней сферы по типу сильных электролитов, т.е. необратимо и нацело.
[Ag(NH3)2]Cl=[Ag(NH3)2]++Cl-
Комплексный ион в свою очередь тоже диссоциирует, однако весьма незначительно, на комплексообразователь и лиганды.
[Ag(NH3)2]+ →← Ag++2NH3
 Чес меньше коэффициент нестойкости, тем устойчивее комплексный ион.
Чес меньше коэффициент нестойкости, тем устойчивее комплексный ион.
Если Кнест большой, то имеем не комплексную, а двойную соль – диссоциирует на все ионы.
Для разрушения комплексных соединений необходимо сместить равновесие в противоположную сторону:
[Zn(OH)6]2- →← Zn2++4OH-
 |
равновесие
равновесие сместится при добавлении HCl (↑CH+=↓COH-)
Комплексные кислоты, основания и соли как правило сильные электролиты и более сильные чем соответствующие им простые.
Cu(OH)2 и [Cu(NH3)4](OH)2
r катиона à
ПД ß
Сила основания à
Вода.
В строительстве воду применяют для замешивания цемента, извести, глины. Природные воды воздействуют на строительные сооружения, вызывая их коррозию (разрушение) как в наземных, так и в подземных (подводных) частях. При работе на мёрзлых грунтах имеют дело со льдом, как со своеобразным компонентом горной породы, лежащем в основе сооружений.
Свойства воды:
Физические:
а) соединение без вкуса, запаха и цвета
б) во многих отношениях отлична от других жидкостей
в) ρ воды при охлаждении падает => замерзание воды в трубах может привести к разрыву стальных труб; лёд в трещинах строительных сооружений приводит к разрушению; особо этому процессу благоприятствует чередование положительных и отрицательных температур (днём «+», ночью «—»; чередование оттепели и заморозка)
г) аномально высокая теплоёмкость: CH2O=4,18 Дж/г*к (это благоприятно сказывается на температуре Земли: накопленное днём (летом) тепло медленно отдаётся окружающей среде ночью (зимой).
Д) аномально высокие температуры плавления и кипения
 μ=1,86 Д => высокая химическая активность
μ=1,86 Д => высокая химическая активность
Н  хороший лиганд Н2О
хороший лиганд Н2О
 О
О  хороший донор
хороший донор
Аномалии физических свойств воды объясняются ассоциацией молекул воды за счёт водородной связи.
ВС- связь водорода с сильно электроотрицательными элементами. (с O, F, Cl, N)
H+ т.к. нет электронной оболочки, проникает в чужую не испытывая сил отталкивания => даёт доп. Связь
ВС на порядок сильнее ковалентной связи, но слабее электромагнитной.
Диаграмма состояния воды
 Тк и Рк – критические температура и давление выше которых ни при каких Т и Р нельзя перевести пар в жидкость и наоборот.
Тк и Рк – критические температура и давление выше которых ни при каких Т и Р нельзя перевести пар в жидкость и наоборот.
 Тройная точка О-в ней все 3 фазы находятся в равновесии.
Тройная точка О-в ней все 3 фазы находятся в равновесии.
Диаграмма водно-солевого раствора
К - криогидратная точка
Химические
Н2О может быть окислителем и восстановителем: Н2О+F2→2HF+1/2 O2
(-) Анод: 2 Н2О-4е= O2+4Н+
Н2О= Н++OH-
Концентрация ионов Н+ в воде 1*10-7 моль/л
Оксиды многих металлов взаимодействуют с H2O: SO3+H2O= Н2SO4
Соли в результате взаимодействия с водой могут подвергнуться гидролизу или гидратации
Na2CO3+10 H2O= Na2CO3ּ10 H2O
Вода катализирует очень многие реакции: Me+Cl2; Na+O2; HF+стекло.
Жёсткость воды:
Природные воды очень сильно отличаются по своему составу (содержанию ионов растворимых веществ); это сказывается на коррозии металлов, бетона, природных каменных материалов.
Жёсткость обуславливают наличием ионов Ca2+ и Mg2+
 мягкая <3 мэкв/л, жёсткая >6(8) мэкв/л
мягкая <3 мэкв/л, жёсткая >6(8) мэкв/л
Жёсткая вода даёт накипи на паровых котлах, вызывая перерасход топлива и создавая угрозу взрыва
Жёсткость: временная (Ca(HCO3)2, Mg(HCO3)2); постоянная (Ca2+ ,Mg2+, Cl-, SO42-)
Ca(HCO3)2→t CaCO3↓+CO3+H2O
Н2Оможно умягчить ионно-обменными смолами (высоко молекулярные в-ва, спос. обмениваться с окр. средой) ВМС (аниониты, катиониты)
| Опреснение: H+форма→ H+ |
| OH-форма→OH- H2O |
NaR+MgSO4=Na2SO4+MgR2
Углерод и кремний
С, Si  степень окисления 2,4
степень окисления 2,4
R атома à
Восстановительные свойства ß
Нахождение в природе:
Углерод: уголь, нефть, газ, атмосфера (CO2 0,03%), известняк, мрамор мел (CaCO3), MgCO3-магнезит, CaCO3ּMgCO3 — доломит
Кремний: (2е место после кислорода по распространению, его значение в минеральном мире как у углерода в органическом) SiO2, горный хрусталь, силикаты в горных породах (асбест, каолин, глины).
Получение: С-добыча полезных ископаемых;
Si - SiO2+C+Fe→(эл. печь)ферросилиций (25% Fe), технический Si (2-5 % Fe)
SiO2+Znпар→t ZnO4+Si
SiO2+Mg→t MgO+Si
Использование:
С – присуща аллотропия: графит,алмаз,карбид, фуллерен (60С, 70С),инертен,активность проявляет при ↑Т
С+(S, Cl2, Me, O2)→t (+) C+O2→t CO2; C+O2 нед→CO+CO2
 СО+Н2О
СО+Н2О


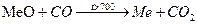 ; CO2: O=C=O (неполярная молекула)
; CO2: O=C=O (неполярная молекула)
Получение:
- лаборатория: СаСО3+2HCl=CaCl2+H2CO3 (CO2+H2O)
- Термическим образом: CaO+CO2
 CaCO3
CaCO3
§ Растворение в Н2О: CO2+H2O→←H2CO3
| (Ca(OH)2+CO2→CaCO3↓+H2O CaCO3↓+H2O+CO2→Ca(HCO3)2) | à лежит в основе разрушения горных пород и строит. камней |
CaO+H2O=Ca(OH)2
Na2CO3 – сода, (моющие ср-ва)
(CuOH)2CO3- малахит
Si- аморфный (химически более активная форма), кристаллический.
Si- полупроводник, под влиянием тепла валентные электроны могут стать электронами проводимости, обуславливая n-проводимость (negative) электронная, освободившиеся от электронов места обуславливают p-проводимость (positive). У химически чистого кремния n- и p-проводимость равны, однако пользуясь различными добавками можно изменять их соотношение: (Si(4e)+B(3e))—дефицит электронов, ↑p-проводимость; (Si(4e)+P(5e))— дефицит дырок, ↑n-проводимость.
При высоких t Si является очень сильным восстановителем, его применяют металлурги для удаления из расплавов Ме растворённого в нём О2. Кремний стоек ко всем кислотам, кроме плавиковой, не устойчив к водным растворам щёлочи.

Si +4HF=SiF4+2H2↑
Si+2NaOH+H2O=Na2SiO3+2H2↑
O2: SiO, SiO2(наиболее распространён в природе); SiO2+Si=2SiO.
 в результате объединения тетраэдров образуются замкнутые кольца. Для разрушения SiO2 надо разрушить очень много прочных связей Si-O. В зависимости от пространственного расположения тетраэдров SiO4 существуют различные полиморфные состояния SiO2: кварц→← тридимит →← кристоболит(химическая активность ↑ от кварца к кристоболиту)
в результате объединения тетраэдров образуются замкнутые кольца. Для разрушения SiO2 надо разрушить очень много прочных связей Si-O. В зависимости от пространственного расположения тетраэдров SiO4 существуют различные полиморфные состояния SiO2: кварц→← тридимит →← кристоболит(химическая активность ↑ от кварца к кристоболиту)
SiO2+HF→SiF4+H2O
SiO2+NaOH→Na2SiO3+H2O
SiO2+Na2CO4→ Na2SiO3+CO2
Растворимы в воде.
(Na2SiO3+K2 SiO3)-канцелярский клей, применяют строители для укрепления слабых грунтов и для изготовления кислородного цемента.
| Na2SiO3+H2O→← Na2SiO5+NaOH 2 SiO32-+H2O→← SiO52-+2OH- | pH>7 |
Na2SiO3+2HCl= Na2SiO5↓(очень слабая желеобразная кислота)+ 2NaCl
В зависимости от условий получения можно получить:
H2SiO3 (SiO2∙H2O)-метакремниевая кислота
H2SiO4 (SiO2∙2H2O)-ортокремневая кислота
H2Si2O5 (2SiO2∙H2O)-диметокремневая кислота
Кремниевые кислоты поляризуются, их состав неизвестен. (x SiO2∙yH2O)
 H6Si2O7
H6Si2O7
C учётом поляризации:
Na2SiO3+H2SO4+H2O→x SiO2∙yH2O+ Na2SO4
Если полученный гель кислоты промыть водой от Na2SO4 и высушить, то получатся прозрачные пластинки силикагеля. Это прекрасный поглотитель влаги, обладает ионно обменными свойствами, применяют как носитель катализатора.
Взаимодействия SiO2+CaO (песок и известью). Эти процессы лежат в основе получения и применения цемента
CaSiO3 (SiO2∙H2O)-метасиликат кальция
Ca2SiO4 (SiO2∙2H2O)-ортосиликат кальция
Ca3SiO5 (2SiO2∙H2O)-3х кальциевый силикат
Ca3Si2O7 (SiO2∙H2O)- 3х кальциевый дисиликат
При наличии H2O происходит гидролиз или гидратация.
CaSiO3 +(n+1) H2O →Ca(OH)2+SiO2 ∙n H2O гель
Ca2SiO4+m H2O = CaSiO4∙ m H2O
В результате гидролиза получаются зёрна малорастворимого Ca(OH)2, вокруг которых накапливается студенистый гидросиликат и кремниевые кислоты, полученная пастообразная масса затвердевает, схватывается, благодаря наличию молекул H2O, которые склеивают полученные гидросиликаты.
Силикаты, содержащие Al, называются алюмосиликаты, в них Al заменяет часть кремния в тетраэдрах SiO4.
Алюмосиликаты K+, Na+, Ca+ называют полевыми шпатами (50% земной массы): глины, граниты, слюда.
Некоторые алюмосиликаты обладают ионно обменными свойствами.
Стекло: SiO2+Na2CO3+CaCO3  Na2O∙CaO∙6SiO2+CO2
Na2O∙CaO∙6SiO2+CO2
SiO2 – кварцевое стекло, коэффициент линейного расширения = 0, раскалённое до красна на трескается в холодной воде, пропускают кварц, если добавить В2О3 или Na2B4O7-оптическое стекло.
Применение:
· Стекловата, теплоизоляционный материал
· Стекло аморфно, но в результате некоторых добавок может закристаллизоваться, получают ситалл, применяют в качестве изоляторов в химической промышленности
· Глины: трудно растворимые осадочные породы, получаются в результате разрушения горных пород, содержат силикаты и алюмосиликаты, применяют в производстве цемента, керамики, фарфора. Керамика – изделия из глины с добавкой оксидов и карбидов некоторых металлов для прочности. Эмаль – тонкое стеклянное покрытие, предохраняет керамику от коррозии и придаёт декоративный вид.
· Цемент – получают спеканием глины с известняком (глина + известняк)  (глина + CaO)+CO2↑
(глина + CaO)+CO2↑
(цемент + H2O)→цементный раствор
цементный раствор+щебень (гравий)→бетон–чрезвычайно прочная конструкция.(бетон + Fe→железобетон)
фторосиликаты: SiO2+4HF=SiF4+2H2O
SiF4+4HF=H2[SiF6] – кремнистофтороводородная кислота, НF – слабая кислота.
Mg2+,Ca2+,Fe3+,Zn2+хорошо растворимы в воде, большое практическое применение в процессе флюатирования
Mg[SiFe]+2CaCO3+nH2O→MgF2↓+CaF2↓+SiO2∙nH2O (гель)+2СО2↑
Таким образом предохраняют камни
SiO2+C (кокс)  SiC (карборунд – по структуре алмаз, половина атомов С заменена на кремний.)
SiC (карборунд – по структуре алмаз, половина атомов С заменена на кремний.)