 |
|
Защита Ме от коррозии
1) Защитные покрытия: неМе – лаки, краски, эмаль, резина, пластмасса; Ме - анодные Fe/Zn в кислой среде или Fe/Sn в кисл среде
2) изменение состава среды или состава ме
- в среду , где работают Ме конструкции, вводят ингибиторы – замедлители коррозии – Na2CrO4, альдегиды
- анодирование, воронение, азотирование, фосфотирование – создание на поверхности ме защитной пленки из соединений этого же ме
3) электрохимические методы защиты
- протекторная защита (протектор – специальный анод из более активного ме, который прикрепляют к защищаемому изделию. Протектор, разрушаясь , защищает Ме конструкцию от коррозии)
- электрозащита (защищаемую конструкцию присоединяют к «-»внешнего источника постоянного тока, а к «+» присоединяют кусок стального Ме(рельс, балка) поддержка оптимального напряжения - защита от коррозии)
Электролиз- ОВР , протекающая при пропускании постоянного тока через электролит. Анионы к аноду, катионы – к катоду. Анод (+) – окисление, катод (-) восстановление. Потенциал разряда ионов зависит от материала электрода, плотности тока. Состояния поверхности. Разность между фактическими потенциалом разряда иона и его теоретическим( рассчитанным по уравнению Нернста значением называется перенапряжением.η=φфакт-φтеор , η- дополнительное напряжение, которое необходимо дать для преодоления побочных процессов. Особо высокое перенапряжение сопровождает разряд ионов газа. Для ме им можно пренебречь, для газов очень большое.
Катодное η - смещение потенциалов катода в сторону отрицательных значений, анодное  - смещение потенциала анода в сторону положительных значений. Из-за перенапряжения идет увеличение по модулю
- смещение потенциала анода в сторону положительных значений. Из-за перенапряжения идет увеличение по модулю 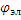
При электролизе водных растворов необходимо учитывать возможность разряда ионов среды. 1) электролиз с нерастворимым анодом
А) электролиз водного раствора HCl c Pt электродами
HCl=H+ +Cl-
H2O=H+ +OH-
Катод(-) : 2H+ +2e- = H2 Анод(+) 2Cl- - 2e- = Cl2
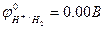


 С учётом перенапряжения О2.
С учётом перенапряжения О2.
На катоде всегда в первую очередь разряжаются те катионы, потенциал которых больше по своему алг значению ( с учетом знака), т.е более сильные окислители восстанавливаются первыми
На аноде окисление, в первую очередь окисляются те анионы, потенциал разряда которых меньше по своему алг значению , т.е более сильные восстановители окисляются в первую очередь.
Б) электролиз водного раствора ZnSO4 с графитовыми электродами
ZnSO4= Zn2+ + SO42-
H2O=H+ +OH-
Катод (-) Zn+2 +2e- = Zn Анод(+) 2H2O – 4e- = O2 +4H+

 С учётом перенапряжения О2.
С учётом перенапряжения О2.
 С учётом перенапряжения водорода
С учётом перенапряжения водорода 
2) Электролиз с растворимым анодом. Применяют при рафинировании Ме от примесей а также при нанесении Ме покрытий
(-) Zn-2e=Zn+2
Fe-2e=Fe2+
Cu-2e=Cu+2
(+) Cu+2 +2e=Cu
Напряжение на ванне поддерживается таким образом, чтобы Ме, расположенные в ряду стандартных потенциалов после меди. Не смогли раствориться. Поэтому они выкрашиваются в виде шлама на дно ванны. На катоде получили чистейшую медь. Процесс сводится к переносу Ме с анода на катод
Электролиз распавов. Им получают активные Ме. Т. к здесь нет конкурирующих ионов воды . Основным законом электролиза является закон Фарадея - для того, чтобы выделить в процессе электролиза 1 грамм- эквивалент любого в-ва необходимо затратить одно и то же кол-во электричества, а именно 96500 Кл
 m- масса I – сила тока τ- время в секундах F- постоянная Фарадея Э- эквивалентная масса продукта электролиза, Э=атомная масса/валентность
m- масса I – сила тока τ- время в секундах F- постоянная Фарадея Э- эквивалентная масса продукта электролиза, Э=атомная масса/валентность
Семейство железа.
7-В группа
Fe Co Ni-семейство железа
Ru Rh Pd-Pt Ме
Os Ir Pt-вые
Техническое значение имеют Fe Co Ni(тк более доступны)
Fe 3d^6 4s^2
Co 3d^7 4s^2
Ni 3d^8 4s^2
Максимальная степень окисления Fe=+6,макс степень ок-я Co Ni=+4
Fe Co Ni
Химическая активность

(самый активный)
Физические свойства: серебристо-белые, ковкие Ме, Fe-мягкое, Co Ni-твердые как сталь. Они ферромагнетики,те намагничиваются. Характерно для сем-ва Fe(чистых элементов).
В зав-ти от своего отношения к внешнему полю пост.магнита,в-ва делятся на диамагнетики и парамагнетики.ДМ-оказывают сопротивление прохождению силовых линий магнитного поля больше,чем вакуум.Поэтому они становятся перпенд-но силовым линиям мп(оно их выталкивает)ПМ-наоборот,проводят сил.линии мп лучше вакуума,поэт мп их втягивает.они распологаются парал-но сил.линиям мп.Такое различн.поведение в-в во внешнем поле пост.магнита обусловлено строением электронных оболочек.У ПМ есть неспаренные электроны и они имеют собственный магнитный момент. У ДМ все электроны спарены(их спины скомпенсированы и собств.магн.момент равен 0)
Н-парамагнетики, O2,No,NО2,K,Pt
H2-диамагнетики, H2O,N2,CО2,Ar
Ферромагнетизм-крайний случай сильно выраж-го парамагнетизма. Ферромагнетизм обусловлен не строением Эл.оболочки,а явл-ся св-ом крист.решетки. Если нагреть намагниченный Ме в т.Кюри он размагничевается.