 |
|
Двойной электрический слой на границе « металл – раствор»
При погружении Ме платины ( электрода) в раствор соли данного Ме может происходить один из 2 процессов:
1) Если Ме актив восст, то под действием диполей воды некоторая часть атомов Ме оставляет свои электроны на электроде и в виде гидратированных ионов переходит в раствор:
Me +mH2O = Me(n+)*mH2O +ne-
Или без учета гидратации ионов :
Me=Me(n+) +ne-
В результате этого процесса окисления Ме пластинка заряжается отрицательно, а катионы Ме притягиваются к ней, и поэтому прилегающий к пластинке слой раствора заряжается положительно. Таким образом на границе «Ме-раствор» возникает двойной электрический слой(ДЭС)
2) Если сам Ме является слабым восст, то его ионы, содержащиеся в растворе соли, являются сильными окислителями. Некоторая часть этих ионов подходит к поверхности Ме пластины и восст за счет имеющихся в ней свободных электронов
Me(n+) + ne- = Me
В результате осаждения катионов пластина Ме заряжается положительно и притягивает к себе отриц заряженные анионы. Поэтому прилегающий к пластине слой раствора заряжается отрицательно. Таким образом и в этом случае возникает ДЭС.
Разность потенциалов, возникающая в ДЭС на границе «Ме-раствор», называется электродным потенциалом.
Зависимость электродного потенциала от концентрации раствора выражает уравнение Нернста

R – универсальная газовая постоянная , Т – абсолютная температура, Z- заряд иона Ме, F – постоянная Фарадея=96500 кл/моль, С – концентрация ионов ме в растворе
Потенциал зависит от природы, температуры и концентрации. Пусть 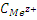 в растворе = 1 моль/литр, тогда
в растворе = 1 моль/литр, тогда  , φ0 – стандартный электродный потенциал
, φ0 – стандартный электродный потенциал

В настоящее время измерить абсолютное значение эл. Потенциала нельзя, однако можно измерить разность потенциалов, возникающую при составлении элемента из 2 электродов. Поэтому условились считать потенциал водородного электрода в стандартных условиях равным 0. Водородный электрод представляет собой платиновую пластинку, насыщенную водородом (при атмосферном давлении) и погруженную в раствор, содержащий ионы водорода. Тогда ЭДС элемента, составленного из нормального водородного электрода и данного электрода численно равна электродному потенциалу.
Ов потенциалы- в ОВР передача электронов от в-ля к ок-лю обычно происходит при непосредственном контакте реагирующих в-в. При этом энергия хим реакции превращается в тепловую. Однако процессы ок-ия и восст-ия можно пространственно разделить . так чтобы электроны передавались от в-ля к ок-лю через Ме проводник, тогда Е хим р-ии превратится в электрическую. Для этого необходимо в растворы , содержащие соответственно ок-ль и в-ль опустить инертные электроды( которые не дают своих ионов)( платина, золото, графит)
Замыкая электроды и электролит, получают ток. На платиновых электродах возникает потенциал о/в, величина которого будет определяться соотношением концентрации окисленной и восстановленной формой в-ва по уравнению 
Если Сок=Свосст, то  ( стандартный ок-восст потенциал) Реакция возможна, только если
( стандартный ок-восст потенциал) Реакция возможна, только если 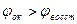 , элемент работает при условии, что его эдс положительна. Эдс =
, элемент работает при условии, что его эдс положительна. Эдс = 