 |
|
Характерные степени окисления.
| +5 | +3 | +1 | -3 |
| Оксид: P2O5 Кислоты: HPO3 (метафосфорная кислота) H4P2O7 (пирофосфорная кислота) H3PO4 (ортофосфорная кислота) Соли: фосфаты Ca3(PO4)2 Гидрофосфаты К2НРО4 Дигидрофосфаты КН2РО4 Галогенангидриды: PОCl3, PCl5 | Оксид: P2O3 Кислота: H3PO3 - двухосновная фосфористая Соли: фосфиты Na2HPO3 Галогенангидрид: PCl3 | Кислота: H3PO3 - одноосновная фосфорноватистая Соль: гипофосфит NaH2PO2 | Фосфиды металлов: Ca3P2 Водородное соединение: фосфин PH3 |
ВАЖНЕЙШИЕ АЛЛОТРОПНЫЕ МОДИФИКАЦИИ.
Белый фосфор. Состоит из молекул P4. Мягкое, бесцветное вещество, ядовит, имеет чесночный запах, t пл.= 44°С, летуч. Молекулярная кристаллическая решетка. Очень реакционноспособен, самовоспламеняется на воздухе, в темноте светится.

| Красный фосфор. Без запаха, цвет красно-бурый, не ядовит. Атомная кристаллическая решётка. Устойчив. В темноте не светится. Образуется из белого фосфора при t=250-3000 без доступа воздуха.
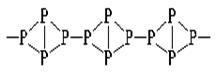
| Чёрный фосфор – полимерное вещество с металлическим блеском, похож на графит, без запаха, жирный на ощупь. Атомная кристаллическая решётка, полупроводник, устойчив. |
Нахождение в природе
Встречается только в виде соединений. В основном это фосфаты (например, Ca3(PO4)2) и апатиты 3Ca3(PO4)2*СаF2
ПОЛУЧЕНИЕ:
Белый фосфор получают восстановлением фосфата кальция (сплавление в электрической печи):
Ca3(PO4)2 + 3SiO2 + 5C(спл) = 3CaSiO3 + 5CO + 2P .
Красный и черный фосфор получают из белого.
ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА.
| 1. Реакции с кислородом: | 4P + 5O2 = 2P2O5 4P + 3O2 = 2P2O3 |
| 2. С галогенами и серой: | 2P + 3Cl2 = 2PCl3 2P + 5Cl2 = 2PCl5 2P + 5S = P2S5 |
| 3. С азотной кислотой: | 3P + 5HNO3 + 2H2O =3H3PO4 + 5NO |
| 4. С металлами образует фосфиды, в которых фосфор проявляет степень окисления -3: | 2P + 3Mg = Mg3P2 3Li + P = Li3P |
| 5. Со щелочью (диспропорциронирование: | 4P + 3NaOH + 3H2O = PH3 + 3NaH2P+1O2 (гипофосфит натрия) |
| 6. С водородом непосредственно не взаимодействует. |
Фосфиды металлов.
| Получение: 2P + 3Mg = Mg3P2 | Свойства: Разлагаются водой и кислотами: Ca3P2 + 6HCl = 3CaCl2 + 2PH3 Mg3P2 + 6H2O =3Mg(OH)2 + 2PH3 |
ФОСФИН PH3 – газ, с неприятным запахом, бесцветный, мало растворим в воде, нестоек, ядовит. Водородные связи между молекулами фосфина не образуются.
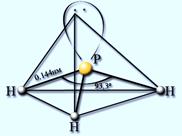
| Получение: из фосфидов: Ca3P2 + 6HCl = 3CaCl2 + 2PH3 Ca3P2+ 6H2O = Ca(OH)2+ 2PH3 | Свойства: 1) Разлагается при нагревании: 2PH3 = 2P + 3H2 2) Проявляет очень слабые основные свойства: PH3 + HI = [PH4]+I- йодид фосфония – менее устойчив, чем соли аммония. 3) Сильный восстановитель. На воздухе самовоспламеняется: 2РН3 + 4О2 = Р2О5 + 3Н2О или РН3 + 2О2 = H3PO4 |
P2O3 - Фосфористый ангидрид (оксид фосфора (III)).
Белые кристаллы, в парах состоит из молекул P4O6. Кислотный оксид.
| Получение. Окисление фосфора при недостатке кислорода: 4P + 3O2 = 2P2O3 | Химические свойства. 1. Кислотный оксид ДВУХОСНОВНОЙ фосфористой кислоты: P2O3 + 3H2O = 2H3PO3 P2O3+ 4NaOH = 2Na2HPO3+ H2O 2. Сильный восстановитель: O2 + P2O3 = P2O5 |
H3PO3 Фосфористая кислота
Бесцветное кристаллическое вещество, хорошо растворимое в воде.
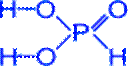 Получение: гидролиз хлорида фосфора (III) или реакция оксида фосфора (III) с водой.
Получение: гидролиз хлорида фосфора (III) или реакция оксида фосфора (III) с водой.
PCl3+ 3H2O =H3PO3+ 3HCl
P2O3 + 3H2O = 2H3PO3