 |
|
Приклади розв'язування задач
Приклад 1. Концентрація іонів водню у розчині дорівнює 4*10-3 моль/л. Визначити рН розчину.
Розв'язування: pH = -lg[H+] = -lg 4*l0-3 = 3 – lg 4 = 2,4.
Приклад 2. Визначити концентрацію іонів водню у розчині, рН якого дорівнює 4,6.
Розв'язування: pH = -lg [H+], звідки -lg [H+] = pH, -lg[H+] = 4,6, тоді lg[H+] = -4,6 = -5,4. Звідки [H+]=2,5*10-5 моль/л.
Приклад 3. Чому дорівнює концентрація розчину оцтової кислоти, рН якої становить 5,2?

Розв'язування: рН= -½lgКа – ½lgСs = ½рКа – ½lgСs, lgC = (-½lgK – pH)*2, lgC = (-½lg1,76 – ½lg10-5 – 5,2)*2=-0,24+5-10,4=-5,64, lg C=6,34, C=2,35*10-6.
Розв'язуючи варіанти контрольних завдань, слід пам’ятати, що з точки зору протолітичпої теорії:
Ø кислота — це речовина (частинка), що здатна віддавати протон (донор протонів);
Ø основа — це речовина (частинка), що здатна приєднувати протон (акцептор протонів).
Ø гідроліз — це окремий випадок реакції протолізу і його механізм для різних типів сполук буде різним залежно від того, катіон чи аніон солі, яка піддається гідролізу, бере участь у реакції.
Гідроліз за катіоном (гідроліз катіонів). Катіони металів існують у водних розчинах у вигляді аквакомплексів певного складу. Наприклад: [Сu(Н2O)4]2+, [Сr(Н2О)6]3+ тощо, у яких молекули води зв'язані з центральним атомом (катіоном металу) ковалентними зв'язками, утвореними за донорно-акцепторними механізмами (катіон — акцептор, молекули води — донори електронних пар). Далі гідратація таких аквакомплексів молекулами води здійснюється за рахунок водневих зв'язків.
Приклад 4. Як відбувається гідроліз водного розчину CuSO4?
Розв'язування: Мідь (II) сульфат у водному розчині дисоціює на іони: CuSO4  Cu2+ + SO42-, іон Cu2+ утворює з молекулами води аквакомплекс: Сu2+ + 4Н2O
Cu2+ + SO42-, іон Cu2+ утворює з молекулами води аквакомплекс: Сu2+ + 4Н2O  [Сu(Н2O)4]2+. Щоб пояснити механізм гідролізу за катіоном, необхідно з'ясувати вплив центрального атома Сu2+ на одну із координованих біля нього молекул води і молекули води, яка зв'язана слабшим водневим зв'язком у гідратній оболонці (за схемою):
[Сu(Н2O)4]2+. Щоб пояснити механізм гідролізу за катіоном, необхідно з'ясувати вплив центрального атома Сu2+ на одну із координованих біля нього молекул води і молекули води, яка зв'язана слабшим водневим зв'язком у гідратній оболонці (за схемою):

Центральний атом поляризує зв’язок -О-Нδ+ у молекулі води, відштовхуючи від себе позитивно поляризований атом водню, що приводить до послаблення і розриву цього зв'язку зі зміцненням водневого зв’язку і перенесенням протону на молекулу води у гідратній оболонці (з утворенням Н3О+).
Таким чином, аквакомплекс у даній рівноважній системі виступає як донор протону, тобто як кислота (а1), якій відповідає спряжена основа (b1). Основою (b2) є молекула води (розчинника), якій відповідає спряжена кислота Н3О+ (а2). Вона обумовлює кисле середовище розчину.
Скорочено записують таким чином:

Слід пам’ятати, що гідролізу за катіоном піддаються солі, утворені слабкими основами, і тим більше, чим менше Кb (або більше pKb) основи. Солі, утворені сильними основами і сильними кислотами, гідролізу не піддаються.
Гідроліз за аніоном (гідроліз аніонів). Гідратація аніонів здійснюється за рахунок водневих зв’язків, утворених негативно поляризованим атомом аніона і попітнію поляризованим атомом водню молекули води у гідратній оболонці невизначеного складу (залежить від ряду умов).
Приклад 5. Як відбувається гідроліз водного розчину Na2CO3?
Розв'язування: Динатрій карбонат у водному розчині дисоціює на іони: Na2CO3  2Na+ + CO32-. Негативно заряджений CO32- притягує до себе позитивно поляризований атом водню молекули води, додатково поляризує її з перетворенням водневого зв’язку в ковалентний, при цьому протон переноситься від молекули води до аніона за схемою:
2Na+ + CO32-. Негативно заряджений CO32- притягує до себе позитивно поляризований атом водню молекули води, додатково поляризує її з перетворенням водневого зв’язку в ковалентний, при цьому протон переноситься від молекули води до аніона за схемою:

Скорочено записують так:

Реакція середовища лужна, що обумовлено нагромадженням у розчині іонів ОН-.
Слід пам’ятати: чим більший заряд і менший розмір аніона, тим більшою мірою сіль піддається гідролізу. Такі реакції найбільш характерні для аніонів CO32-, РО43-, SO32-, CN-, NO2-, СН3СОО- та інших, тобто гідролізу за аніоном піддаються солі, утворені слабкою кислотою і тим більше, чим менше Ка (або більше рКа) кислоти.
Для розрахунку ступеня гідролізу використайте закон розведення Оствальда:
 де h — ступінь гідролізу, Кг — константа гідролізу, С — молярна концентрація солі.
де h — ступінь гідролізу, Кг — константа гідролізу, С — молярна концентрація солі.
Для розрахунку константи гідролізу використовують формули:
якщо гідроліз відбувається за аніоном, то  ; якщо за катіоном, то
; якщо за катіоном, то  для солей слабкої кислоти і слабкої основи
для солей слабкої кислоти і слабкої основи 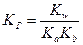 , де Кг, Кb, Ка — константа відповідно гідролізу, іонізації основи, іонізації кислоти (див. табл. 3).
, де Кг, Кb, Ка — константа відповідно гідролізу, іонізації основи, іонізації кислоти (див. табл. 3).
Для розрахунку рН солі, яка гідролізується, використовують формули:
а) pH=7 + ½pKa + ½lgСs
б) рН=7 - ½рКb - ½lgСs
в) рН=7 + ½рКа - ½рКb.
Контрольні питання
Скласти іонно-молекулярні рівняння гідролізу і визначити реакцію середовища наступних солей (відмітити значення рН=7, рН<7, рН>7):
241. АlСl3 (к.ч. — 6, де к.ч. — координаційне число), NaCN, K2SO4.
242. CuSO4 (к.ч. — 4), К2СО3, NaCl.
243. ZnCl2 (к.ч. — 4), K3PO4, NaNO3.
244. МgSO4 (к.ч. — 6), NaHCO3, Na2SO4.
245. FeCl3 (к.ч. — 6), КСlO, ВаСl2.
246. Cu(NO3)2 (к.ч. — 4), Na2S, LiCl.
247. Cr(NO3)2 (к.ч. — 6), KNO2, NaNO3.
248. ZnSO4 (к.ч. — 4), Na2CO3, Na2SO4.
249. CrCl3 (к.ч. — 6), KCN, LiNO3.
250. CuCl2 (к.ч. — 4), K3HPO4, RbCl.
251. Fe2(SO4)3 (к.ч. — 6), (NH4)2S, Li2SO4.
252. MgBr2 (к.ч. — 6), CH3COONa, KNO3.
253. AI2(SO4)3 (к.ч. — 6), СH3COONH4, NaCl.
254. NH4Cl, Na2SO3, LiNO3.
255. Cr2(SO4)3 (к.ч. — 6), K2S, Na2SO4.
256. Cu(NO3)2 (к.ч. — 4), Na3PO4, K2SO4.
257. FeCl3 (к.ч. — 6), (NH4)2S, NaNO3.
258. MgCl2 (к.ч. — 6), К2СО3, LiNO3.
259. A1(NO3)3 (к.ч. — 6), Ca(OCl)2, KCl.
260. ZnSO4 (к.ч. — 4), (NH4)2SO4, Li2SO4.
261 Обчислити константу гідролізу калію фториду, визначити ступінь гідролізу цієї солі у розчині з СМ=0,01 і рН розчину.
Відповідь: h=3,88 105; рН=7,59.
262. При якій молярнім концентрації мурашиної кислоти (К=2*10-4) 95% її знаходиться у недисоційованому стані?
Відповідь: 0,8 моль/л.
263. Обчислити молярну концентрацію і еквівалентність (нормальність) сірчаної кислоти, рН розчину якої дорівнює 4,2.
Відповідь: СМ = 3,15*105; СН=6,3*10 3.
264. Визначити pН розчинів хлороводневої (соляної) кислоти і натрію гідроксиду (СН=0,05).
Відповідь: рН=1,3; рН=12,7.
265. Обчислити ступінь гідролізу калію ацетату у розчині (См=0,1) і рН розчину.
Відповідь: h=7,45*10-5; рН=8,87.
266. При якій масовій частці мурашиної кислоти у розчині з густиною, яка дорівнює одиниці, [H+]=8,4*10-3 моль/л (К=2*10-4)?
Відповідь: 0,016.
267. Визначити a і [Н+] в розчині нітратної (азотної) кислоти (CM=0,05). K=5*104.
Відповідь: 0,1; [H+]=5*10-3.
268. Обчислити рH розчину оцтової кислоти (Сн=0,1), якщо 
Відповідь: 2,88.
269. Oбчислити ступінь гідролізу калію ціаніду у розчині з См=0,1 та рН розчину.
Відповідь: h=l, 12; рН=11,05.
270. рН розчину натрієвої солі (См=0,1) деякої одноосновної органічної кислоти дорівнює 10. Обчислити константу дисоціації цієї кислоти.
Відповідь: Ки=107.
271. Обчислити а і [H+] в розчині дихлороцтової кислоти (См=0,1), якщо К=5-10-2.
Відповідь: 2,23 10-1; 2,23 10-1 моль/л.
272. Обчислити рН розчину ціанідної кислоти (Сн=0,2), якщо
KHCl = 7,2*1O-10.
Відповідь: 4,92.
273. Обчислити ступінь гідролізу і рН розчину КОСl (См=0,01).
Відповідь: h=4,47 10~3;рН=9,65.
274. рН розчину одноосновної кислоти дорівнює 4,5 (См=0,1). Знайти ступінь і константу дисоціації кислоти.
Відповідь: 3,16*10-4; 10-8.
275. Скільки грамів HCOONa треба додати до 2 л розчину мурашиної кислоти з См=0,4 (К=2*10-4), щоб [Н+] стала дорівнювати 1*10-3 моль/л?
Відповідь: 10,88г.
276. Дано 10 мл 20%-ного розчину калію гідроксиду (густиною 1,18 г/см3). Розчин розбавили водою до 250 мл. Обчислити рН одержаного розчину.
Відповідь: рН= 13,2.
277. Обчислити ступінь гідролізу натрію ацетату у розчині (См=0,01) і рН розчину.фй
Відповідь: h=2,55*10-4; рН=8,37.
278. Обчислити ос і [Н+] в розчині плавикової кислоти (См=0,3) якщо KHF=6,8*10-4.
Відповідь: 1,75 10-2; 1,42*10-2.
279. 0бчислити ступінь гідролізу NaNO2 у розчині з См=0,1 і рН розчину.
Відповідь: h=1,58 10-5; рH=8,2.
280. Ступінь дисоціації слабкого бінарного електроліту у розчині дорівнює α=0,03 (СН=0,2). Визначити концентрацію недисоційованих молекул і константу дисоціації.
Відповідь: 0,194 моль/л; 1,8 10 4.
Додаток № 1
Таблиця 3.