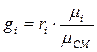|
|
Основні закони суміші ідеальних газів
Суміші ідеальних газів підкоряються тим же законам, що й окремі ідеальні гази. Згідно з законом Дальтона, тиск суміші ідеальних газів дорівнює сумі тисків, які створюються окремими газами незалежно від присутності інших:
 . (42)
. (42)
Згідно з законом Амага, об'єм суміші ідеальних газів дорівнює сумі парціальних об'ємів кожного компонента суміші:
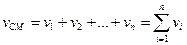 . (43)
. (43)
Склад суміші визначається
масовими частками:
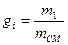 , (44)
, (44)
або об’ємними частками:
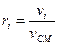 , (45)
, (45)
де mi- маса i-го компонента суміші, mсм -маса суміші,
vi – об’єм і-го компонента суміші, vсм – об’єм суміші.
Для встановлення зв'язку масових часток і об'емних користуються співвідношенням:
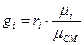 ,
,
Де молекулярна маса суміші:
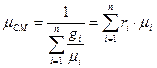 , (46)
, (46)
µі - молекулярна маса компонента суміші.
Питома газова стала суміші визначається як:
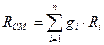 , (47)
, (47)
або
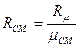 , (48)
, (48)
де R - питома газова стала 1-го компонента сумііші,
Rµ - 8,314 Дж/моль К - універсальна газова стала. Таким чином, рівняння стану суміші ідеальних газів має вигляд
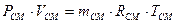 . (49)
. (49)
Запитання до самоконтролю і повторення
1. Засоби визначення складу газової суміші та зв'язок між ними.
2. Основні закони суміші ідеальних газів.
3. Як визначаються молекулярна маса та газова стала суміші?
4. Рівняння стану суміші ідеальних газів.
Приклади розв'язування задач
Задача 1.
Газова суміш задана масовими частками: вуглекислого газу - 25%, кисню - 25% та азоту - 50%. При температурі 650° С та тиску 0,12 МПа вона має об'єм 4 м3. Суміш охолоджують при постійному тиску до 150° С. Визначити масу суміші та відведену кількістьтеплоти.
Дано: g(CО2) = 25% - 0,25; g(O2) =25% - 0.25; g(N2) = 50% = 0,50; t1 = 650°С; Т1 = 923 К; р1 = р2 = 0,12 МПа = 1,2 * 105Па; V1 = 4м3; T2 = 150°С; Т2 = 423 К.
Знайти: m, Q
Розв'язання
3 рівняння стану
рv = mRТ
знайдемо
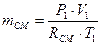
Питома газова стала суміші
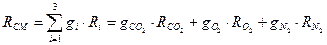 ,
,
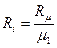 - питома газова стала компонентів суміші,
- питома газова стала компонентів суміші,
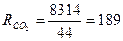 Дж/(кг К),
Дж/(кг К),
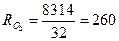 Дж/(кг К),
Дж/(кг К),
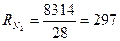 ДЖ/(кг К),
ДЖ/(кг К),
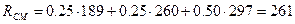 ДЖ/(кг К),
ДЖ/(кг К),
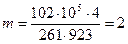 кг.
кг.
Кількість теплоти:
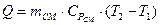 ,
,
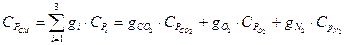 Дж/(кгК),\
Дж/(кгК),\
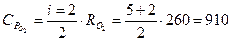 Дж/(кг К),
Дж/(кг К),
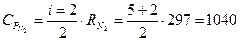 ДЖ/(кг К),
ДЖ/(кг К),
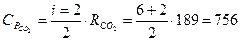 ДЖ/(кг К),
ДЖ/(кг К),
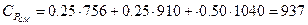 Дж/(кгК).
Дж/(кгК).
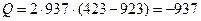 кДж.
кДж.
Задача 2
Газова суміш задана об'ємними частками: вуглекислого газу - 20%, азоту - 68%, кисню - 12%. Початкові параметри стану суіміші: тиск - 0,14 МПа, температура - 140°С. Визначити молярну масу, питому сталу, густину и питомий об'єм суміші.
Дано: r(СО2) = 20% = 0,20; r(N2) = 68% = 0,68; r(О2)-12% = 0,]2; Р1= 0,14 МПа =1,4 * 105Па; t1=140°С T1=413 K.
Знайти: µcм, Rcм, vcм, ρcм.
Розв'язання
Молярна маса суміші:
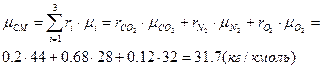
Питома газова стала:
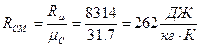 .
.
Густину суміші знаходимо з рівняння стану р V = m R Т:
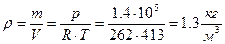 .
.
Питомий об'єм суміші:
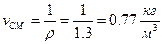 .
.
Задача 3
Генераторний газ складається з наступних об'ємних часток: Н2=18%, СО=24%, СО2=6%, N2=52%. Визначити газову сталу генераторного газу та масову частку газів, що входять до його складу.
Дано: r(Н2)=0.18; µ(Н2)=2 кг/кмоль; r(СО)=0.24; µ(СО)=28 кг/кмоль; r(СО2)=0.06; µ(СО2)=44 кг/кмоль; r(Н2)=0.52; µ(N2)=28 кг/кмоль.
Знайти: Rсм -?, gi - ?
Розв'язання
Газова стала суміші:
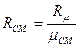
Молярна маса суміші:
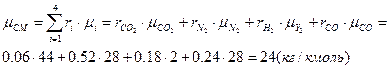
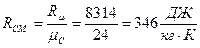
Масові частки газів:
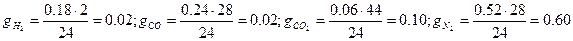 .
.