 |
|
Безперервне рентгенівське випромінювання.
Гальмування електронів первинного пучка у кулонівському полі атома призводить до виникнення безперервного спектра гальмівного рентгенівського випромінювання з енергіями квантів від нуля до енергії пучка.
Довжина хвилі рентгенівського кванта обернено пропорційна енергії, яку втратив електрон, що збуджує квант, тому довжини хвилі квантів з максимальною енергією (Е0) будуть мати мінімальне значення; довжина хвилі (lmin), яка отримала назву короткохвильової межі, і є сталою для певної енергії пучка.

Рисунок 1.16 – Розподіл інтенсивності безперервного рентгенівського випромінювання
Аналіз залежностей, наведених на рисунку, показує:
- величина lmin змінюється залежно від енергії пучка (прискорюючої напруги), причому вона зміщується у бік більш короткої хвилі зі збільшенням Е0;
- інтенсивність безперервного рентгенівського випромінювання досягає максимуму при 1,5lmin, який зміщується у бік великих довжин хвиль при зменшенні Е0;
- інтенсивність рентгенівського випромінювання збільшується зі зростанням енергії пучка.
(1.20) зі зростанням енергії кванта Е його інтенсивність падає, а при збільшенні атомного номера матеріалу мішені – зростає.
Безперервне рентгенівське випромінювання створює фон у спектрах рентгенівського мікроаналізу. Інтенсивність фону має велике значення для визначення межі чутливості приладу. Задача дослідника і конструктора полягає в тому, щоб досягти малої величини фону. У деяких випадках, наприклад, при рентгенівському мікроаналізі біологічних об’єктів, інтенсивність фону має і корисну інформацію.
Механізм утворення характеристичного рентгенівського випромінювання.
Характеристичне рентгенівське випромінювання утворюється при переході атома зі збудженого у стаціонарний стан.
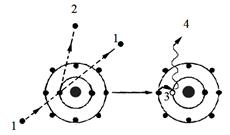
Рисунок 1.17 – Схема процесу збудження та релаксації атома: 1 - первинний електрон; 2 - вилучений електрон; 3 - перехід електрона; 4 - рентгенівський квант
Закон Мозлі
Мозлі встановив зв’язок між частотою лінії рентгенівського випромінювання та атомним номером мішені
 де
де  =2,06·10-16с-1 – стала Рідберга;
=2,06·10-16с-1 – стала Рідберга;  – коефіцієнт, характерний для певної серії випромінювання (для К-серії s =1, для L-серії s =7,5);
– коефіцієнт, характерний для певної серії випромінювання (для К-серії s =1, для L-серії s =7,5); 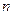 – головне квантове число.
– головне квантове число.

Рисунок 1.18 – Діаграма енергетичних рівнів атома
Ураховуючи те, що на оболонці не може бути більше 2n2 електронів, та принцип заборони Паулі (у даному енергетичному стані не може бути двох електронів з однаковим набором квантових чисел), К-оболонка не має підоболонок, L-оболонка має три підоболонки (L1 містить 2 електрони, L2 – 2 , L3 – 4 ), M-оболонка має п’ять підоболонок (M1 – 2, M2 – 2, M3 – 4, M4 – 4, M5 – 6), N-оболонка має сім підоболонок (N1 – 2, N2 – 2, N3 – 4, N4 – 4, N5 – 6, N6 – 6, N7 – 8).
Часто закон Мозлі записують у лінеаризованій формі (1.25)
Закон Мозлі читається наступним чином: корінь квадратний з частоти є лінійною функцією атомного номера елемента.
Визначивши довжину хвилі рентгенівського випромінювання або частоту, можна за допомогою закону Мозлі точно встановити атомний номер елемента.