 |
|
Влияние температуры на химическое равновесие
Химическое равновесие при повышении температуры должно сместиться в сторону эндотермической реакции (в том направлении, в котором протекает эндотермическая реакция), а при понижении температуры – в том направлении, в котором протекает экзотермическая реакция (в соответствии с качественным правилом – принципом Ле Шателье).
Количественные характеристики влияния температуры на химическое равновесие можно получить на основании уравнения изобары химической реакции (Р = const):
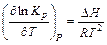
и уравнения изохоры химической реакции (V = const):
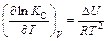
Если реакция протекает в растворе при V = const, то KC = KP.
Уравнения изобары и изохоры химической реакции дают зависимость константы химического равновесия от температуры:
- если реакция экзотермическая, DH < 0, то при увеличении температуры константа равновесия уменьшается (равновесие сдвигается влево, в сторону образования исходных веществ при распаде продуктов реакции);
- если реакция экзотермическая, DH < 0, то при уменьшении температуры константа равновесия увеличивается (равновесие сдвигается вправо, в сторону образования продуктов реакции);
- если реакция эндотермическая, DH > 0, то при увеличении температуры константа равновесия увеличивается (равновесие сдвигается вправо, в сторону образования продуктов реакции);
- если реакция эндотермическая, DH > 0, то при уменьшении температуры константа равновесия уменьшается (равновесие сдвигается влево, в сторону образования исходных веществ при распаде продуктов реакции).
Интегрирование уравнений изобары и изохоры химической реакции при постоянных DH, DU (в небольших интервалах температур) позволяет получить уравнения, которые используют для экспериментального определения тепловых эффектов химических реакций:
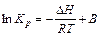 ,
,
где В – константа интегрирования.
Таким образом, зависимость ln KP от 1/Т должна быть линейной, а наклон прямой равен –DH/R (рис. 1).

Рис. 1. Зависимость логарифма константы равновесия от 1/Т.
Интегрирование уравнения изобары и изохоры в пределах K1, K2 и T1, Т2 дает:
 ,
,  .
.
Зная константы равновесия при двух разных температурах, можно рассчитать тепловой эффект реакции. Соответственно, зная DH реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.