 |
|
Законы поведения разряженных газов
ВВЕДЕНИЕ
Предмет молекулярной физики
Предметом молекулярной физики является изучение молекулярной формы движения, т.е. движения больших совокупностей молекул.
При этом существенными являются два вопроса:
1. Изучение молекулярной формы движения самой по себе.
2. Овладение методами изучения систем многих частиц (не обязательно молекул) и соответствующими понятиями.
Решениями второго вопроса занимается статическая физика.
Термодинамические и статистические методы
В изучении макроскопических систем
Всякий материальный объект, всякое тело, состоящее из большого числа частиц, называется макроскопической системой. Размеры макроскопических систем всегда значительно больше размеров атомов и молекул.
Наиболее простой моделью системы многих частиц является идеальный газ. Это газ, состоящий из точечных материальных частиц с конечной массой, между которыми отсутствуют силы, действующие на расстояние, и которые сталкиваются между собой по законам соударения шаров.Необходимо отметить, что частицы сталкиваются между собой именно по законам соударения шаров, потому что точечные частицы, строго говоря, испытывают только лобовые столкновения, которые приводят лишь к изменению направления скорости сталкивающихся частиц на обратное и не изменяют направления скоростей на какие-то другие углы. Наиболее близко свойствам идеального газа составляют достаточно разряжённые газы.
Для описания систем многих частиц информация должна иметь обобщённый характер и относиться не к отдельным частицам, а к совокупности большого числа частиц. Соответствующие понятия также должны относиться не к отдельным частицам, а к большим совокупностям частиц. Такой метод называется статистическим. Его также называют молекулярно-кинетическим или микрофизическим, поскольку конечная цель этого метода заключается в изучении свойств вещества на основе введения представлений об их внутреннем строении. В молекулярно-кинетической теории микроскопические свойства тел (давление, температура, упругость, вязкость, теплопроводность) рассматривают как проявление суммарного действия молекул. Статистическая физика как научное направление сложилась в начале ХХ века благодаря работам Максвелла, Больцмана, Гиббса.
Макроскопический метод основан на изучении свойств макроскопических тел без учёта особенностей их внутреннего строения. Этот подход также называется термодинамическим или феноменологическим, поскольку строится на данных экспериментальных исследований, которые призваны установить связь между величинами, характеризующими систему. Теория при этом строится на некоторых общих положениях (например, закон сохранения энергии) и с их помощью объясняются эти факты.
Оба метода изучения физических явлений – макроскопический и микрофизический – дополняют друг друга.Нельзя излагать вопросы молекулярной физики, не обращаясь к понятиям термодинамики. В это же время нельзя понять природу явлений, описываемых в термодинамике, без использования молекулярных представлений.
Состояние термодинамической системы характеризуют равновесным давлением Р , массой системы m, её объёмом V и температурой t (T). Величины P,V,T называют параметрами системы. Температура может измеряться в градусах Цельсия t (ОС) или в Кельвинах T (К). Единица измерения температуры 1К является в СИ одной из семи основных единиц измерения физических величин.
Принято считать, что таяние льда происходит при 0 ОС, а кипение воды при 100 ОС. Температуры в градусах Кельвина и градусах Цельсия связаны друг с другом:
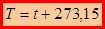
Давление измеряется в паскалях: 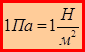
Внесистемными единицами измерения давления являются «атмосфера» и «миллиметр ртутного столба»:
1 атм = 101325 Па
1 мм.рт.ст. = 133,322 Па
Масса измеряется в килограммах. Для количества вещества в качестве единицы измерения используется 1 моль – одна из семи основных единиц измерения физических величин в СИ: 1 моль – количество вещества, содержащее столько же структурных элементов, сколько содержится атомов в 0,012 кг изотопа углерода с массовым числом 12 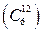 . Структурными элементами могут быть атомы, молекулы, ионы и другие частицы.
. Структурными элементами могут быть атомы, молекулы, ионы и другие частицы.
Число частиц в моле вещества называют числом Авогадро: 
Таким образом, масса одного моля (молярная масса) вещества:
 ,
,
где 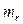 – масса одной молекулы. В СИ
– масса одной молекулы. В СИ 
Число молей в массе вещества m определяется по формуле  .
.
Относительной массой молекулы называют величину  , где mО – масса молекулы
, где mО – масса молекулы  ,
, 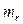 – масса одной молекулы. Величину
– масса одной молекулы. Величину 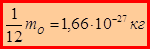 называют атомной единицей массы.
называют атомной единицей массы.
Следовательно:
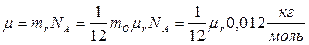 .
.

Законы поведения разряженных газов
Можно ввести понятие идеального газа как предельного состояния реальных газов при их значительных разряжениях. При давлениях, не отличающихся существенно от атмосферного, наиболее близки к идеальному газу водород и особенно гелий.
 Изотермический процесс в идеальных газах исследовался Р.Бойлем (Англия, 1662г.) и Э.Мариоттом (Франция, 1676г.). Согласно закону Бойля-Мариотта: при неизменной температуре T и массе газа m произведение давления газа p на его объем V является величиной постоянной
Изотермический процесс в идеальных газах исследовался Р.Бойлем (Англия, 1662г.) и Э.Мариоттом (Франция, 1676г.). Согласно закону Бойля-Мариотта: при неизменной температуре T и массе газа m произведение давления газа p на его объем V является величиной постоянной
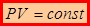
Полученная зависимость графически изображается изотермами(Т = const)
Также являются изотермами

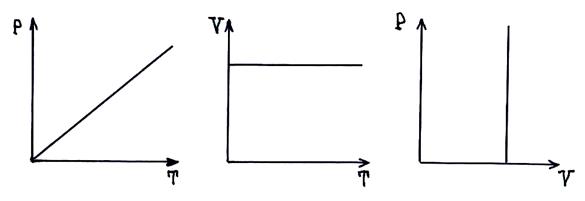
 С помощью соотношения
С помощью соотношения 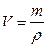 (
(  – плотность газа) в случае изотермического процесса получаем прямо-пропорциональную зависимость между P и
– плотность газа) в случае изотермического процесса получаем прямо-пропорциональную зависимость между P и  :
:

Изобарический (изобарный) процесс исследовался Л. Гей-Люссаком (Франция, 1802г.). Согласно закону Гей-Люссака: при неизменном давлении и массе газа m его температура прямо пропорциональна его объёму

Графическое представление изобар(P = const):

 Пусть газ переведет из состояния 1 с параметрами P1,V1,T1 в состояние 2 с параметрами P2,V2,T2посредством изотермического и изобарного процесса. Для изотермического процесса
Пусть газ переведет из состояния 1 с параметрами P1,V1,T1 в состояние 2 с параметрами P2,V2,T2посредством изотермического и изобарного процесса. Для изотермического процесса 
Для изобарного процесса
Используя четыре записанные выше уравнения получаем:

Следовательно:  – уравнение Клапейрона: для неизменной массы газа произведение давления газа на его объем деленное на температуру газа есть величина постоянная.
– уравнение Клапейрона: для неизменной массы газа произведение давления газа на его объем деленное на температуру газа есть величина постоянная.
Изохорический (изохорный) процесс – процесс при постоянном объеме газа – исследовался Ж. Шарлем (Франция, 1787г.). Из записанного выше уравнения Клапейрона следует:  – закон Шарля: при неизменном объёме и массе газа его давление прямо пропорционально температуре.
– закон Шарля: при неизменном объёме и массе газа его давление прямо пропорционально температуре.
Графическое представление изохор(V = const):
В 1811г. Итальянский химик А.Авогадро открыл закон, носящий его имя: одинаковые объёмы различных газов, взятых при одинаковых температуре и давлении, содержат равное количество молекул.Отсюда следует, что для 1 моля любого идеального газа 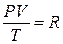 – универсальная газовая постоянная
– универсальная газовая постоянная 
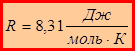
Если масса газа m, а молекулярная масса 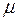 , то для произвольной массы газа (
, то для произвольной массы газа (  – количество молей в массе m вещества):
– количество молей в массе m вещества):
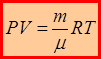 – уравнение Клапейрона-Менделеева.
– уравнение Клапейрона-Менделеева.
Для смеси идеальных газов справедлив законДж.Дальтона (Англия, 1801г.), открытый опытным путем: общее давление смеси химических не реагирующих газов равно сумме их парциальное давлений. Парциальное давление – это давление, создаваемое каждой из компонент газовой смеси в отсутствие других компонент этой смеси.
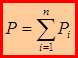 , где n – число компонент смеси.
, где n – число компонент смеси.
Если объём сосуда V, то для каждой компоненты:
 .
.
После суммирования:
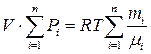
Используя закон Дальтона, получаем уравнение состояния для смеси идеальных газов:
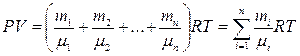 ,
,
здесь 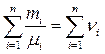 – число молей в газовой смеси.
– число молей в газовой смеси.
Смесь характеризуются эффективной мольной массой  , которая определяется из равенства:
, которая определяется из равенства: 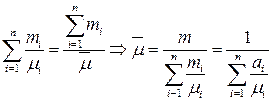 , где
, где  - концентрация компоненты в смеси. В итоге уравнение состояния для смеси идеальных газов примет вид:
- концентрация компоненты в смеси. В итоге уравнение состояния для смеси идеальных газов примет вид:
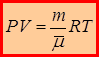
Свойства газовой смеси можно отождествить со свойствами однородного газа, мольная масса которого равна эффективной мольной массе газовой смеси.