 |
|
Элементарная боровская теория атома водорода
Теория Бора, как уже было сказано основана на следующих допущениях-постулатах:
1. Атомная система имеет дискретные устойчивые стационарные состояния с определенной энергией, которые можно рассматривать с помощью обычной механики, но в которых система не излучает, даже если она должна излучать по законам классической электродинамики.
2. Излучение происходит при переходе из одного стационарного состояния в другое в виде кванта энергии 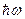 монохроматического света (здесь w – частота излучения;
монохроматического света (здесь w – частота излучения; 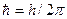 ).
).
3. В специальном случае движения по круговым орбитам стационарными являются только те орбиты, на которых момент количества движения Р электрона кратен величине 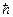 :
:
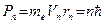 , (1)
, (1)
где n = 1, 2, 3,...; me – масса электрона, rn – радиус n-ой орбиты; Vn – скорость электрона на n-ой орбите. Число п называется главным квантовым числом.
Рассмотрим электрон, движущийся в поле атомного ядра с зарядом Ze. При Z =1 такая система соответствует атому водорода, при иных Z – водородоподобному иону, т. е. атому с порядковым номером Z, из которого удалены все электроны, кроме одного. Согласно второму закону Ньютона произведение массы электрона me на его центростремительное ускорение V2/r должно равняться кулоновской силе:
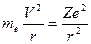 . (2)
. (2)
Исключая V из (1) и (2), получаем, что радиус электронных орбит в атоме может принимать лишь ряд дискретных значений:
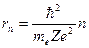 (n = 1, 2, 3, … ) (3)
(n = 1, 2, 3, … ) (3)
Для первой орбиты водородного атома (Z = 1, п =1) получается
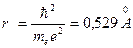 , т.е. величина порядка газокинетических размеров атома.
, т.е. величина порядка газокинетических размеров атома.
Внутренняя энергия атомаслагается из кинетической энергии электрона (ядро неподвижно) и энергии взаимодействия электрона с ядром (потенциальной энергии): 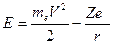 . Из (2) следует, что
. Из (2) следует, что 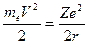 Следовательно,
Следовательно, 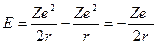 .
.
Наконец, учтя значения r, даваемые (3), получим дозволенные значения энергии электрона в атоме:
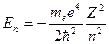 (n = 1, 2, 3, … ) (4)
(n = 1, 2, 3, … ) (4)
Схема энергетических уровней, определяемых (4), дана на рис. 1.
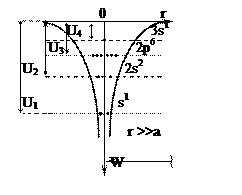 |
Рис. 1.
При переходе атома водорода из состояния п в состояние m испускается квант 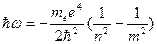 . Частота испущенного кванта равна
. Частота испущенного кванта равна  .
.
Таким образом, мы пришли к обобщенной формуле Бальмера, причем для постоянной Ридберга получается значение:
 . (5)
. (5)
Величина R несколько отличается от значения постоянной Ридберга, найденной из спектроскопических измерений. Дело в том, что при выводе формулы (4) мы предполагали ядро неподвижным, тогда как в силу конечности своей массы оно вместе с электроном движется вокруг их общего центра инерции. Чтобы учесть это обстоятельство, достаточно вместо массы электрона ввести приведенную массу электрона и ядра:
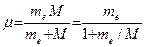 , (6)
, (6)
где M - масса ядра. Заменяя в (4) me на m, получаем в случае атома водорода (M = Mp):
 , (7)
, (7)
что прекрасно согласуется с экспериментом 109737,309±0,012 см-1.
Здесь Rµ соответствует бесконечно большой массе ядра и совпадает с (5).
Выражение (7) показывает, что постоянная Ридберга для изотопов водорода (дейтерия с Мд = 2Мp и трития МТ = 3Мp), вследствие различия в приведённых массах, отличается от постоянной Ридберга Rp для легкого водорода. Это хорошо согласуется с наблюдаемым сдвигом линий в спектрах дейтерия и трития по сравнению со спектром водорода (изотопический сдвиг).
Теория Бора была весьма крупным шагом в развитии теории атома. Она с полной отчетливостью показала неприменимость классической физики к внутриатомным явлениям и главенствующее значение квантовых законов в микромире. Изложенная выше элементарная теория была в течение последующего десятилетия подвергнута дальнейшему развитию.
Для описания более тонких эффектов, например расщепления спектральных линий, излучаемых атомами во внешнем поле, недостаточно рассмотрения только круговых орбит. Более общие условия стационарности, чем (1), пригодные для эллиптических орбит, были даны Зоммерфельдом в следующем виде: если механическая система с i-ми степенями свободы описывается обобщенными координатами qi и соответствующими обобщенными импульсами pi = ¶T/¶qi, то стационарны только те состояния системы, для которых
 , (8)
, (8)
где ni - целые квантовые числа, а интегрирование распространяется на всю область изменения qi. В случае эллипса, описываемого полярными координатами r и j, имеем
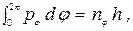 (9)
(9)
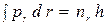 , (10)
, (10)
где nj и nr - азимутальное и радиальное квантовые числа. В силу постоянства момента количества движения pj = const = p, условие (9) дает, как и в предыдущем случае круговой орбиты
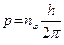 . (11)
. (11)
Соответствующий расчет показывает, что энергия электрона зависит от суммы nj + nr = n по формуле (4). n называют главным квантовым числом. Так как nj = 1, 2, ...n, при заданном n, имеется n эллиптических орбит с одинаковой энергией (4) и с различной величиной момента количества движения (11). Если рассмотреть третью степень свободы, то условие квантования (8) для неё приводит к тому, что каждая орбита может быть сориентирована в пространстве не произвольным образом, а лишь так, что проекция момента количества движения на любое фиксированное направление OZ может принимать 2n + 1 значений, кратных h/(2p) :
 , (12)
, (12)
m = - nj , - nj + 1 , . . . . . nj - 1, nj . (13)
Теория Бора-Зоммерфельда с полной отчетливостью показала неприменимость классической физики и первенствующее значение квантовых законов для микроскопических систем. Она объяснила основные закономерности в спектрах водородоподобных ионов, щелочных металлов, рентгеновских спектрах. В её рамках впервые получили объяснения закономерности периодической системы элементов. С другой стороны, теория не дала последовательного объяснения интенсивности и поляризации спектральных линий. Никак не удались попытки построить теорию простейшей двухэлектронной системы – атома гелия. Недостатки теории Бора являются следствием её внутренней противоречивости. Действительно, с одной стороны, она привлекает чуждые классической физике идеи квантования, а с другой – пользуется для описания стационарных состояний классической механикой. Наиболее правильную картину внутриатомных физических явлений дала последовательная квантовая теория – квантовая механика, по отношению к которой теория Бора явилась важнейшим переходным этапом.
Лекция 9
1. Гипотеза де-Бройля. Волновые свойства вещества
Недостаточность теории Бора сделала необходимым критический пересмотр основ представлений о природе элементарных частиц (электронов, протонов и т. п.). Возник вопрос о том, насколько исчерпывающим является представление электрона в виде малой механической частицы, характеризуемой определенными координатами и определенной скоростью.
В результате углубления наших знаний о природе света выяснилось, что в оптических явлениях обнаруживается своеобразный дуализм. Наряду с такими свойствами света, которые самым непосредственным образом свидетельствуют о его волновой природе (интерференция, дифракция), имеются и другие свойства, столь же непосредственно обнаруживающие его корпускулярную природу (фотоэффект, явление Комптона).
В 1924 г. Лун де-Бройль выдвинул смелую гипотезу, что дуализм не является особенностью одних только оптических явлений, но имеет универсальное проявление. Допуская, что частицы вещества наряду с корпускулярными свойствами имеют также и волновые, де-Бройль перенес на случай частиц вещества те же правила перехода от одной картины к другой, какие справедливы в случае света. Фотон, как известно, обладает энергией 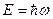 и импульсом
и импульсом  . По идее де-Бройля, движение электрона или какой-либо другой частицы связано с волновым процессом, длина волны которого и частота равны
. По идее де-Бройля, движение электрона или какой-либо другой частицы связано с волновым процессом, длина волны которого и частота равны
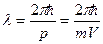 и
и 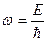 . (1)
. (1)
Гипотеза де-Бройля вскоре была блестяще подтверждена экспериментально. Дэвиссон и Джермер исследовали в 1927 г. отражение электронов от монокристалла никеля, принадлежащего к кубической системе. Узкий пучок моноэнергетических электронов направлялся на поверхность монокристалла, сошлифованную перпендикулярно к большой диагонали кристаллической ячейки. Отраженные электроны улавливались цилиндрическим электродом, присоединенным к гальванометру (рис. 1). Интенсивность отраженного пучка оценивалась по силе тока, текущего через гальванометр. Варьировались скорость электронов и угол j, под которым устанавливался цилиндрический электрод. На рис. 2 показана зависимость силы тока, измеряемой гальванометром, от угла j при различных энергиях электронов.
Вертикальная ось на графиках определяет направление падающего пучка. Сила тока в заданном направлении представляется длиной отрезка, проведенного от начала координат до пересечения с кривой. Из рисунка видно, что рассеяние оказалось особенно интенсивным при определенном значении угла j. Этот угол соответствовал отражению от атомных плоскостей, расстояние между которыми d было известно из рентгенографических исследований. При данном j сила тока оказалась особенно значительной при ускоряющем напряжении, равном 54 В. Вычисленная по формуле (1) длина волны, отвечающая этому напряжению равнялась 1,67 ангстрема. Длина волны, соответствующая дифракционному максимуму определенному в соответствии с формулой 2d sin j = nl, равнялась 1,65 ангстрема, что можно было считать первым подтверждением гипотезы де-Бройля.
Рис. 1. |  Рис. 2.
Рис. 2.
|
Томсон и независимо от него Тартаковскнй получили дифракционную картину при прохождении электронного пучка через металлическую фольгу. Схема опыта приведена на рис. 3. Пучок электронов, ускоренных разностью потенциалов порядка нескольких десятков киловольт, проходил через тонкую металлическую фольгу и попадал на фотопластинку. Электрон при ударе о фотопластинку оказывает на нее такое же действие, как и фотон. Полученная таким способом электронограмма золота (рис. 4, а)сопоставлена с полученной в аналогичных условиях рентгенограммой алюминия (рис. 4, б). Сходство обеих картин поразительно.
 Рис. 3.
Рис. 3.
|  Рис. 4.
Рис. 4.
|
Штерн и его сотрудники показали также, что дифракционные явления обнаруживаются также у атомных и молекулярных пучков. Причем во всех этих случаях картина соответствует длине волны, определяемой формулой (1). Таким образом? из описанных опытов естественно следовало, что пучок микрочастиц определенной скорости и направления дает дифракционную картину, подобную картине, получаемой от плоской волны.
