 |
|
Лабораторна робота № 2
Демонстраційний експеримент на тему:
“Закони постійного струму”
Дослід 1. Електрорушійна сила і внутрішній опір джерела струму
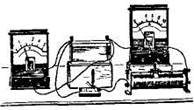 Збирають електричне коло. В якості джерела вмикають ванну з цинковим і мідним електродами і електролітом. До амперметра підбирають шунт силою струму 1А, а до вольтметра - додатковий опір напругою 1 В. При розімкнутому колі вольтметр дає деякі покази. Змінюють положення електродів в ванні, тобто зближують їх і змінюють глибину їх занурення в електроліт. При цьому покази вольтметра не змінюються. Роблять висновок, що ця напруга може служити характеристикою джерела струму, яка залежить тільки від того, які електроди і який електроліт застосовані в даному джерелі струму. Цю характеристику прийнято називати електрорушійною силою джерела. Електрорушійна сила - це енергетична характеристика поля, що створюється джерелом. Вольтметр, підключений до клем джерела струму при розімкнутому електричному колі, вимірює саме ЕРС. Після цього замикають зовнішні кола і спостерігають за показами вольтметра і амперметра. Вольтметр в цьому випадку показує напругу, а амперметр - силу струму в колі.
Збирають електричне коло. В якості джерела вмикають ванну з цинковим і мідним електродами і електролітом. До амперметра підбирають шунт силою струму 1А, а до вольтметра - додатковий опір напругою 1 В. При розімкнутому колі вольтметр дає деякі покази. Змінюють положення електродів в ванні, тобто зближують їх і змінюють глибину їх занурення в електроліт. При цьому покази вольтметра не змінюються. Роблять висновок, що ця напруга може служити характеристикою джерела струму, яка залежить тільки від того, які електроди і який електроліт застосовані в даному джерелі струму. Цю характеристику прийнято називати електрорушійною силою джерела. Електрорушійна сила - це енергетична характеристика поля, що створюється джерелом. Вольтметр, підключений до клем джерела струму при розімкнутому електричному колі, вимірює саме ЕРС. Після цього замикають зовнішні кола і спостерігають за показами вольтметра і амперметра. Вольтметр в цьому випадку показує напругу, а амперметр - силу струму в колі.
Не змінюючи навантаження у внутрішньому колі змінюють відстань між електродами, змінюють глибину їх занурення в електроліт. При цьому змінюється як сила струму, так і напруга. Тут в основному слід звернути увагу на зміну сили струму. При збільшені відстані між електродами сила струму зменшується. Чому так відбувається? Ймовірно, тому що змінюється опір на ділянці всередині джерела. Те саме відбувається і при зменшені заглиблення електродів в електроліт. Отже, сила струму в колі залежить не тільки від зовнішнього опору R, але і від внутрішнього опору г. Характер залежності сили струму від ЕРС і опору кола визначається законом, що отримав назву закону Ома для повного кола.
Дослід 2. Закон Ома для всього кола
Складають електричне коло з увімкнених послідовно універсального гальванометра з шунтом на 1 А, реостата з повзунком, рубильника і елемента Грене. Усі сполучення виконують короткими і товстими проводами. Увівши невеликий опір реостата і опустивши в розчин цинковий електрод, замикають коло і записують показ амперметра (струм 17,5 А - п'ять поділок шкали). Збільшуючи зовнішній опір, спостерігають зменшення струму і навпаки. При незмінному зовнішньому опорі змінюють внутрішній опір джерела струму, змінюючи глибину занурення цинкового електрода в розчин, і спостерігають, як при цьому змінюється величина струму (ЕРС елемента не залежить від його розмірів та форми і при зміні глибини занурення електрода не змінюється; це треба показати).
Залежність величини струму від ЕРС джерела можна було б продемонструвати, узявши інший елемент з таким самим внутрішнім опором, як і перший, але з більшою ЕРС. Проте оскільки безпосередньо здійснити це важко, то поступають так. При невеликому зовнішньому опорі і при зануреному до половини цинковому електроді одного елемента Грене записують величину струму в колі. Потім другий елемент сполучають послідовно з першим і спостерігають, що величина струму збільшилась у двічі.
Дослід 3
Обладнання: 1) амперметр, 2) вольтметр, 3) реостат, 4) електрощит з лампами різної потужності, 5) вимикач, 6) випрямляч ВС-24, 7) провідники
При демонстрації послідовного з’єднання провідників збирають схему

і показують, що величина електричного струму в точках "1", "2", "3", "4" однакова. Тобто, при послідовному з’єднанні провідників 
Далі демонструють, що 
Дослід 4
Визначають за законом Ома опір кожної лампи і роблять перевірку формули 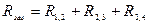
Дослід 5
При демонстрації паралельного з’єднання провідників збирають схему
і вимірюють величину сили струму 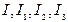 . Показують, що
. Показують, що 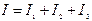
Далі вимірюють напругу на лампах і показують, що 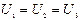

Дослід 6
За показами приладів розраховують 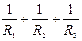 і порівнюють з
і порівнюють з  . Роблять висновки.
. Роблять висновки.
Контрольні запитання
1. Опишіть закони послідовного сполучених джерел струму.
2. Опишіть закони паралельно з'єднаних джерел струму.
3. Що називають сторонніми силами та електрорушійною силою?
4. Наведіть методи визначення електрорушійної сили та внутрішнього опору джерела струму.
5. Опишіть дії, які спричинює електричний струм.
6. Як визначити розподіл напруги на різних ділянках електричного кола?
Лабораторна робота № 3
Демонстраційний експеримент на тему: “Електричний струм в електролітах”
Дослід 1. Порівняння електропровідності води і розчинів солі і кислоти
Обладнання: 1) панелька з двома електродами, 2) склянки хімічні з дистильованою водою – 3 шт., 3) сіль поварена і пісок цукровий- 5-10 г, 4) розчин сірчаної кислоти в пробірці, 5) лампа електрична 15-25 Вт, 127 В на підставці, 6) піпетка, 7) штатив універсальний, 8) паличка скляна, 9) з’єднувальні провідники, 10) провідник з’єднувальний на ізолюючій ручці.
Панельку з двома електродами з алюмінієвого дроту діаметром 4 мм затискають у лапці штатива. Електроди з'єднують послідовно з лампою накалювання і вмикають у мережу змінного струму напругою 10 -120 В.
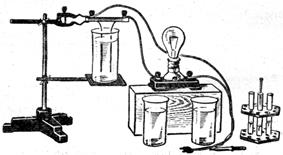
Спочатку поміщають електроди в склянку з дистильованою водою і виявляють, що лампа не світиться. Дистильована вода не проводить електричний струм. Щоб переконатися, що на електродах є напруга, з'єднують їх за допомогою провідника на ізолюючій ручці. Лампа загоряється.
Після цього розчиняють у воді небагато кухонної солі і спостерігають появу світіння лампи, спочатку слабке, а в міру додавання солі більш яскраве.
Потім демонструють електропровідність розчину кислоти. Для цього беруть іншу склянку з чистою дистильованою водою і, додаючи по краплях з піпетки розчин сірчаної кислоти, демонструють, як поступово лампа починає світитися усе яскравіше. Дослід показує, що зі збільшенням концентрації розчину збільшується число дисоційованих молекул чи іонів, тобто росте число носіїв струму.
Однак не всі розчинені у воді речовини дисоціюють. Щоб переконатися в цьому, у третій склянці з дистильованою водою розчиняють 1-2 чайні ложки цукру і спостерігають за лампою, яка протягом всього досліду не загоряється.
Нарешті, демонструють слабку електропровідність звичайної питної води, у якій завжди є невелика кількість розчинених солей.
Дослід 2. Рух іонів в електричному полі
 Обладнання: 1) пластинка скляна 120 Х 150 мм на штативі, 2) два електроди з пружними затисками, 3) випрямляч універсальний, 4) папір фільтрувальний, 5) електроліти: розчин кухонної солі в плоскій кюветі й аміачний розчин хромата міді в пробірці, 6) освітлювач для тіньової проекції, 7) з’єднувальні провідники.
Обладнання: 1) пластинка скляна 120 Х 150 мм на штативі, 2) два електроди з пружними затисками, 3) випрямляч універсальний, 4) папір фільтрувальний, 5) електроліти: розчин кухонної солі в плоскій кюветі й аміачний розчин хромата міді в пробірці, 6) освітлювач для тіньової проекції, 7) з’єднувальні провідники.
Мета досліду - показати одночасний рух в електричному полі як позитивно, так і негативно заряджених іонів. Для цього найбільш придатним електролітом є аміачний розчин хромата міді. У розчині ця комплексна сіль дисоціює на позитивно заряджені іони міді темно-синього кольору і негативно заряджені іони кислотного залишку, що мають жовте забарвлення.
На скляну пластинку 1, закріплену в лапці штатива, накладають фільтрувальний папір 2, змочений в розчині кухонної солі. Потім беруть вузьку смужку фільтрувального папера (краще в кілька шарів) і, змочивши її в розчині комплексної солі, поміщують посередині фільтрувального паперу 3.
Праворуч і ліворуч на папері закріплюють електроди 4із пружними затисками, що з'єднують з універсальним випрямлячем, (±250 В).
Ввімкнувши випрямляч і встановивши за допомогою ручки потенціометра майже повну напругу 250 В, звертають увагу учнів, як від середньої смужки, що має зелене забарвлення, поступово починає поширюватися жовтою смугою у бік анода негативно заряджені іони, а у бік катода - синім фронтом позитивно заряджені іони.
Щоб поліпшити умови спостереження за поширенням кольорових смуг при електролізі, корисно змочений папір на скляній пластинці підсвітити, скориставшись освітлювачем для тіньовою проекції.
Дослід 3. Зміна електропровідності електролітів при нагріванні
Обладнання: 1) панелька з двома електродами з алюмінієвого дроту, 2) склянка хімічна з підкисленою водою, 3) лампа електрична 15-25 Вт на підставці, 4) штатив універсальний, 5) газовий пальник чи спиртівка, 6) з’єднувальні провідники.
Збирають установку, як зображено на малюнку в досліді 1, і вмикають струм. Воду в склянці заздалегідь підкислюють (пускають декілька крапель сірчаної кислоти) так, щоб при зануренні в неї електродів волосок лампи злегка розжарювався.
Після цього підставляють під склянку запалену спиртівку і спостерігають, як у міру нагрівання електроліта лампа починає все яскравіше світитися.
Таким чином, дослід показує, що опір електроліту з підвищенням температури зменшується (електропровідність збільшується).
Дослід 4. Принцип дії гальванічного елемента й акумулятора
Обладнання: 1) набір для електролізу з цинкової, мідної, вугільної і двома свинцевими пластинами, 3) розчин сірчаної кислоти, 5) амперметр демонстраційний, 6) випрямляч В-24, 7) панелька з маловольтними лампочками,8) дзвоник електричний демонстраційний, 11) перемикач однополюсний, 14) з’єднувальні провідники.
 1. Спочатку збирають найпростіший гальванічний елемент із цинкової і мідної пластин, опущених у 10-15-процентний розчин сірчаної кислоти, і демонструють його дію, використовуючи електричну лампу.
1. Спочатку збирають найпростіший гальванічний елемент із цинкової і мідної пластин, опущених у 10-15-процентний розчин сірчаної кислоти, і демонструють його дію, використовуючи електричну лампу.
Замінивши мідний електрод вугільним, повторюють дослід і зауважують, що лампа горить дещо яскравіше (ЕРС отриманого елемента 1,4 В). Замість лампи як індикатора струму вмикають електричний дзвоник, що через нетривалий час припиняє працювати.
Щоб відновити роботу елемента, необхідно видалити з мідного чи вугільного електрода газовий шар. Для цього виймають електрод, обмивають його чистою водою і витирають. Елемент знову починає діяти.
2. Для демонстрації принципу дії акумулятора збирають його модель. Закріплюють у спеціальній вставці два однакових свинцевих електроди й опускають їх у розчин сірчаної кислоти, налитий у хімічну склянку.
Приєднують до затисків електродів лампу і переконуються, що вона не горить.
Після цього збирають установку, зображену на рисунку. Амперметр беруть із шунтом на ЗА і шкалою з нулем посередині. На панелі залишають дві лампочки.
Вмикають коло на зарядку і звертають увагу, в який бік відхиляється стрілка амперметра при зарядці. Величину зарядного струму регулюють за допомогою реостата (встановлюють її найбільшою). Через 1-2 хв струм вмикають і, вийнявши електроди, звертають увагу учнів на зміну їхнього забарвлення: електрод, що був приєднаний до плюса джерела, тепер має шоколадний відтінок, а другий електрод, приєднаний до мінуса, - ясно-сірий.
Знову занурюють електроди в розчин кислоти і замикають коло розрядки. Спостерігають світіння лампочок і відхилення стрілки амперметра в зворотній бік. Так як струм розрядки існує короткий час, то весь дослід повторюють ще раз.
Після повної розрядки моделі акумулятора (для цього її замикають на якийсь час накоротко) пластини майже відновлюють свій колишній колір.
Контрольні запитання
1. Чому під час проходження струму крізь розчин електроліту речовина переноситься, а при проходженні по металевому провіднику не переноситься?
2. Сформулюйте закони Фарадея для електролізу?
3. Як визначити елементарний електричний заряд, використовуючи закони електролізу?
4. Яка природа електропровідності електролітів і газів? Що тут є спільного і чим ці типи електропровідності відрізняються?
5. Які практичні застосування електролізу ви знаєте? Які з них можна досить просто продемонструвати на уроках?
6. Чим відрізняється явище дисоціації молекул в електролітах від іонізації газових молекул?
7. Як залежить опір електролітів від температури? Чим така залежність пояснюється?
8. Що називається електрохімічним еквівалентом речовини?
9. Які процеси відбуваються в розчині на електродах під час електролізу?