 |
|
Обратимые и необратимые процессы.
Процесс перехода системы из одного состояния в другое называется обратимым, если можно провести его в обратном направлении так, чтобы и система, и окружающие ее тела вернулись в исходное состояние, проходя ту же самую последовательность промежуточных состояний, но в обратном порядке. Если это невозможно, то процесс называется необратимым.
Примером необратимого процесса является переход тепла от нагретого тела к холодному. Известно, что при тепловом контакте тел этот процесс происходит самопроизвольно. Обратный же процесс самопроизвольно произойти не может.
Другой пример необратимого процесса - переход кинетической энергии движущегося тела во внутреннюю при торможении его под действием силы трения. При этом механическая энергия переходит в энергию хаотического движения молекул самопроизвольно. Опыт показывает, что обратный процесс самопроизвольно произойти не может.
Все реальные тепловые процессы являются необратимыми. А понятие обратимого процесса является идеализацией, такой же как материальная точка, точечный заряд, абсолютно твердое тело и т. д. Условием обратимости процесса является его равновесность. Это значит, что система должна проходить через последовательность бесконечно близких друг к другу промежуточных равновесных состояний. Следовательно, обратимый процесс должен быть квазистатическим.
Второе начало термодинамики.
Для описания термодинамических процессов первого начала термодинамики недостаточно, т. к. оно не позволяет определить направление протекания процессов. Действительно, процесс самопроизвольной передачи энергии в форме теплоты от холодного тела к горячему нисколько не противоречит первому началу термодинамики. Однако, опыт показывает, что такое никогда не происходит. Первое начало не исключает возможность построения вечного двигателя II рода, т. е. такого двигателя, который все тепло, полученное от нагревателя, превращает в эквивалентную ему работу. Опыт свидетельствует о невозможности создания такого двигателя. Обобщение этих и других опытных данных получило название второго начала термодинамики. Существует несколько формулировок этого закона. Приведем две из них.
1. Невозможен круговой процесс, единственным результатом которого является превращение всей теплоты, полученной от нагревателя, в эквивалентную ей работу.
2. Невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от холодного тела к горячему.
В термодинамике доказывается, что эти формулировки эквивалентны.
Энтропия.
Кроме внутренней энергии, являющейся функцией состояния системы, в термодинамике используются и другие физические величины, также являющиеся функциями состояния. Одна из них - энтропия. Она определяется следующим образом.
Пусть 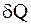 - элементарное количество теплоты, сообщенное системе, а Т - температура, при которой оно было получено. Энтропией системы S называется функция ее состояния, такая что
- элементарное количество теплоты, сообщенное системе, а Т - температура, при которой оно было получено. Энтропией системы S называется функция ее состояния, такая что
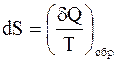 ,
,
где индекс “обр” означает, что процесс получения тепла является обратимым. Разность энтропий в состояниях 1 и 2 равна
 .
.
Как и внутренняя энергия энтропия определяется с точностью до произвольной постоянной, значение которой не играет роли. Физический смысл имеет не сама энтропия, а лишь разность ее в двух состояниях.
В термодинамике доказывается, что энтропия замкнутой системы не может убывать, т. е.
 ,
,
где знак “=” относится к обратимому процессу, знак “>” - к необратимому. Это утверждение называется законом неубывания энтропии, который фактически является еще одной формулировкой второго начала термодинамики.
Нернстом было доказано, что энтропию любой системы при Т=0 необходимо принимать равной нулю. Это утверждение называют третьим началом термодинамики или тепловой теоремой Нернста. В соответствии с этим энтропию при произвольной температуре Т находят как
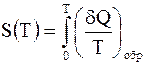 .
.