 |
|
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
а) Запишите математические выражения для скорости прямой и обратной реакции, выразив скорость через концентрации (твердая и жидкая фазы) или парциальное давление реагентов (газовая фаза). Определите порядок и молекулярность каждой реакции;
б) Напишите математическое выражение закона действующих масс для равновесных систем;
в) В какую сторону будет смещаться равновесие в системе при увеличении концентрации исходных веществ, при понижении давления, при повышении температуры.
Пример решения.
Для химической реакции, протекающей по уравнению:
СоСl2 (г)  СО (г) + Сl2 (г), ΔН = -112,86 кДж
СО (г) + Сl2 (г), ΔН = -112,86 кДж
напишем выражение для скорости прямой (  ) и обратной (
) и обратной (  ) реакции, выразив ее через парциальное давление реагентов, так как все вещества находятся в газовой фазе
) реакции, выразив ее через парциальное давление реагентов, так как все вещества находятся в газовой фазе

 где
где
 скорости прямой реакции и обратной;
скорости прямой реакции и обратной;
 константы скорости прямой и обратной реакции;
константы скорости прямой и обратной реакции;
 парциальное давление фосгена СОСl2, оксида углерода СО и хлора Сl2.
парциальное давление фосгена СОСl2, оксида углерода СО и хлора Сl2.
Порядок реакции определяется суммой величин показателей степени при значении концентрации исходных реагирующих веществ в выражении скорости реакции, следовательно прямая реакция первого порядка, а обратная - второго порядка.
Число молекул реагентов, принимающих участие в простейшей (элементарной) стадии, называется ее молекулярностью. Для одностадийных реакций порядок совпадает с молекулярностью.
Прямая реакция - мономолекулярная, обратная - бимолекулярная.
Для реакций, протекающих между газами при вычислении константы равновесия удобно пользоваться значениями парциальных давлений реагирующих веществ:
 где
где
 константа равновесия, вычисляемая через парциальные давления.
константа равновесия, вычисляемая через парциальные давления.
Это и есть математическое выражение закона действующих масс.
При увеличении концентрации СОСl2 скорость прямой реакции возрастет, и равновесие сместится в правую сторону (в сторону прямой реакции).
При увеличении давления равновесие в системе сместится в сторону реакции, идущей с уменьшением давления (меньше объемов газа), то есть налево, в сторону обратной реакции.
Так как прямая реакция экзотермическая (идет с выделением теплоты), то повышение температуры должно вызвать смещение равновесия в сторону обратной реакции, идущей с поглощением теплоты согласно принципа Ле Шателье.
ДИСПЕРСНЫЕ СИСТЕМЫ
а) Найти массу соли, необходимую для приготовления раствора объемом V л с массовой долей ω. Плотность раствора ρ. Вычислить нормальность, молярность и моляльность этого раствора. Написать уравнения электролитической диссоциации данной соли в воде.
Пример. Найти массу Pb(NO3)2, необходимую для приготовления 0,5 л 2%-ного раствора. Плотность раствора 1016 кг/м3. Вычислить нормальность, молярность и моляльность этого раствора. Написать уравнение электролитической диссоциации этой соли в воде.
Р е ш е н и е
1. Определяем молярную массу и молярную массу эквивалента Pb(NO3)2
 г/моль;
г/моль;  г/моль
г/моль
2. Находим массу Pb(NO3)2, необходимую для приготовления 0,5 л его раствора с массовой долей 2%.
Массовая доля показывает, сколько единиц массы растворимого вещества содержится в 100 массовых единицах массы раствора.
Масса раствора равна произведению объема раствора на его плотность
m = 0,5 · 10-3 м3 · 1016 кг/м3 = 0,508 кг = 508 г
В 100 г раствора содержится 2 г Pb(NO3)2
В 508 г раствора содержится Х г Pb(NO3)2
Х =  г
г
3. Находим молярную концентрацию раствора
Молярная концентрация (молярность) раствора (См) показывает количество растворенного вещества, содержащееся в 1 л раствора
В 0,5 л раствора содержится 10,16 г Pb(NO3)2
В 1 л раствора содержится Х г Pb(NO3)2
Х =  г Pb(NO3)2
г Pb(NO3)2
 моль/л
моль/л
4. Находим молярную концентрацию эквивалента (нормальность) раствора
Молярная концентрация эквивалента показывает число молярных масс эквивалентов растворенного вещества, содержащегося в 1 л раствора
 г/моль
г/моль
5. Находим моляльность раствора
Моляльность раствора μ(моль/кг) показывает количество растворенного вещества, находящегося в 1 кг растворителя
Масса воды в 0,5 л 2%-ного раствора Pb(NO3)2 равна
508 г - 10,16 г = 497,84 г
Количество Pb(NO3)2 равно  моль
моль
В 497,84 г Н2О растворено 0,0307 моль Pb(NO3)2
В 1000 г Н2О растворено Х
Х =  моль/кг
моль/кг
Уравнение реакции электролитической диссоциации
Соли в воде диссоциируют на катионы и анионы
Pb(NO3)2  Pb2+ + 2 NO
Pb2+ + 2 NO  .
.
б) Что такое рН раствора? Определить рН раствора основания или кислоты (1) молярной концентрации (2)
Пример.Определить рН 0,01 М раствора КОН
Р е ш е н и е
 если растворы разбавленные, то
если растворы разбавленные, то  ;
;
 моль/л
моль/л
 моль/л
моль/л

в) Составить молекулярное и молекулярно-ионное уравнения реакций гидролиза соли и оценить рН раствора
Пример. Составить молекулярное и ионно-молекулярное уравнения реакций гидролиза солей NH4NO3, Li2SO3 и Al(CH3COO)3 и оцените рН раствора
Р е ш е н и е
Гидролиз соли
1. При растворении в воде соль слабого основания и сильной кислоты (NH4NO3) диссоциирует:
NH4NO3  NH
NH 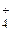 + NO
+ NO 
Молекулы воды находятся в равновесии
Н2О  Н+ + ОН-
Н+ + ОН-
Ионы NH 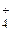 связывают ОН
связывают ОН  - ионы воды в слабый электролит NH4OH. Молекулярно-ионное уравнение гидролиза:
- ионы воды в слабый электролит NH4OH. Молекулярно-ионное уравнение гидролиза:
NH 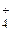 + Н2О
+ Н2О  NH4OH + Н+
NH4OH + Н+
В растворе накапливаются Н+ ионы. Реакция среды кислая, рН < 7.
Уравнение гидролиза в молекулярной форме:
NH4NO3 + Н2О  NH4OH + HNO3
NH4OH + HNO3
2. Гидролиз соли сильного основания и слабой кислоты сульфит лития Li2SO3 при растворении в воде диссоциирует:
Li2SO3  2Li+ + SO
2Li+ + SO 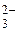
Ионы SO 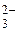 связывают Н+ ионы воды ступенчато, образуя кислые ионы HSO
связывают Н+ ионы воды ступенчато, образуя кислые ионы HSO  и молекулы слабой кислоты H2SO3. В растворе накапливаются ОН- ионы. Практически гидролиз ограничивается первой ступенью.
и молекулы слабой кислоты H2SO3. В растворе накапливаются ОН- ионы. Практически гидролиз ограничивается первой ступенью.
I ступень: SO 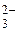 + H2O
+ H2O  HSO
HSO  + OH-
+ OH-
Na2SO3 + H2O  NaHSO3 + NaOH
NaHSO3 + NaOH
Реакция среды щелочная, рН >7.
II ступень: HSO  + H2O
+ H2O  H2SO3 + OH-
H2SO3 + OH-
NaHSO3 + H2O  H2SO3 + NaOH.
H2SO3 + NaOH.
3. Гидролиз соли слабого основания и слабой кислоты
Соль ацетат алюминия Al(CH3COO)3 в воде диссоциирует, образуя ионы:
Al(CH3COO)3  Al3+ + 3CH3COO-
Al3+ + 3CH3COO-
Ионы Al3+ и CH3COO- взаимодействуют с ионами воды, образуя малорастворимое соединение Al(OH)3 и малодиссоциирующее соединение СН3СООН (уксусную кислоту). То есть происходит необратимый гидролиз соли. Соль слабого основания и слабой кислоты гидролизуется полностью и необратимо.
Реакция среды нейтральная, рН = 7.
Al3+ + 3CH3COO- + 3Н2О = Al(OH)3 + 3СН3СООН
Al(CH3COO)3 + 3Н2О = Al(OH)3 + 3СН3СООН.
г) Образуется ли осадок труднорастворимого соединения, если смешать равные объемы растворов 2-х солей с известной молярной концентрацией См?
Пример. Образуется ли осадок труднорастворимого соединения СаSO4, если смешать равные объемы растворов Ca(NO3)2 и K2SO4 с молярной концентрацией См = 0,003 моль/л. Произведение растворимости ПР = 6,1·10-5 (250С).
= 6,1·10-5 (250С).
Р е ш е н и е
При смешении равных объемов растворов, объем стал в 2 раза больше, а концентрация каждого раствора уменьшилась вдвое:
 0,0015 моль/л,
0,0015 моль/л,  0,0015 моль/л.
0,0015 моль/л.
Концентрации ионов Са2+ и SO  соответственно равны:
соответственно равны:
 1,5 · 10-3 моль/л;
1,5 · 10-3 моль/л;  1,5 · 10-3 моль/л.
1,5 · 10-3 моль/л.
Осадок выпадает, если произведение концентраций ионов, его образующих, больше произведения растворимости (ПР)

 = 2,25 · 10-6 < ПР (6,1 · 10-5),
= 2,25 · 10-6 < ПР (6,1 · 10-5),
значит осадок не образуется.