 |
|
Первичный тромбоцитарно-сосудистый гемостаз
Обнажение субэндокардиальных структур в области атеросклеротической бляшки (коллагена, фактора Виллебранда, фибронектина, ламинина) способствует усиленной адгезии и агрегации тромбоцитов с образованием на поверхности поврежденной эрозированной атеросклеротической бляшки “белого” тромбоцитарного тромба.
Механизмы адгезии и агрегации тромбоцитов и образования тромбоцитарного сгустка подробно обсуждались в главе 5. Напомним, что основными факторами, определяющими процесс агрегации кровяных пластинок являются:
- тромбоксан А2 (активация метаболизма арахидоновой кислоты в тромбоцитах);
- тромбин;
- АДФ;
- серотонин;
- гликопротеиновые Iа, Ib рецепторы тромбоцитов, обеспечивающие адгезию и первоначальную агрегацию кровяных пластинок;
- гликопротеиновые IIb/IIIа рецепторы тромбоцитов, взаимодействие которых с фибриногеном на заключительном этапе агрегации тромбоцитов приводит к формированию относительно плотного тромбоцитарного тромба.
Вторичный, или коагуляционный, гемостаз
Вторичный, или коагуляционный, гемостаз обеспечивает плотную закупорку поврежденных сосудов так называемым “красным” тромбом, состоящим из сети волокон фибрина с захваченными ею клетками крови (тромбоцитами, эритроцитами и др.). Весь процесс свертывания крови, протекающий с участием специфических факторов свертывания (табл. 6.1), принято условно разделять на две основные фазы:
Таблица 6.1
Факторы свертывания крови (ФС) (по Р. Шмидту и Г. Гевсу в модификации)
| ФС | Название | Свойства |
| I | Фибриноген | Белок |
| II | Протромбин | α1-глобулин |
| III | Тканевой тромбопластин | Фосфолипопротеиды |
| IV | Ионы Са2+ | |
| V | Проакцелерин | β-глобулин |
| VII | Проконвертин | α-глобулин |
| VIII | Антигемофильный глобулин А (АГГ) в комплексе с фактором Виллебранда | β2-глобулин |
| IX | Фактор Кристмаса | α1-глобулин |
| Х | Фактор Стюарта–Прауэра | α1-глобулин |
| ХI | Плазменный предшественник тромбопластина (ППТ) | γ-глобулин |
| ХII | Фактор Хагемана | β-глобулин |
| ХIII | Фибринстабилизирующий фактор | β-глобулин |
| – | Прекалликреин (ПК), фактор Флетчера | β-глобулин |
| – | Высокомолекулярный кининоген (ВМК), фактор Фитцжеральда | α1-глобулин |
1. Фаза активации — многоступенчатый этап свертывания, завершающийся активизацией протромбина (фактор II) с превращением его в активный фермент тромбин (фактор IIа).
2. Фаза коагуляции — конечный этап свертывания, в результате которого под влиянием тромбина фибриноген (фактор I) превращается в фибрин.
Фаза активации. Центральным звеном сложных химических превращений этой фазы является образование так называемого “активатора протромбина”, который представляет собой ферментный комплекс, состоящий из активизированных факторов свертывания Ха, Va, ионов Са2+ и фосфолипопротеинов (рис. 6.9). Источником последних могут быть:
- фосфолипопротеины, высвобождающиеся при повреждении тканей, в частности эндотелия сосудов или соединительной ткани (тканевой тромбопластин — фактор III);
- фосфолипопротеины мембран тромбоцитов, выходящие в плазму при их разрушении (тромбоцитарный фактор 3).
Таким образом, формирование ключевого ферментного комплекса этой фазы — “активатора протромбина” — происходит двумя путями, в соответствие с которыми различают две системы свертывания.
1. Внешняя система, которая активируется при повреждении тканей в течение нескольких секунд. Фосфолипопротеины, выходящие из тканевых клеток (тканевой тромбопластин, или фактор III), в присутствии ионов Са2+ активируют фактор VII (проконвертин). Последний в комплексе с фосфолипопротеинами поврежденной ткани и ионами Са2+ в свою очередь активирует фактор Х, входящий затем в состав “активатора протромбина”.
2. Внутренняя система, активация которой происходит несколько медленнее (в течение минут) и без участия тканевого тромбопластина. Пусковым фактором этого механизма является фактор XII (фактор Хагемана), который активируется двумя путями:
- при контакте крови с коллагеном субэндотелия поврежденного сосуда или с любой чужеродной поверхностью (стеклом, металлом, каолином и т.д.);
- при ферментативном расщеплении фактора Хагемана протеолитическими ферментами (калликреином, тромбином, трипсином и др.) с участием высокомолекулярного кининогена (ВМК).
Фактор ХIIа активирует фактор XI. Последний в свою очередь активирует фактор IX. Наконец, фактор IХа образует ферментный комплекс с фосфолипопротеинами, высвобождающимися при разрушении тромбоцитов (т.е. с тромбоцитарным фактором 3), который в присутствии ионов Са2+ и плазменного фактора VIIIа (фактора Виллебранда) активирует фактор X. Последний также входит в состав “активатора протромбина”. Образовавшийся двумя путями ключевой ферментный комплекс — “активатор протромбина” — протеолитически расщепляет неактивный предшественник протромбин (фактор II) (молекулярная масса 72 000), в результате чего образуется активный протеолитический фермент тромбин (молекулярная масса 35 000), представляющий собой пептидазу. Действие тромбина не ограничивается только протеолизом фибриногена на следующем этапе свертывания крови. Тромбин способствует также необратимой агрегации тромбоцитов (см. выше), а также активирует ряд факторов свертывания (V, VIII, XIII).
Фаза коагуляции.В течение этой фазы происходит образование фибрина из его предшественника фибриногена (см. рис. 6.9). Процесс этот протекает в два этапа. На первом из них фибриноген расщепляется тромбином на четыре растворимых мономера фибрина (по два пептида А и В), у каждого из которых имеется по 4 свободные связи. На втором этапе мономеры соединяются друг с другом, формируя полимеры, из которых строятся волокна фибрина. Процесс необратимой полимеризации фибрина происходит с участием фибриностабилизирующего фактора XIII в присутствии ионов Са2+.
Однако на этой стадии трехмерная сеть волокон фибрина, которая содержит эритроциты, тромбоциты и другие клетки крови, все еще относительно рыхлая. Свою окончательную форму она принимает после ретракции сгустка, возникающей при активном сокращении волокон фибрина и выдавливании сыворотки. Благодаря ретракции сгустка он становится более плотным и стягивает края раны.

|
| Рис. 6.9. Схема свертывания крови. Красными стрелками обозначена активация факторов свертывания, черными — превращения. Римские цифры в кружочках с ровными контурами обозначают неактивированные факторы свертывания, в кружочках с неровными контурами — активированные факторы свертывания |
 Запомните
Выраженность тромбоза в месте разрыва атеросклеротической бляшки и продолжительность его существования определяют, в какой форме будет протекать в дальнейшем острый коронарный синдром: НС, ИМ без зубца Q или ИМ с зубцом Q. При нестабильной стенокардии нередко происходит самопроизвольный тромболизис и компенсаторная дилатация резистивных коронарных сосудов. В результате коронарный кровоток постепенно восстанавливается и наступает ремиссия. Если внутрикоронарный тромб более устойчив к действию компенсаторных механизмов, а период резкого ограничения кровотока и даже окклюзии КА сохраняется более длительное время (до 1 ч), развивается нетрансмуральный ИМ без зубца Q. Наконец, если КА окклюзируется хорошо фиксированным прочным тромбом (смешанным или “красным”, фибринным), развивается трансмуральный ИМ с зубцом Q. Запомните
Выраженность тромбоза в месте разрыва атеросклеротической бляшки и продолжительность его существования определяют, в какой форме будет протекать в дальнейшем острый коронарный синдром: НС, ИМ без зубца Q или ИМ с зубцом Q. При нестабильной стенокардии нередко происходит самопроизвольный тромболизис и компенсаторная дилатация резистивных коронарных сосудов. В результате коронарный кровоток постепенно восстанавливается и наступает ремиссия. Если внутрикоронарный тромб более устойчив к действию компенсаторных механизмов, а период резкого ограничения кровотока и даже окклюзии КА сохраняется более длительное время (до 1 ч), развивается нетрансмуральный ИМ без зубца Q. Наконец, если КА окклюзируется хорошо фиксированным прочным тромбом (смешанным или “красным”, фибринным), развивается трансмуральный ИМ с зубцом Q.
|
Следует, правда, заметить, что нередко в клинической практике наблюдаются исключения из этого правила. Так например, у 1/4 больных нетрансмуральным ИМ без зубца Q при ангиографии выявляется полная окклюзия КА, а перфузия миокарда, относящегося к бассейну окклюзированной КА, осуществляется через хорошо развитые коллатерали. Наоборот, пристеночный тромбоз, формирование которого сопровождается выраженным и длительным спазмом КА, может привести к развитию трансмурального ИМ с зубцом Q, если коллатеpали не выражены.
| 6.3. Нестабильная стенокардия |

|
Термин “нестабильная стенокардия” (НС), предложенный Н. Fovler (1971) и С. Conty с соавт. (1973), используется в настоящее время для обозначения наиболее тяжелого периода течения ИБС, для которого характерно быстрое прогрессирование коронарной недостаточности и высокий риск развития ИМ и внезапной сердечной смерти (до 15–20% в течение 1 года). Выделение этой формы ИБС, несомненно, имеет большое практическое значение, так как нацеливает врача на возможно более раннее выявление и интенсивное лечение больных с высоким риском возникновения фатальных осложнений.
К нестабильной стенокардии относят следующие клинические формы.
1. Впервые возникшая стенокардия нестабильного течения (в течение 1 мес после возникновения первого приступа стенокардии).
2. Прогрессирующая стенокардия напряжения (внезапное увеличение частоты, тяжести, продолжительности приступов стенокардии напряжения в ответ на обычную для данного больного физическую нагрузку, снижение эффективности нитроглицерина и других лекарственных средств, ранее с успехом применявшихся пациентом).
3. Тяжелые и продолжительные приступы стенокардии покоя (более 15–20 мин), в том числе тяжелые случаи спонтанной (вариантной) стенокардии.
4. Ранняя постинфарктная и послеоперационная (после аортокоронарного шунтирования, транслюминальной ангиопластики и т.д.) стенокардия.
В ряде случаев к НС могут быть отнесены и другие формы ИБС, описанные в предыдущей главе, например БИМ и микроваскулярная форма стенокардии, тяжелые и продолжительные приступы вазоспастической стенокардии Принцметала.
 Запомните
1. Различные варианты нестабильной стенокардии представляют собой клинические проявления выраженного обострения ИБС, сопровождающегося не только кратковременной ишемией миокарда, но и его дистрофическими изменениями, а иногда и микронекрозами, высоким риском возникновения ИМ и внезапной сердечной смерти. 2. Морфологической основой нестабильной стенокардии является “осложненная” атеросклеротическая бляшка, на поврежденной поверхности которой (оболочке) формируется тромбоцитарный (“белый”), чаще пристеночный, тромб. 3. Основными патогенетическими факторами, ограничивающими коронарный кровоток при нестабильной стенокардии, являются: Запомните
1. Различные варианты нестабильной стенокардии представляют собой клинические проявления выраженного обострения ИБС, сопровождающегося не только кратковременной ишемией миокарда, но и его дистрофическими изменениями, а иногда и микронекрозами, высоким риском возникновения ИМ и внезапной сердечной смерти. 2. Морфологической основой нестабильной стенокардии является “осложненная” атеросклеротическая бляшка, на поврежденной поверхности которой (оболочке) формируется тромбоцитарный (“белый”), чаще пристеночный, тромб. 3. Основными патогенетическими факторами, ограничивающими коронарный кровоток при нестабильной стенокардии, являются:
| ||
| 6.3.1. Клиническая картина | ||

| ||
Выше было показано, что к НС относятся несколько клинических форм ИБС, каждая из которых отличается существенными клиническими особенностями. Примерно у 2/3 больных НС наблюдаются затяжные приступы стенокардии покоя. На долю прогрессирующей стенокардии напряжения и впервые возникшей стенокардии приходится оставшаяся 1/3 случаев.
 Запомните
При постановке диагноза НС необходимо ориентироваться не столько на нозологическую принадлежность к той или иной форме ИБС, сколько на главный и единственный общий клинический критерий различных вариантов НС — быстро меняющийся характер, интенсивность и длительность болевых приступов, прогрессирующее снижение толерантности к физической нагрузке, а также эффективности обычной для данного больного антиангинальной терапии. Запомните
При постановке диагноза НС необходимо ориентироваться не столько на нозологическую принадлежность к той или иной форме ИБС, сколько на главный и единственный общий клинический критерий различных вариантов НС — быстро меняющийся характер, интенсивность и длительность болевых приступов, прогрессирующее снижение толерантности к физической нагрузке, а также эффективности обычной для данного больного антиангинальной терапии.
|
Впервые возникшая стенокардия
Впервые возникшая стенокардия (ВВС) диагностируется в тех случаях, когда приступы стенокардии напряжения и/или покоя впервые появились у пациента не более 1 месяца назад. Поначалу приступы могут напоминать боли при стабильной стенокардии напряжения. В типичных случаях приступы болей возникают на фоне физической или психоэмоциональной нагрузки, особенно в холодную и ветреную погоду, локализуются за грудиной, иррадиируют в левую руку, лопатку, плечо. Длительность боли, как правило, не превышает 1–5 мин. Боль купируется нитроглицерином и/или прекращением действия провоцирующих факторов.
Однако очень скоро часть больных с ВВС замечают, что приступы ангинозных болей повторяются все чаще и становятся все более интенсивными и продолжительными. На протяжении короткого времени (1–4 недели) они приводят к заметному снижению толерантности к физической нагрузке. Иногда боли появляются в покое и сопровождаются чувством нехватки воздуха, резкой слабостью, потливостью, головокружением. Следует помнить, что каждый такой ангинозный приступ у больных с описанным нестабильным течением ВВС может закончиться развитием ИМ или даже внезапной смертью.
Строго говоря, ВВС не является синонимом НС и не всегда может быть связана с осложненной атеросклеротической бляшкой. В этих случаях ВВС характеризуется более “спокойным” стабильным течением: приступы стенокардии, хотя и рецидивируют, но провоцируются обычно значительным физическим или психоэмоциональным напряжением, толерантность больных длительное время не снижается. При этом с самого начала имеет место медленно формирующийся стеноз КА, который на определенном этапе становится лишь гемодинамически значимым и проявляется впервые возникшей стенокардией напряжения, которая сразу носит стабильный характер (П.Х. Джанашия с соавт.). Через 1–1,5 месяца от начала заболевания такое течение ИБС расценивается как стабильная стенокардия напряжения.
Тем не менее характер дальнейшего течения ВВС (стабильный или нестабильный) у пациента с недавно появившимися ангинозными приступами предсказать очень трудно. Поэтому каждый такой случай требует от врача самого пристального внимания к развитию всех симптомов болезни. Несомненно, что каждый больной с ВВС должен наблюдаться в кардиологическом стационаре, где ему может быть оказана своевременная медицинская помощь и проведено соответствующее обследование (см. ниже).
Рассматривая особенности болевого синдрома при ВВС как стабильного, так и нестабильного течения, следует иметь в виду сравнительно высокую частоту возникновения у этих больных, особенно у лиц молодого возраста, атипичной стенокардии, напоминающей клинику вегетативной дисфункции. Боли в области сердца могут иметь значительную продолжительность, нередко локализуются не за грудиной, а в области верхушки сердца, слева от грудины или в эпигастрии, часто провоцируются не физической нагрузкой, а возникают как бы спонтанно, что подчеркивает значение динамической окклюзии коронарной артерии, обусловленной ее спазмом.
Прогрессирующая стенокардия напряжения
Прогрессирующая стенокардия напряжения (ПС) всегда расценивается как НС. Она возникает, как правило, у больных с более или менее длительным анамнезом стабильной стенокардии напряжения, свидетельствуя об “обострении” заболевания. Для диагностики ПС следует ориентироваться, прежде всего, на качественно изменившийся характер болевого синдрома:
1. У больных происходит значительное учащение и увеличение длительности и интенсивности приступов стенокардии напряжения.
2. Болевые приступы провоцируются все меньшей физической или психоэмоциональной нагрузкой, свидетельствуя об изменении функционального класса стенокардии (III ФК).
3. К стенокардии напряжения присоединяются приступы стенокардии покоя (если их не было ранее) (IV ФК).
4. Заметно снижается эффективность нитроглицерина и других антиангинальных препаратов, ранее использовавшихся больными для купирования или профилактики стенокардии.
Стенокардия покоя
Тяжелые и продолжительные приступы стенокардии покоя (если они не выявлялись ранее у данного пациента) представляют собой один из наиболее опасных в прогностическом отношении клинических вариантов НС. По некоторым данным, частота развития ИМ в течение 1–2 месяцев от момента возникновения первых таких ангинозных приступов достигает 40–50%, а летальность — 11–15%.
По сути эта форма может выявляться как у больных с прогрессирующей стенокардией напряжения (в тех случаях, когда к стенокардии напряжения присоединяются приступы стенокардии покоя), так и у пациентов с ВВС и стенокардией Принцметала. Возможно также внезапное появление подобных болевых приступов на фоне относительно стабильного течения заболевания.
Эта форма НС клинически проявляется повторными и тяжелыми приступами стенокардии покоя продолжительностью более 15–20 минут. Интенсивная загрудинная боль нередко сопровождается остро наступающей слабостью, потливостью, одышкой, преходящими нарушениями ритма и проводимости и/или внезапным снижением АД. Боль, как правило, появляется в покое, без предшествующих нагрузок, и становится все более рефрактерной к нитроглицерину. Для ее купирования нередко требуется применение наркотических анальгетиков. Толерантность к физической нагрузке при этом резко падает.
Тяжелые и частые приступы спонтанной (вариантной) стенокардии Принцметала также относятся к прогностически весьма неблагоприятной форме НС. По данным некоторых авторов, у 1/4 - 1/2 больных со спонтанной вариантной стенокардией в течение ближайших 2–3 месяцев развивается ИМ или внезапная сердечная смерть.
Ранняя постинфарктная стенокардия
Ранняя постинфарктная стенокардия, возникающая в период от 48 ч до 2 недель от начала острого ИМ, по своему прогностическому значению также относится к НС. Возобновление ангинозных приступов в раннем постинфарктном периоде существенно ухудшает как ближайший, так и отдаленный прогноз ИМ: к концу первого года частота рецедивов ИМ достигает 50%, а летальность — 17%. Ранняя постинфарктная стенокардия, как правило, свидетельствует о неполном тромболизисе в окклюзированной КА и о продолжающемся формировании тромба, в том числе и в других сосудистых областях, если имеет место многососудистое поражение КА.
Клинически ангинозная боль у этих больных мало чем отличается от обычной стенокардии, причем встречаются как случаи тяжелой стенокардии покоя и/или малых нагрузок, рефрактерных к антиангинальной терапии, так и случаи неинтенсивных ангинозных болей, провоцируемых лишь чрезмерной физической нагрузкой. Однако во всех этих случаях раннее возобновление стенокардии у больного с ИМ расценивается как НС.
Таким образом, тщательный анализ основных характеристик болевого синдрома и других анамнестических данных в большинстве случаев позволяет выделить среди больных ИБС пациентов с нестабильным течением заболевания.
 Запомните
Основными клиническими критериями НС являются: 1. Быстро меняющийся характер, интенсивность и частота приступов стенокардии напряжения, длительно существующей у больного (при прогрессирующей стенокардии), или недавно выявленной (при ВВС прогрессирующего течения). 2. Появление стенокардии покоя (если ранее ее не было), особенно тяжелых, спонтанно возникающих ангинозных приступов, продолжающихся более 15–20 мин. 3. Быстрое снижение толерантности к физической нагрузке и изменение функционального класса стенокардии. 4. Снижение эффективности обычной для данного больного антиангинальной терапии. 5. Появление частых ночных ангинозных приступов (в том числе вазоспастической стенокардии Принцметала). 6. Появление ранней постинфарктной стенокардии (2–14 суток от начала ИМ). Запомните
Основными клиническими критериями НС являются: 1. Быстро меняющийся характер, интенсивность и частота приступов стенокардии напряжения, длительно существующей у больного (при прогрессирующей стенокардии), или недавно выявленной (при ВВС прогрессирующего течения). 2. Появление стенокардии покоя (если ранее ее не было), особенно тяжелых, спонтанно возникающих ангинозных приступов, продолжающихся более 15–20 мин. 3. Быстрое снижение толерантности к физической нагрузке и изменение функционального класса стенокардии. 4. Снижение эффективности обычной для данного больного антиангинальной терапии. 5. Появление частых ночных ангинозных приступов (в том числе вазоспастической стенокардии Принцметала). 6. Появление ранней постинфарктной стенокардии (2–14 суток от начала ИМ).
| ||
| 6.3.2. Классификация нестабильной стенокардии | ||

| ||
С целью оценки прогностической значимости симптомов НС и выделения группы лиц с особенно неблагоприятным течением заболевания E. Braunwald в 1989 г. была предложена классификация НС, модифицированная в 2000 г. (C.W. Hamm, E. Braunwald), в которой НС делится на классы и формы в зависимости от тяжести клинической картины заболевания и условий возникновения острого коронарного синдрома (табл. 6.2).
Таблица 6.2.
Классификация нестабильной стенокардии (C.W. Hamm, E. Braunwald, 2000)
| Классы НС | Формы НС | ||
| А — развивается в присутствии экстракардиальных факторов, которые усиливают ишемию миокарда Вторичная НС | В — развивается без экстракардиальных факторов Первичная НС | С — возникает в пределах 2-х недель после ИМ Постинфарктная стенокардия | |
| I — Первое появление тяжелой стенокардии или прогрессирующая стенокардия напряжения (без стенокардии покоя) | IА | IВ | IС |
| II — Стенокардия покоя в предшествующий месяц, но не в ближайшие 48 ч (стенокардия покоя, подострая) | IIА | IIВ | IIС |
| III — Стенокардия покоя в предшествующие 48 ч (стенокардия покоя, острая) | IIIА | IIIВ IIIВ — тропонин – IIIВ — тропонин + | IIIС |
В основу этой классификации положены характер и сроки появления болевого синдрома. Наиболее серьезным в прогностическом отношении является III класс НС, при котором стенокардия покоя наблюдалась в течение последних 2-х суток перед обращением к врачу. Именно у этой категории больных НС риск развития ИМ или внезапной сердечной смерти является наиболее высоким.
Важным представляется также выделение различных форм заболевания в зависимости от условий возникновения острого коронарного синдрома. Наиболее серьезный прогноз следует ожидать у больных с так называемой первичной НС III класса, особенно у пациентов с положительными маркерами некроза миокарда (тропонин-положительные).
Приведенная классификация E. Braunwald в настоящее время широко используется в научных исследованиях, однако в клинической практике более удобной представляется оценка кратковременного риска тех или иных осложнений НС на основании следующих клинических критериев, представленных в табл. 6.3.
Таблица 6.3.
Клинические критерии кратковременного риска у больных нестабильной стенокардией (по E. Braunwald, в модификации)
| Группа высокого риска* | Группа промежуточного риска** | Группа низкого риска*** |
| Стенокардия покоя более 20 мин | Стенокардия покоя в момент осмотра купирована, но сохраняется возможность ее возобновления | Увеличение частоты и продолжительности стенокардии |
| Отек легких | Стенокардия, сопровождающаяся динамическими изменениями зубца Т | Снижение порога возникновения стенокардии |
| Появление или усиление шума митральной регургитации | Ночная стенокардия | Появление стенокардии в течение последних 2-х недель — 2-х месяцев |
| Стенокардия покоя с транзиторными смещениями сегмента RS–T не менее 1 мм | Появление в течение 2-х последних недель стенокардии напряжения III или IV ФК | Отсутствие изменений на ЭКГ |
| Стенокардия, сопровождающаяся появлением патологического III тона сердца | Наличие патологических зубцов Q или депрессии сегмента RS–T более 1 мм в нескольких отведениях | |
| Появление влажных хрипов в легких | Возраст более 65 лет | |
| Стенокардия, сопровождающаяся артериальной гипотензией | ||
| Повышенный уровень тропонинов в крови (или других маркеров некроза миокарда) |
Примечание:
* — высокий риск диагностируется при наличии хотя бы одного из нижеперечисленных критериев; ** — принадлежность к группе промежуточного риска диагностируется при отсутствии критериев высокого риска и наличии хотя бы одного из нижеперечисленных критериев;
*** — принадлежность к группе низкого риска диагностируется при отсутствии критериев высокого и промежуточного риска и наличии хотя бы одного из нижеперечисленных критериев.
Оценка кратковременного риска НС крайне необходима для выбора оптимального метода лечения больных.
| 6.3.3. Диагностика |

|
Все больные с НС должны быть госпитализированы в блоки интенсивной терапии кардиологических отделений стационаров. При этом следует помнить, что чем меньше времени прошло от начала дестабилизации состояния больного, тем выше риск развития ИМ или внезапной сердечной смерти и тем больше показана срочная госпитализация. Особенно быстро этот вопрос должен решаться при таких вариантах НС, как ВВС прогрессирующего течения, спонтанная (вариантная) стенокардия Принцметала и тяжелые и длительные приступы стенокардии покоя.
Следует также подчеркнуть, что правилом для врача должна явиться обязательная госпитализация в специализированный стационар всех больных ВВС, если симптомы болезни возникли менее 1 месяца назад. Это связано, во-первых, со сложностью прогнозирования дальнейшего развития симптомов болезни даже у больных с относительно стабильным течением ВВС и, во-вторых, с необходимостью более детального обследования этих пациентов с целью уточнения диагноза, морфологической основы и патогенетических механизмов коронарной недостаточности и проведения дифференциальной диагностики с некоронарогенными кардиалгиями.
Диагностический поиск в блоке кардиореанимации и затем в кардиологическом отделении преследует обычно следующие цели.
1.Подтверждение диагноза НС и ее клинического варианта и проведение дифференциального диагноза с острым ИМ.
2. Уточнение преобладающих патогенетических механизмов, лежащих в основе обострения коронарной недостаточности у данного больного.
3.Оценка характера и степени повреждения миокарда ЛЖ.
4. Выделение среди больных НС лиц с высоким риском развития острого ИМ и/или внезапной сердечной смерти.
Для решения этих задач необходимо оценить:
- динамику болевого синдрома на фоне проведения интенсивной антиангинальной терапии;
- динамику ЭКГ, особенно во время спонтанных приступов стенокардии;
- результаты суточного мониторирования ЭКГ по Холтеру;
- динамику уровня кардиоспецифических ферментов (КФК, МВ КФК, АсАт, ЛДГ, ЛДГ1), а также концентрации миоглобина и тропонинов I и Т;
- данные ЭхоКГ;
- состояние системы гемостаза;
- результаты, полученные при коронароангиографии.
Электрокардиография
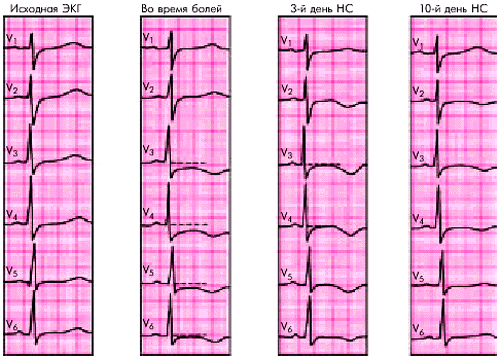
Исследование ЭКГ12в межприступном периоде у многих больных с синдромом НС имеет ограниченное значение, особенно у больных с ВВС и спонтанной стенокардией Принцметала. Лишь при глубокой и распространенной ишемии с очагами повреждения миокарда и иногда микронекрозами кардиомиоцитов на ЭКГ в течение 1–4 дней могут регистрироваться преходящие изменения конечной части желудочкового комплекса.
Чаще наблюдается депрессия сегмента RS–T (более 1 мм) горизонтального или косонисходящего типа, которая в большинстве случаев сочетается с соответствующими измененями зубцов Т (рис. 6.10) — их сглаженностью или формированием отрицательных равносторонних и остроконечных (“коронарных”) зубцов Т (больше 1 мм). В других случаях отрицательная динамика Т является единственным, хотя и неспецифическим, электрокардиографическим подтверждением развившейся ишемии миокарда.
Сохранение этих изменений в течение нескольких дней после начала дестабилизации ИБС указывает на более глубокое, чем при стабильной стенокардии, ишемическое повреждение миокарда ЛЖ.
Следует подчеркнуть, что такая же отрицательная динамика ЭКГ может выявляться и в случаях прогрессирования безболевой ишемии миокарда, т.е. у пациентов, у которых отсутствует болевой синдром. Следовательно, любая более или менее стойкая отрицательная динамика ЭКГ у больного ИБС, даже если она не сопровождается болевыми ангинозными приступами, требует углубленного обследования на предмет наличия или отсутствия других признаков дестабилизации заболевания.
|
| Рис. 6.10. Динамика ЭКГ (грудные отведения) у больного с нестабильной стенокардией |
 Запомните
1. Для большинства больных НС характерна отрицательная динамика ЭКГ в виде депрессии сегмента RS–T (больше 1 мм) и изменений зубца Т, сохраняющихся в течение нескольких дней от начала дестабилизации ИБС. 2. Описанные динамические изменения ЭКГ не являются строго специфичными для НС и могут выявляться на фоне приема некоторых лекарственных средств (например, дигоксина) или нарушений электролитного обмена. 3. Отсутствие отрицательной динамики ЭКГ не исключает диагноз нестабильной стенокардии. Запомните
1. Для большинства больных НС характерна отрицательная динамика ЭКГ в виде депрессии сегмента RS–T (больше 1 мм) и изменений зубца Т, сохраняющихся в течение нескольких дней от начала дестабилизации ИБС. 2. Описанные динамические изменения ЭКГ не являются строго специфичными для НС и могут выявляться на фоне приема некоторых лекарственных средств (например, дигоксина) или нарушений электролитного обмена. 3. Отсутствие отрицательной динамики ЭКГ не исключает диагноз нестабильной стенокардии.
|
Подъем сегмента RS–T указывает на трансмуральную ишемию миокарда, развившуюся вследствие окклюзии КА. Стойкий подъем сегмента RS–T характерен для развивающегося ИМ (ИМ “в ходу”). Преходящий подъем сегмента RS–T может быть выявлен во время приступа вазоспастической стенокардии Принцметала.
Длительное мониторирование ЭКГ по Холтеру является наиболее информативным методом изучения электрической активности сердечной мышцы у больных НС. Холтеровское мониторирование ЭКГ позволяет выявить:
- ишемические изменения ЭКГ во время спонтанных приступов стенокардии;
- частоту и продолжительность эпизодов болевой и безболевой ишемии;
- преходящие нарушения ритма и проводимости.
У большинства больных с синдромом НС при суточном мониторировании выявляются транзиторные ишемические изменения сегмента RS–T, в том числе эпизоды безболевой ишемии. Чаще наблюдается смещение сегмента RS–Т ниже изоэлектрической линии (на 1,0 мм и более), что свидетельствует о возникновении субэндокардиальной ишемии миокарда. У больных с нестабильным течением спонтанной (вариантной) формы стенокардии во время ангинозного приступа, сопровождающегося, как известно, динамической окклюзией КА (выраженным спазмом), можно обнаружить подъем сегмента RS–Т выше изолинии, указывающий на наличие преходящей трансмуральной ишемии миокарда.
Характерно, что в группе больных с НС существенно чаще, чем у больных со стабильным течением заболевания, обнаруживаются суточные колебания сегмента RS–T и преходящие желудочковые аритмии высоких градаций. Особенно неблагоприятным признаком является безболевая ишемия миокарда, не сопровождающаяся возникновением приступа стенокардии. Наличие безболевой ишемии миокарда существенно повышает риск внезапной сердечной смерти и острого ИМ. Прогноз остается неблагоприятным даже в тех случаях, когда под влиянием антиангинальной терапии уменьшается количество спонтанных болевых приступов стенокардии, но число эпизодов безболевой ишемии сохраняется прежним.
 Запомните
1. Чем больше частота возникновения у больных НС транзиторных ишемических изменений сегмента RS–T и их продолжительность, тем выше риск развития ИМ и внезапной сердечной смерти. 2. Особенно неблагоприятным признаком у больных НС является наличие безболевой ишемии миокарда, не сопровождающейся приступами стенокардии. Запомните
1. Чем больше частота возникновения у больных НС транзиторных ишемических изменений сегмента RS–T и их продолжительность, тем выше риск развития ИМ и внезапной сердечной смерти. 2. Особенно неблагоприятным признаком у больных НС является наличие безболевой ишемии миокарда, не сопровождающейся приступами стенокардии.
|
Функциональные нагрузочные тесты. У больных НС с низким риском ИМ и внезапной смерти непосредственно перед выпиской из стационара и не раньше чем через 7–10 дней после приступа ангинозной боли, проводят стресс-тесты (с физической нагрузкой или фармакологические) с целью объективной оценки степени риска заболевания. Главным условием их проведения является отсутствие повторных эпизодов болевой или безболевой (по данным ЭКГ или холтеровского мониторирования) ишемии миокарда в покое. Низкая толерантность к нагрузке и выраженные ишемические изменения ЭКГ во время проведения теста служат показанием для осуществления коронароангиографии и решения вопроса о целесообразности реваскуляризации (см. ниже).
Лабораторные тесты
Биохимический анализ кровиу больных НС дает возможность:
- оценить активность кардиоспецифических ферментов и других маркеров некроза с целью дифференциальной диагностики НС и острого ИМ;
- оценить выраженность и характер нарушений липидного, углеводного и других видов обмена.
Активность кардиоспецифических ферментов (КФК, МВ КФК, АсАТ, ЛДГ, ЛДГ1) при НС в большинстве случаев не отличается от нормы. Лишь изредка при тяжелом течении заболевания на фоне длительной и необратимой ишемии миокарда может произойти некротизация отдельных кардиомиоцитов. В этих случаях наблюдается небольшое повышение активности указанных ферментов, но не более чем на 40% от верхней границы нормы.
В то же время следует иметь в виду, что такое же повышение активности КФК, ЛДГ, МВ КФК и других ферментов может быть и при отсутствии некротизации сердечной мышцы (при различных заболеваниях внутренних органов, повреждении скелетных мышц, после кардиоверсии и т.д.). В этих случаях диагноз уточняется при проведении сцинтиграфии с 99mТс (технецием пирофосфатом) и при тщательном анализе всей клинической картины заболевания.
Определение современных маркеров некроза (тропонины I и Т) имеет важное значение для выделения группы больных НС с высоким риском ИМ и внезапной смерти. В настоящее время уровень тропонинов в сыворотке крови считается наиболее специфическим и чувствительным лабораторным тестом для диагностики некроза кардиомиоцитов и дифференциальной диагностики НС и острого ИМ. На рис. 6.11 видно, что у больных с НС и высоким риском развития ИМ или внезапной смерти нередко наблюдается небольшое повышение уровня тропонинов, что свидетельствует о наличии у этих пациентов микронекрозов в сердечной мышце и плохом прогнозе заболевания. Повышение уровня тропонинов при классическом ИМ существенно отличается от результатов, полученных у больных НС: амплитуда и продолжительность повышения тропонинов оказываются значительно более выраженными.
| Рис. 6.11. Изменение уровня тропонинов при нестабильной стенокардии (кривая красного цвета) и инфаркте миокарда. Для сравнения приведена кривая повышения уровня МВ КФК у больного острым инфарктом миокарда | 
|
Нарушения углеводного и инсулинового обмена могут значительно ухудшать ближайший и отдаленный прогноз НС, так как существенно повышают риск возникновения ИМ и внезапной сердечной смерти. Так же, как при стабильной стенокардии напряжения, гиперлипидемия выявляется у значительной части больных НС. Имеется определенная зависимость между уровнем общего ХС, ХС ЛНП и количеством пораженных КА, толерантностью к физической нагрузке и глобальной систолической функцией ЛЖ (Е.П. Кохан с соавт., 2000).
Нарушения в системе гемостаза, закономерно выявляющиеся у больных НС, играют важную роль как в дестабилизации ИБС (в формировании “осложненной” атеросклеротической бляшки), так и в определении исходов НС. Поэтому у каждого больного с НС целесообразно по возможности более тщательно изучить состояние всех трех звеньев этой системы: 1) сосудисто-тромбоцитарного гемостаза; 2) системы коагуляционного гемостаза; 3) системы фибринолиза. С этой целью необходимо определение следующих показателей:
- активированное время рекальцификации (АВР);
- активированное частичное тромбопластиновое время (АЧТВ);
- фибриноген плазмы;
- фибринолитическая активность крови;
- свободный гепарин крови;
- адгезивность и агрегация тромбоцитов, агрегация эритроцитов;
- протромбиновый индекс;
- антитромбин III;
- аутокоагуляционный тест;
- время свертывания цельной крови;
- тромбиновое время;
- показатели вязкости крови;
- тромбоэластограммы.
Базисные методы определения состояния системы свертывания крови позволяют оценить следующие признаки гиперкоагуляции у больных НС.
1. Укорочение времени свертывания цельной крови (меньше 5 мин).
2. Укорочение времени рекальцификации плазмы (менее 60–120 с при использовании кальция хлорида и менее 50–70 с — при использовании каолина).
3. Уменьшение активированного частичного тромбопластинового времени (АЧТВ) — кефалин-каолиновое время меньше 35–50 с.
4. Увеличение протромбинового индекса более 100% (или уменьшение протромбинового времени).
5. Изменение основных показателей тромбоэластограммы: укорочение времени реакции (R) и времени коагуляции (К) и увеличение максимальной амплитуды (Мa) тромбоэластограммы (рис. 6.12).
6. Дефицит антитромбина III — важнейшего физиологического антикоагулянта.
7. Повышение адгезии и агрегации тромбоцитов.
8. Увеличение концентрации фибриногена (более 2–4 г/л).
9. Появление в плазме растворенных фибрин-мономерных комплексов с фибриногеном (РФМК).
10. Повышение продуктов деградации фибрина (ПДФ) — более 0,015 г/л.
Увеличение последних двух показателей — признак усиливающегося свертывания крови, сопровождающегося активацией фибринолитической системы (см. ниже).
В реальной клинической практике бывает достаточно определения времени АЧТВ, которое служит в качестве контрольного теста при лечении больных антитромбиновыми препаратами.
| Рис. 6.12. Тромбоэластограмма в норме (а); при гиперкоагуляции (б) и гипокоагуляции (в). Схема | 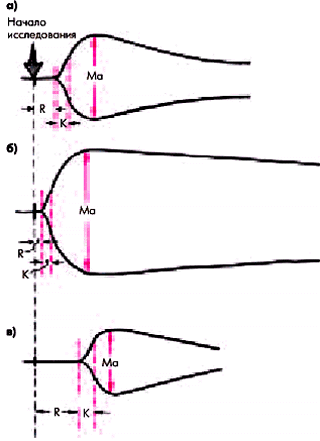
|
Эхокардиография
Эхокардиографическое исследование у больных НС дает возможность количественно оценить степень систолической и диастолической дисфункции ЛЖ, а также выявить признаки нарушения локальной сократимости, обусловленные как острым ишемическим повреждением кардиомиоцитов, так и наличием у некоторых больных НС постинфарктного кардиосклероза.
Нарушения глобальной систолической функции ЛЖ оцениваются по величине ФВ, степени укорочения переднезаднего размера ЛЖ в систолу (%DS) и другим показателям (КДО, КСО, МО, СИ, размеры ЛП). Прогностическое значение имеет снижение ФВ меньше 40%, которое выявляется более чем у половины больных НС, чаще у пациентов с длительным анамнезом ИБС и больных, перенесших в прошлом ИМ. В то же время даже у относительно молодых пациентов с ВВС примерно в 1/4–1/3 случаев также можно обнаружить снижение систолической функции ЛЖ, обусловленное ишемическим повреждением миокарда. Под влиянием лечения, направленного на восстановление перфузии миокарда, происходит уменьшение признаков систолической дисфункции ЛЖ, что подтверждает ишемический генез снижения сократимости ЛЖ.
Выявление у больных НС локальных нарушений сократимости ЛЖ с помощью двухмерной ЭхоКГ имеет особое диагностическое и прогностическое значение. Как известно, асинергия ЛЖ у больных ИБС может быть обусловлена 4 основными причинами: 1) острым ИМ; 2) постинфарктным кардиосклерозом; 3) кратковременной преходящей болевой или безболевой ишемией миокарда и 4) постоянно действующей ишемией жизнеспособного миокарда (гибернирующий миокард), а также существованием так называемого “оглушенного” миокарда.
При остром трансмуральном ИМ с зубцом Q или постинфарктном кардиосклерозе эхокардиографические признаки локальных нарушений сократимости ЛЖ (чаще акинезия или дискинезия) сохраняются длительное время, как правило, в течение всей жизни больного и соответствуют электрокардиографическим маркерам острого или перенесенного ИМ (патологический зубец Q или комплекс QS).
Участки гипокинезии ЛЖ, обнаруживаемые у больных с кратковременной преходящей ишемией миокарда, вызванной очередным приступом стабильной стенокардии или индуцированной функциональным нагрузочным тестом (велоэргометрия, тредмил-тест, фармакологические пробы), как правило, через несколько минут после прекращения нагрузки или купирования приступа стенокардии не выявляются. На этом основана диагностика ИБС с помощью метода стресс-эхокардиографии.
Более чем у половины больных с НС гипокинезия ЛЖ может сохраняться от одного до нескольких дней после купирования болевого приступа, свидетельствуя о более серьезных нарушениях коронарного кровообращения и более глубоком ишемическом повреждении миокарда. Это является важным диагностическим признаком НС, отличающим эту форму ИБС от приступов стабильной стенокардии.
Причиной таких локальных нарушений сократимости ЛЖ, сохраняющихся у больных НС в течение нескольких дней от начала дестабилизации болезни, могут являться дистрофические изменения и даже некрозы кардиомиоцитов в ограниченных участках сердечной мышцы, расположенных в бассейне нарушенного коронарного кровообращения.
Кроме того, следует иметь в виду еще два возможных механизма снижения локальной сократимости ЛЖ, которые особенно часто наблюдаются у больных НС.
1. Феномен гибернирующего (“спящего”) миокарда, находящегося в условиях хронического снижения коронарной перфузии.
2. Феномен “оглушения”, выявляющийся после восстановления исходной перфузии тканей (реперфузии).
Оба феномена были описаны в главе 5. Напомним, что феномен гибернации миокарда (hybernatio, “спячка”) заключается в нарушении локальной сократимости ЛЖ, возникающем при выраженном и продолжительном снижении его перфузии и не сопровождающемся иными признаками ишемии. Феномен гибернации является своеобразной формой клеточного анабиоза, обеспечивающего выживаемость кардиомиоцитов в условиях дефицита кислорода. Важно помнить, что гибернирующий миокард реагирует на введение катехоламинов: например, под влиянием малых доз добутамина временно восстанавливается сократимость миокарда, что доказывает его жизнеспособность. Феномен “оглушенного” миокарда (stunning) — это преходящее постишемическое нарушение локальной сократимости ЛЖ, возникающее после восстановления исходного коронарного кровообращения (реперфузии) и прекращения действия ишемии. Оба феномена очень характерны для больных с “обострением” ИБС, в том числе для пациентов с НС, хотя встречаются и при стабильном течении заболевания.
 Запомните
1. Примерно у половины больных НС обнаруживаются эхокардиографические признаки снижения глобальной систолической функции ЛЖ, в частности, уменьшение ФВ ниже 40%. 2. Нарушения локальной сократимости ЛЖ у больных НС, как правило, сохраняются в течение нескольких дней после ангинозных приступов, свидетельствуя о наличии более значительных нарушений коронарного кровотока и метаболизма кардиомиоцитов. 3. Основной причиной относительно продолжительного снижения локальной сократимости ЛЖ у больных НС являются: Запомните
1. Примерно у половины больных НС обнаруживаются эхокардиографические признаки снижения глобальной систолической функции ЛЖ, в частности, уменьшение ФВ ниже 40%. 2. Нарушения локальной сократимости ЛЖ у больных НС, как правило, сохраняются в течение нескольких дней после ангинозных приступов, свидетельствуя о наличии более значительных нарушений коронарного кровотока и метаболизма кардиомиоцитов. 3. Основной причиной относительно продолжительного снижения локальной сократимости ЛЖ у больных НС являются:
|
Добавим, что нарушения локальной сократимости в области заднедиафрагмальной стенки ЛЖ свидетельствуют, как правило, о стенозировании (органическом или динамическом) правой коронарной артерии, а соответствующие нарушения переднеперегородочной и верхушечной локализации — об ограничении коронарного кровотока в бассейне ЛКА.
Если у больных НС, несмотря на интенсивную антиангинальную и антитромбоцитарную терапию, нарастают симптомы коронарной недостаточности и сохраняется высокий риск возникновения ИМ и ВCС, должен быть решен вопрос о целесообразности хирургической реваскуляризации зон ишемии. В этих случаях больной должен быть переведен в специализированные кардиохирургические центры, где проводится КАГ и уточняется характер поражения КА, локализация и распространенность патологического процесса, а также состояние коллатерального кровообращения, после чего решается вопрос о выборе способа реваскуляризации.
Сцинтиграфия миокарда
Сцинтиграфия миокарда с 201Т1, зарегистрированная в покое (без нагрузки), позволяет выявить у части больных НС дефекты накопления радиопрепарата в зонах нарушенной перфузии миокарда и оценить их локализацию и распространенность. Чем меньше времени прошло с момента ангинозного приступа, тем больше шансов обнаружить эти дефекты. Если перфузия миокарда полностью восстановлена, “холодные” зоны локального снижения радиоактивности на сцинтиграммах больше не выявляются. В отличие от этого при остром ИМ или постинфарктном кардиосклерозе “холодные” зоны резкого снижения или отсутствия радиоактивности обнаруживаются в течение длительного времени.
Таким образом, у части больных НС сцинтиграфия миокарда с 201Т1 позволяет визуализировать зоны локального снижения перфузии миокарда, определить их распространенность и локализацию.
Коронароангиография (КАГ)
Проведение КАГ у больных НС позволяет уточнить локализацию, распространенность и характер поражения коронарного русла, а также оценить выраженность коллатерального кровообращения. Эти данные необходимы, прежде всего, для решения вопроса о целесообразности проведения чрескожной коронарной ангиопластики и особенно показаны у больных НС с высоким риском возникновения острого ИМ и внезапной сердечной смерти:
- больным с повторными эпизодами ишемии миокарда (рецидивы боли или отрицательная динамика сегмента RS–T);
- больным с повышенным содержанием в сыворотке крови тропонинов или МВ КФК;
- пациентам с нестабильной гемодинамикой (артериальная гипотензия или прогрессирующая сердечная недостаточность);
- больным с угрожающими нарушениями ритма (повторные эпизоды ЖТ или ФЖ);
- пациентам с ранней постинфарктной стенокардией.
Сужение КА обнаруживают примерно у 85–90% больных НС, из них примерно в 40% случаев на КАГ, зарегистрированных в первые сутки заболевания, можно обнаружить тромбы в КА. Только у 10–15% больных по данным КАГ сужение крупных венечных сосудов является гемодинамически незначимым или артерии остаются интактными, несмотря на наличие у этих пациентов типичных клинических, электрокардиографических и сцинтиграфических признаков локального нарушения перфузии миокарда, характерного для ИБС. В этих последних случаях речь идет, как правило, о динамическом стенозе или о метаболическом синдроме (“синдроме Х”), в основе которого лежат серьезные нарушения микроциркуляторного сосудистого русла, обусловленные повреждением эндотелия мелких венечных сосудов и их склонностью к спазму и образованию микротромбов.
Почти у 2/3 больных НС выявляется гемодинамически значимый стеноз КА (сужение более 75% просвета КА), а еще у 1/4 — полная окклюзия одной из 3-х КА, в том числе у больных, перенесших в прошлом ИМ.
Однососудистое поражение обнаруживают примерно у 30% больных НС, причем чаще у пациентов относительно молодого возраста с впервые возникшей стенокардией. Двухсосудистое поражение коронарного русла встречается у 25–30% и, наконец, трехсосудистое — еще у 15–20% больных. Атеросклеротическое сужение трех крупных ветвей КА (ПМЖВ, ПКА и ОВ) наблюдается, как правило, у больных, длительно страдающих ИБС и перенесших ИМ. Независимо от клинического варианта НС чаще всего поражается ПМЖВ ЛКА.
Главным отличием морфологических изменений коронарного русла у больных стабильной и нестабильной стенокардией является наличие у последних ангиографических признаков “осложненной” атеросклеротической бляшки. Так, у большинства больных НС на коронарных ангиограммах можно выявить эксцентрическое (асимметричное) сужение просвета сосуда с неровной зазубренной кромкой (рис. 6.13). Такую неровность поверхности атеросклеротической бляшки объясняют ее разрывом или изъязвлением с формированием пристеночного тромба, расположенного, как правило, в области этого повреждения. Иногда пристеночный тромб, неполностью закрывающий просвет сосуда, выглядит на коронарограммах как дефект наполнения, который как бы отделен от стенки сосуда.
| Рис. 6.13. Фрагмент коронароангиограммы у больного с осложненной атеросклеротической бляшкой ПМЖВ. Асимметричное сужение артерии с неровными контурами обозначено стрелкой | 
|
В отличие от этого у больного со стабильной стенокардией в месте сужения КА кромка обычно ровная и незазубренная, что отражает наличие “неосложненной” атеросклеротической бляшки, суживающей просвет КА. Значительно реже, чем при НС, выявляется эксцентрический характер сужения венечного сосуда.
Важное прогностическое значение у больных НС имеет ангиографическая оценка коллатерального кровообращения. Известно, что при хорошо развитой сети коллатеральных сосудов даже полная окклюзия одной КА длительное время может не сопровождаться развитием ИМ. Обычно при значительном и распространенном поражении КА и длительном течении ИБС при КАГ выявляется хорошо развитая сеть коллатералей, тогда как у больных с “коротким” ишемическим анамнезом и стенозом одной КА коллатеральное кровообращение выражено хуже. Последнее обстоятельство имеет особое значение в случаях внезапного тромбоза, сопровождающегося, как правило, возникновением трансмурального некроза сердечной мышцы (например, у сравнительно молодых больных ИБС).
В некоторых случаях у больных с типичной клинической картиной ИБС при обычном коронароангиографическом исследовании описанные изменения КА не выявлются вообще. В этих случаях, как правило, речь идет о преобладании функциональных нарушений венечных сосудов или поражении более дистально расположенных микрососудов (преартериол и артериол).
Следует заметить, что больным НС присуща повышенная констрикторная активность в области “осложненной” атеросклеротической бляшки, суживающей просвет венечного сосуда. Поэтому на КАГ нередко можно выявить заметную спастическую реакцию стенозированной КА, причем не только у пациентов с вазоспастической (вариантной) стенокардией Принцметала, но и у большинства больных НС.
 Запомните
1. У большинства больных НС при КАГ обнаруживают гемодинамически значимое сужение (более 75% просвета) 1–3 КА. Наиболее часто выявляется атеросклеротическое сужение ПМЖВ. 2. У больных НС сужение просвета КА нередко имеет неровную зазубренную кромку, что отражает наличие разрывов, изъязвлений на поверхности атероматозной бляшки, а также формирование пристеночного тромба (осложненная атеросклеротическая бляшка). 3. Некоторые коронароангиографические признаки атеросклеротического поражения КА у больных НС имеют особо неблагоприятное прогностическое значение: Запомните
1. У большинства больных НС при КАГ обнаруживают гемодинамически значимое сужение (более 75% просвета) 1–3 КА. Наиболее часто выявляется атеросклеротическое сужение ПМЖВ. 2. У больных НС сужение просвета КА нередко имеет неровную зазубренную кромку, что отражает наличие разрывов, изъязвлений на поверхности атероматозной бляшки, а также формирование пристеночного тромба (осложненная атеросклеротическая бляшка). 3. Некоторые коронароангиографические признаки атеросклеротического поражения КА у больных НС имеют особо неблагоприятное прогностическое значение:
| ||
| 6.3.4. Лечение | ||

| ||
Основной целью лечения больных острым коронарным синдромом без стойкого подъема сегмента RS–T, который в дальнейшем трансформируется в НС, является снижение риска возникновения ИМ и внезапной смерти и уменьшение последствий острой распространенной ишемии миокарда ЛЖ (нарушений ритма и проводимости, прогрессирования СН и др.). Согласно рекомендациям Европейского кардиологического общества (2000 г.) и Российским рекомендациям комитета экспертов ВНОК (2001 г.), с этой целью могут использоваться следующие медикаментозные и немедикаментозные воздействия.
1. Антиишемические (антиангинальные) ЛС:
- β-адреноблокаторы;
- нитраты;
- блокаторы медленных кальциевых каналов.
2. Антитромбиновые препараты:
- гепарины (нефракционированный и низкомолекулярные);]
- прямые ингибиторы тромбина.
3. Антитромбоцитарные агенты:
- аспирин;
- антагонисты рецепторов к аденозиндифосфату (тиенопиридины);
- блокаторы гликопротеиновых IIb/IIIа рецепторов тромбоцитов.
4. Коронарная реваскуляризация:
- транслюминальная коронарная ангиопластика;
- аорто-коронарное шунтирование.
Лечение больных перечисленными способами должно быть начато незамедлительно, как только по клиническим данным и результатам ЭКГ-исследования в покое складывается впечатление о наличии острого коронарного синдрома без стойкого подъема сегмента RS–T (наиболее характерного для НС) и проведена клиническая оценка риска возникновения ИМ и внезапной смерти (см. раздел 6.3.2 и табл. 6.3). При возобновлении приступов болей показан прием нитроглицерина, включая его внутривенное введение, а при необходимости — применение внутривенных инфузий β-адреноблокаторов и наркотических анальгетиков. Методика купирования боли при остром коронарном синдроме подробно описана в разделе 6.4.
Следует подчеркнуть, что при остром коронарном синдроме без стойкого подъема сегмента RS–T, т.е. у подавляющего большинства больных НС, не рекомендуется применение тромболитической терапии, поскольку, увеличивая риск геморрагических осложнений, этот метод лечения не снижает смертность и частоту развития ИМ, а по некоторым данным даже увеличивает их. Совершенно иной подход прослеживается в отношении больных острым коронарным синдромом со стойким подъемом сегмента RS–T или “новой” блокадой ножки пучка Гиса, при котором этот способ лечения является методом выбора (см. раздел 6.4).
β-адреноблокаторы
При отсутствии противопоказаний β-адреноблокаторы рекомендуется назначать всем больным НС. Положительный эффект от применения этих ЛС обусловлен преимущественно их отрицательным инотропным и хронотропным действием. Снижение потребности миокарда в кислороде и урежение сердечных сокращений, вызванное β-адреноблокаторами, обычно сопровождается отчетливым антиишемическим эффектом и примерно на 13% уменьшает риск последующего развития ИМ (подробнее — см. главы 2 и 5).
Поскольку отсутствуют доказательства большей эффективности того или иного β-адреноблокатора в лечении НС, выбор конкретного препарата должен основываться, прежде всего, на учете индивидуальной клинической ситуации: наличии сопутствующих заболеваний (АГ или артериальной гипотонии, сахарного диабета, заболеваний легких и т.д.), имеющихся у больного признаков дисфункции ЛЖ, наличии синусовой тахикардии или брадикардии и т.п. Подробное описание методики применения этих ЛС, а также побочных эффектов и противопоказаний к их назначению приведено в главах 2, 3 и 5. Напомним лишь, что при лечении больных НС следует избегать назначения β-адреноблокаторов при тяжелой острой СН, сопутствующей бронхиальной астме, выраженной артериальной гипотонии, синусовой брадикардии (< 50–55 уд. в мин) и АВ блокадах II, III и I степени (по крайней мере, при Р–Q(R) > 0,24 с). С осторожностью препараты применяются при хронических заболеваниях легких; в этих случаях целесообразно использовать короткодействующие кардиоселективные β 1-адреноблокаторы в уменьшенных дозах.
Больным с высоким риском развития ИМ и внезапной смерти (см. выше) показано внутривенное капельное введение β-адреноблокаторов с последующим переводом их на пероральный прием этих ЛС (см. раздел 6.4).
Следует помнить, что у больных со склонностью к спазму КА β-адреноблокаторы необходимо применять с большой осторожностью, а при вазоспастической стенокардии Принцметала они противопоказаны (подробнее см. главу 5). Исключение составляют β-адреноблокаторы, обладающие дополнительными вазодилатирующими свойствами (карведилол).
Нитраты
Нитраты применяются у больных НС в первую очередь с целью гемодинамической разгрузки ЛЖ и уменьшения или купирования симптомов заболевания (например, сохраняющихся болей в области сердца, одышки и других признаков левожелудочковой недостаточности). В последнем случае нитраты назначают парентерально, постепенно наращивая дозы вплоть до купирования симптомов заболевания или появления побочных эффектов (головные боли, артериальная гипотензия).
Начальная скорость внутривенной инфузии раствора нитроглицерина составляет 10 мкг/мин. Затем она увеличивается на 10 мкг/мин каждые 3–5 мин до появления реакции АД или изменения симптоматики. Если боль в сердце и другие признаки ишемии уменьшаются или исчезают, то скорость наращивания дозы препарата не увеличивается. Если возникает соответствующая реакция АД, а симптоматика острой ишемии миокарда сохраняется, то скорость введения препарата наращивают с большими временными интервалами и под постоянным контролем АД. Особой осторожности требует ситуация, когда систолическое АД становится ниже 110 мм рт. ст. или у больного с артериальной гипертензией — на 25% ниже исходного уровня. Если на протяжении 12 ч боль и другие признаки ишемии миокарда не возникают, следует попытаться уменьшить дозу и начинать переход на применение других лекарственных форм нитратов (прием внутрь, трансбуккально, транскутанеально), учитывая возможность возникновения побочных эффектов и наличие противопоказаний к применению нитратов, подробно описанных в главе 5.
Блокаторы медленных кальциевых каналов
Блокаторы медленных кальциевых каналов (антагонисты кальция) назначаются больным НС преимущественно с симптоматической целью, поскольку, обладая сосудорасширяющим действием (особенно препараты группы нифедипина и дилтиазем) и снижая сократимость миокарда и его потребность в кислороде (верапамил и дилтиазем), они все же не предотвращают развитие острого ИМ и не снижают смертность больных НС. Особенно показаны антагонисты кальция у пациентов с вариантной вазоспастической стенокардией Принцметала, а также при наличии противопоказаний к назначению β-адреноблокаторов (например, при сопутствующей бронхиальной астме).
Верапамил и дилтиазем показаны при наличии у больных признаков гиперактивации САС, синусовой тахикардии и необходимости уменьшить потребность миокарда в кислороде. Препараты группы нифедипина, обладающие наиболее выраженным сосудорасширяющим действием, показаны при сопутствующей АГ и вазоспастической стенокардии Принцметала. При применении антагонистов кальция группы нифедипина следует использовать препараты, обладающие пролонгированным эффектом, поскольку имеются данные о том, что систематическое применение короткодействующих препаратов нифедипина может сопровождаться увеличением смертности больных ИБС.
Методика применения блокаторов медленных кальциевых каналов, их побочные эффекты и противопоказания к назначению подробно изложены в главах 5 и 7.
Антитромботические лекарственные средства
Главной целью лечения больных НС является предотвращение дальнейшего прогрессирования тромбоза венечных сосудов и развития острого ИМ. В настоящее время с этой целью используют несколько групп ЛС, воздействующих на узловые звенья процесса тромбообразования:
1. Антитромбоцитарные препараты:
- аспирин;
- антагонисты рецепторов к аденозиндифосфату (тиенопиридины);
- блокаторы гликопротеиновых IIb/IIIа рецепторов тромбоцитов.
2. Антитромбиновые препараты:
- непрямые ингибиторы тромбина (нефракционированный и низкомолекулярные гепaрины);
- прямые ингибиторы тромбина (гирудин и др.).
Антитромбоцитарные препараты
Аспирин. Всем больным НС рекомендуется назначение аспирина (ацетилсалициловой кислоты), который является “золотым стандартом” антитромбоцитарной терапии. Как и при стабильных формах ИБС, целесообразно назначать малые дозы аспирина (75–325 мг в сутки), поскольку именно в такой дозировке аспирин ингибирует циклооксигеназу тромбоцитов и, препятствуя образованию тромбоксана А2, почти не оказывает действия на метаболизм арахидоновой кислоты в сосудистом эндотелии и не снижает продукции простациклина (подробнее — см. главу 5).
Больным острым коронарным синдромом следует как можно раньше начать прием аспирина. Например, при первом контакте врача скорой помощи с больным или при поступлении в стационар, наряду с мероприятиями по купированию боли, больному рекомендуют разжевать 1 таблетку аспирина, не покрытую оболочкой (250–500 мг). В последующем переходят на прием аспирина внутрь 1 раз в сутки (75–325 мг).
Тиенопиридины. При непереносимости аспирина больным НС могут быть назначены тиклопидин (тиклид) или клопидогрель, эффективно угнетающие адгезию и агрегацию тромбоцитов. Они проявляют свойства антагонистов АДФ-рецепторов тромбоцитов и по некоторым данным угнетают активность