 |
|
Ведение больных после выписки из стационара
После выписки из стационара всем больным, перенесшим эпизоды НС, показано активное воздействие на ФР атеросклероза: курение, ожирение, АГ, гиперлипидемии и т.д. (см. главы 4 и 5). Особое значение придается в настоящее время применению гиполипидемической терапии ингибиторами ГМГ-КоА редуктазы (статинами), которые существенно снижают смертность и частоту осложнений у больных с высоким и средним уровнями ХС ЛНП. Согласно рекомендациям комитета экспертов ВНОК (2001 г.), такую терапию следует начинать еще в стационаре, ориентируясь на уровни липидов в пробах крови, взятых при поступлении.
В обязательном порядке (при отсутствии противопоказаний) должно быть предусмотрено применение:
- β-адреноблокаторов;
- антитромбоцитарных препаратов;
- гиполипидемических средств;
- нитратов.
У больных с клиническими или эхокардиографическими признаками дисфункции ЛЖ показано также длительное применение ингибиторов АПФ.
| 6.3.5. Прогноз |

|
Ближайший прогноз НС оценивается большинством авторов как неблагоприятный: у 10–20% больных НС в течение трех месяцев развивается острый ИМ или новые эпизоды НС, причем летальные исходы составляют 4–10%.
Основными признаками прогностически неблагоприятного варианта течения НС являются:
- сохранение или прогрессирование болевого синдрома и неэффективность антиангинальной терапии;
- приступы стенокардии покоя длительностью более 20 мин;
- косвенные признаки, указывающие на сохранение наклонности к спазму КА (ночные приступы стенокардии Принцметала, положительная проба с эргометрином и др.);
- частые и длительные эпизоды смещения сегмента RS–T при суточном мониторировании ЭКГ, в том числе сохранение эпизодов безболевой ишемии;
- выявление при холтеровском мониторировании ЭКГ преходящих желудочковых аритмий высоких градаций;
- выраженное снижение толерантности больных НС к нагрузкам;
- анамнестические указания на перенесенный в прошлом ИМ или операцию реваскуляризации.
| 6.4. Инфаркт миокарда |

|
Инфаркт миокарда (ИМ) — это ишемический некроз сердечной мышцы, развивающийся в результате острой недостаточности коронарного кровообращения.
ИМ является одной из самых распространенных причин смертности и инвалидизации населения, как в нашей стране, так и за рубежом. В Российской федерации ежегодно ИМ развивается у 0,2–0,6% мужчин в возрасте от 40 до 59 лет (Н.А. Мазур). У мужчин старшей возрастной группы (60–64 г) заболеваемость ИМ еще выше и достигает 1,7% в год. Женщины заболевают ИМ в 2,5–5 раз реже мужчин, особенно в молодом и среднем возрасте, что связывают обычно с более поздним (примерно на 10 лет) развитием у них атеросклероза. После наступления менопаузы (в возрасте старше 55–60 лет) разница в заболеваемости мужчин и женщин существенно уменьшается.
В последние годы отмечается рост заболеваемости ИМ, особенно среди лиц молодого и среднего возраста. Несмотря на повсеместное снижение госпитальной летальности от ИМ, общая смертность от этого заболевания до сих пор остается высокой, достигая 30–50% от общего числа заболевших. Причем большая часть летальных исходов наступает на догоспитальном этапе.
| 6.4.1. Классификация |

|
Современная классификация ИМ предусматривает его деление:
- по величине и глубине поражения сердечной мышцы;
- по характеру течения заболевания;
- по локализации ИМ;
- по стадии заболевания;
- по наличию осложнений ИМ.
1. По величине и глубине поражения сердечной мышцы различают трансмуральный и нетрансмуральный ИМ.
При трансмуральном ИМ (инфаркте миокарда с зубцом Q) очаг некроза захватывает либо всю толщу сердечной мышцы от субэндокардиальных до субэпикардиальных слоев миокарда (рис. 6.18, а), либо большую его часть (рис. 6.18, б), что находит свое отражение на поверхностной ЭКГ в виде формирования патологического зубца Q или комплекса QS в нескольких электрокардиографических отведениях. Отсюда и синоним трансмурального ИМ — “инфаркт миокарда с зубцом Q”. Как правило, такое повреждение сердечной мышцы достаточно обширно и очаг некроза распространяется на 2 и больше сегментов ЛЖ (крупноочаговый ИМ).
| Рис. 6.18. Трансмуральные (с зубцом Q) и нетрансмуральные (без зубца Q) инфаркты миокарда (схема). а, б — трансмуральные ИМ; в —субэндокардиальный (нетрансмуральный) ИМ; г — интрамуральный (нетрансмуральный) ИМ | 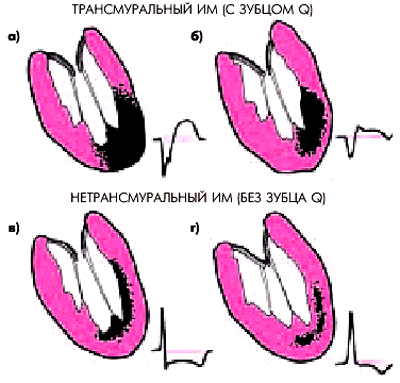
|
При нетрансмуральном ИМ (инфаркте миокарда без зубца Q) очаг некроза захватывает только субэндокардиальные или интрамуральные отделы ЛЖ (рис. 6.18, в, г) и не сопровождается патологическими изменениями комплекса QRS (“инфаркт миокарда без зубца Q”). В течение длительного времени в отечественной литературе для обозначения ИМ без зубца Q использовался термин “мелкоочаговый ИМ”. Действительно, в большинстве случаев ИМ без зубца Q существенно меньше по протяженности, чем трансмуральный инфаркт, хотя нередко встречаются случаи обширного субэндокардиального ИМ, распространяющегося на несколько сегментов ЛЖ, но затрагивающего только субэндокардиальные слои миокарда.
2. По характеру течения заболевания различают первичный, повторный и рецидивирующий ИМ.
Первичный ИМ диагностируется при отсутствии анамнестических и инструментальных признаков перенесенного в прошлом ИМ.
Повторный ИМ диагностируется в тех случаях, когда у больного, у которого имеются документированные сведения о перенесенном в прошлом ИМ, появляются достоверные признаки нового очага некроза, чаще формирующегося в бассейне других КА в сроки, превышающие 28 дней с момента возникновения предыдущего инфаркта.
При рецидивирующем ИМ клинико-лабораторные и инструментальные признаки формирования новых очагов некроза появляются в сроки от 72 ч (3 суток) до 28 дней после развития ИМ, т.е. до окончания основных процессов его рубцевания.
3. По локализации ИМвыделяют:
- переднесептальный (переднеперегородочный);
- передневерхушечный;
- переднебоковой;
- переднебазальный (высокий передний);
- распространенный передний (септальный, верхушечный и боковой);
- заднедиафрагмальный (нижний);
- заднебоковой;
- заднебазальный;
- распространенный задний;
- ИМ правого желудочка.
ИМ чаще локализуется в ЛЖ, поражая его переднюю, заднюю, боковую стенки или/и межжелудочковую перегородку (МЖП), что зависит от местоположения критического стеноза или окклюзии той или иной КА. Нарушение кровообращения по ПМЖВ ЛКА может привести к развитию ИМ переднеперегородочной области, верхушки и гораздо реже — заднедиафрагмальной (нижней) стенки ЛЖ. Прекращение кровотока по ОВ ЛКА сопровождается возникновением переднебазального, бокового или заднебазального ИМ (при окклюзии дистальных отделов ОВ ЛКА). При нарушении кровообращения в бассейне ПКА может развиться заднедиафрагмальный (при поражении проксимальных отделов ПКА) или заднебазальный ИМ (при окклюзии дистальных отделов ПКА). Изолированный инфаркт правого желудочка встречается сравнительно редко. Часто имеется сочетание ИМ различной локализации.
4. По стадии течения заболеванияразличают (рис. 6.19):
- острейший период — до 2 ч от начала ИМ;
- острый период — до 10 дней от начала ИМ;
- подострый период — с 10 дня до конца 4–8 недели;
- постинфарктный период — обычно после 4–8 недели.
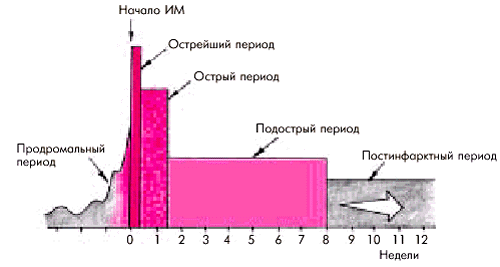
|
| Рис. 6.19. Деление инфаркта миокарда на стадии. Объяснение в тексте |
Иногда выделяют так называемый продромальный период (“предынфарктное состояние”), который в известной степени соответствует понятию нестабильной стенокардии, осложнившейся развитием ИМ. Этот период можно выделить только ретроспективно, после состоявшегося ИМ, поскольку при возникновении клинической картины НС, хотя и возрастает риск развития острого ИМ или внезапной смерти, все же никогда нельзя с уверенностью сказать, завершится ли острый коронарный синдром развитием ИМ или нет.
5. К числу наиболее распространенных осложнений ИМ относятся:
- острая левожелудочковая недостаточность (отек легких);
- кардиогенный шок;
- желудочковые и наджелудочковые нарушения ритма;
- нарушения проводимости (СА-блокады, АВ-блокады, блокады ножек пучка Гиса);
- острая аневризма ЛЖ;
- внешние и внутренние разрывы миокарда, тампонада сердца;
- асептический перикардит (эпистенокардитический);
- тромбоэмболии.
| 6.4.2. Этиология и патогенез |

|
Основной причиной развития ИМ является атеросклероз КА (95%). Следует также иметь в виду, что довольно редко (не более чем у 5% больных) ИМ может развиться в результате эмболии КА (инфекционный эндокардит, внутрижелудочковые тромбы), врожденных дефектов развития венечных сосудов и других поражений КА (коронарииты при системной красной волчанке, ревматизме, ревматоидном артрите) и т.д. Однако в этих случаях ИМ расценивается не как клиническая форма ИБС, а как осложнение одного из перечисленных заболеваний (см. главу 5).
В большинстве случаев прекращение или резкое ограничение коронарного кровотока наступает в результате тромбоза КА, который обычно развивается в области “осложненной” атеросклеротической бляшки, истонченная капсула которой оказывается поврежденной (надрыв, изъязвление, обнажение липидного ядра бляшки). Это способствует активации тромбоцитарных и плазменных факторов свертывания крови тканевым тромбопластином и коллагеном.
Вначале образуется тромбоцитарный “белый” пристеночный тромб. Одновременно в этой области выделяется ряд биологически активных веществ, обладающих мощным вазоконстрикторным действием (эндотелин, серотонин, тромбин, антитромбин А2). В результате возникает выраженный спазм стенозированной КА, еще больше ограничивающий кровоток по венечной артерии. Кроме того, мелкие тромбоцитарные агрегаты могут эмболизировать венечные сосуды на микроциркуляторном уровне, что еще больше ограничивает коронарный кровоток.
Постепенно размеры пристеночного тромба увеличиваются и, если не происходит его спонтанного лизиса в результате естественной активации собственной фибринолитической системы или не проводится тромболитическая терапия, тромб полностью окклюзирует просвет сосуда и развивается трансмуральный ИМ (инфаркт с зубцом Q).
В тех случаях, когда по разным причинам полной окклюзии КА не происходит или возникает спонтанный лизис тромба, может развиться субэндокардиальный или интрамуральный ИМ (инфаркт без зубца Q). Последний может развиться и при полной окклюзии КА, если хорошо выражены коллатерали.
Важно помнить, что в большинстве случаев (около 75%) процесс формирования тотального тромба, полностью перекрывающего просвет крупной КА, может занимать от 2-х дней до 2–3 недель. В этот период клиническая картина прогрессирующего ухудшения коронарного кровотока в целом соответствует симптоматике нестабильной стенокардии (предынфарктный синдром).
Гораздо реже (примерно у 1/4 больных ИМ) процесс формирования тотального, полностью окклюзирующего тромба, протекает молниеносно. В этих случаях в клинической картине заболевания отсутствует симптоматика продромального периода.
Быстрому формированию очага некроза в сердечной мышце могут способствовать еще 3 дополнительных фактора:
- выраженный спазм КА;
- слабое развитие коллатеральных сосудов;
- выраженное увеличение потребности миокарда в кислороде в результате физического или психоэмоционального напряжения, подъема АД и других причин.
Все три фактора ведут к увеличению скорости формирования очага некроза и его объема. Наоборот, в условиях хорошо развитого коллатерального кровообращения даже полная, но постепенная, окклюзия КА в отдельных случаях может не сопровождаться развитием ИМ.
В научной литературе до сих пор обсуждается вопрос о том, возможно ли развитие ИМ за счет длительного и выраженного спазма венечной артерии или нарушения кровообращения на микроциркуляторном уровне. Не исключено, что эти механизмы могут лежать в основе некоторых случаев не-Q-инфаркта, особенно при наличии у больных значительного органического сужения венечного сосуда. Тем не менее этот вопрос требует дальнейшего изучения.
 Запомните
1. Острый инфаркт миокарда в большинстве случаев развивается в результате образования в области “осложненной” атеросклеротической бляшки тромба, полностью или частично ограничивающего коронарный кровоток. Выраженный спазм КА, слабое развитие коллатералей и увеличение потребности миокарда в кислороде на фоне нагрузки являются дополнительными факторами, усугубляющими коронарную недостаточность и ведущими к увеличению объема очага некроза и скорости его формирования. 2. При полной окклюзии КА (органической и динамической), сохраняющейся в течение длительного времени, и слабом развитии коллатералей формируется трансмуральный ИМ (инфаркт с зубцом Q). 3. При наличии пристеночного тромба, частично ограничивающего коронарный кровоток, и/или развитой сети коллатералей развивается нетрансмуральный ИМ (инфаркт без зубца Q). Запомните
1. Острый инфаркт миокарда в большинстве случаев развивается в результате образования в области “осложненной” атеросклеротической бляшки тромба, полностью или частично ограничивающего коронарный кровоток. Выраженный спазм КА, слабое развитие коллатералей и увеличение потребности миокарда в кислороде на фоне нагрузки являются дополнительными факторами, усугубляющими коронарную недостаточность и ведущими к увеличению объема очага некроза и скорости его формирования. 2. При полной окклюзии КА (органической и динамической), сохраняющейся в течение длительного времени, и слабом развитии коллатералей формируется трансмуральный ИМ (инфаркт с зубцом Q). 3. При наличии пристеночного тромба, частично ограничивающего коронарный кровоток, и/или развитой сети коллатералей развивается нетрансмуральный ИМ (инфаркт без зубца Q).
|
Нарушения метаболизма сердечной мышцы
Возникновение ишемии сердечной мышцы приводит к глубоким нарушениям в метаболизме кардиомиоцитов и клеток проводящей системы сердца. В результате прекращения или значительного ограничения коронарного кровотока развивается гипоксия, которая нарушает синтез АТФ в митохондриях. При этом сократительная функция кардиомиоцитов быстро снижается.
Значительное ограничение поступления с коронарным кровотоком жирных кислот и глюкозы, являющихся основным энергетическим субстратом клеток, активизирует анаэробный гликолиз (распад гликогена). Причем гликоген метаболизируется лишь до лактата, который в условиях дефицита кислорода дальше не окисляется (см. рис. 5.49). Концентрация лактата и других недоокисленных продуктов в сердечной мышце и крови коронарного синуса возрастает, и в миокарде происходит сдвиг рН в кислую сторону (ацидоз), который способствует еще большему снижению электрической активности и сократимости миокарда.
Дефицит АТФ приводит к раскрытию калиевых каналов клетки, ионы К+ выходят во внеклеточную среду, снижая тем самым трансмембранный потенциал покоя и возбудимость кардиомиоцитов. Одновременно уменьшается скорость нарастания ТМПД, общая его продолжительность (рис. 6.20), а также скорость проведения электрического импульса. Характерно, что степень этих нарушений в отдельных участках ишемизированного миокарда различна. Поэтому при ишемии создаются условия для возникновения выраженной негомогенности электрофизиологических свойств сердечной мышцы, лежащей в основе многих нарушений сердечного ритма.
В результате ишемии нарушается также обратный транспорт ионов Са2+ в саркоплазматический ретикулум и внеклеточную среду. Kонцентрация Са2+ в клетке возрастает, и развивается так называемая “ишемическая контрактура” кардиомиоцитов, ведущая к нарушению процесса диастолического расслабления
Значительное угнетение функции К+-Nа+–насоса, возникающее в результате дефицита АТФ, сопровождается также повышением концентрации ионов Nа+ в клетке и, соответственно, ее отеком.
 Запомните
Ишемия миокарда приводит к многочисленным расстройствам метаболизма и функции клеток сердца, основными из которых являются: Запомните
Ишемия миокарда приводит к многочисленным расстройствам метаболизма и функции клеток сердца, основными из которых являются:
|
| Рис. 6.20. Изменение трансмембранного потенциала действия (ТМПД) в зоне ишемического повреждения. Обьяснения в тексте. | 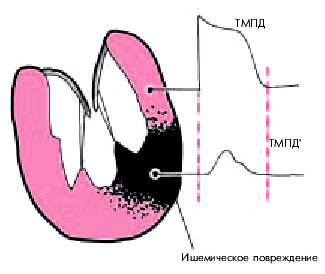
|
Морфологические данные
Самые ранние морфологические изменения в сердечной мышце при развивающемся ИМ можно выявить только при использовании электронной микроскопии. Уже через 15–20 мин после коронарной окклюзии обнаруживают набухание митохондрий и истощение гликогена. Через 60 мин после прекращения коронарного кровообращения выявляется необратимое ишемическое повреждение клетки в виде распада хроматина ядер и выраженной контрактуры саркомеров.
При использовании световой микроскопии первые изменения в очаге ИМ обнаруживаются только через 12–18 ч от начала инфаркта. Наблюдается расширение капилляров, отек мышечных волокон. Через 24 ч выявляется фрагментация мышечных волокон и инфильтрация полиморфно-ядерными лейкоцитами.
Макроскопически картина ИМ начинает выявляться только через 18–24 ч от начала заболевания. Очаг некроза выглядит бледным и отечным, а через 48 ч зона некроза приобретает серый оттенок и становится дряблой.
При неосложненном течении процесс формирования рубца завершается примерно через 6 недель от начала ИМ.
Последствия инфаркта миокарда
В результате возникновения ИМ происходит нарушение диастолической и систолической функций ЛЖ, а также начинается сложный процесс его ремоделирования. Одновременно наблюдаются значительные изменения функционального состояния других органов и систем.
Диастолическая дисфункция ЛЖ является одним из первых проявлений ишемии и развивающегося ИМ. Диастолическая дисфункция обусловлена повышением ригидности (снижением податливости) сердечной мышцы во время диастолы.
Начальные стадии диастолической дисфункции характеризуются снижением скорости диастолического расслабления и объема раннего диастолического наполнения (в фазу быстрого наполнения желудочка). При этом увеличивается объем кровотока во время систолы левого предсердия. Значительная часть диастолического наполнения ЛЖ осуществляется только в конце диастолы, во время систолы ЛП.
Дальнейшее ухудшение диастолической функции ЛЖ приводит к росту КДД в ЛЖ, давления наполнения и среднего давления в ЛП и венах малого круга кровообращения, что существенно повышает риск возникновения застоя крови в легких.
Систолическая дисфункция ЛЖ проявляет себя 1) в нарушении региональной сократимости ЛЖ и 2) в появлении признаков глобальной систолической дисфункции ЛЖ.
Нарушения локальной сократимости ЛЖ при ИМ развиваются очень рано. Вначале они напоминают таковые, обнаруживаемые у больных стабильной стенокардией во время проведения нагрузочных тестов или у пациентов НС после ангинозного приступа (см. выше). Однако уже через сутки от начала ИМ гипокинезия некротизирующегося участка сердечной мышцы, отражающая функцию гибернирующего (“спящего” в условиях выраженной ишемии) миокарда, сменяется ее акинезией — отсутствием во время систолы сокращения некротизированного участка сердечной мышцы. Наиболее серьезным нарушением локальной сократимости является дискинезия — парадоксальное выбухание участка некроза в момент систолы.
Наконец, в области неповрежденной сердечной мышцы нередко наблюдается локальная гиперкинезия — некоторое увеличение сократимости интактных участков ЛЖ, которая носит компенсаторный характер.
Снижение глобальной систолической функции ЛЖ при ИМ заключается
- в уменьшении ФВ, УО, СИ, МО, АД;
- в повышении КДД и КДО ЛЖ;
- в появлении клинических признаков левожелудочковой недостаточности и застоя крови в малом круге кровообращения;
- в появлении признаков системных расстройств периферического кровообращения, в том числе на микроциркуляторном уровне.
Насосная функция ЛЖ при ИМ определяется многими факторами, в первую очередь, распространенностью очага некроза.
 Запомните
Между выраженностью снижения глобальной систолической функции ЛЖ и величиной очага некроза существует прямая зависимость (С. Rаskley): 1. При величине некроза, превышающей 10% массы миокарда ЛЖ, наблюдается снижение ФВ. 2. При вовлечении в некротический процесс более 15% массы ЛЖ к этим изменениям присоединяется повышение КДД и КДО ЛЖ. 3. Если область некроза превышает 40% от общей массы миокарда ЛЖ, развивается кардиогенный шок (см. ниже). Запомните
Между выраженностью снижения глобальной систолической функции ЛЖ и величиной очага некроза существует прямая зависимость (С. Rаskley): 1. При величине некроза, превышающей 10% массы миокарда ЛЖ, наблюдается снижение ФВ. 2. При вовлечении в некротический процесс более 15% массы ЛЖ к этим изменениям присоединяется повышение КДД и КДО ЛЖ. 3. Если область некроза превышает 40% от общей массы миокарда ЛЖ, развивается кардиогенный шок (см. ниже).
|
Понятно, что в каждом конкретном случае заболевания такая зависимость может существенно нарушаться, поскольку еще большее ухудшение гемодинамики может быть связано с наличием острой аневризмы ЛЖ, появлением митральной регургитации при инфаркте сосочковых мышц или перфорацией МЖП, выраженной гипертрофии миокарда, наличием диастолической дисфункции сердечной мышцы, уровнем АД, а также состоянием соседних с инфарктом участков миокарда, не вовлеченных в процесс инфарцирования (величиной их кровоснабжения, наличием в этой зоне рубцов после перенесенного в прошлом ИМ) и т.п.
Ремоделирование ЛЖ при ИМ — это совокупность изменений структуры и функции ЛЖ, обусловленных формированием в сердечной мышце ИМ. Наиболее существенные изменения происходят при трансмуральном ИМ. Формирующийся в стенке ЛЖ обширный очаг некроза испытывает на себе высокое внутрижелудочковое давление, создаваемое интактным миокардом желудочка во время систолы (рис. 6.21, а). Поскольку этот участок некроза не участвует в сокращении и не оказывает сопротивления внутрижелудочковому давлению, он довольно быстро начинает растягиваться и истончаться. В результате площадь инфаркта, а также общие размеры ЛЖ, увеличиваются (рис. 6.21, б).
Поскольку часть сердечной мышцы выпадает из сокращения, а полость ЛЖ становится расширенной, неповрежденные участки миокарда испытывают избыточную нагрузку, что приводит вначале к их гиперфункции, а затем и гипертрофии. Одновременно еще больше увеличивается КДО ЛЖ, что поначалу, согласно механизму Старлинга, позволяет поддерживать сердечный выброс на должном уровне.
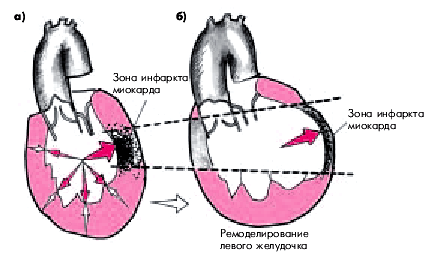
|
| Рис. 8.21. Ремоделирование левого желудочка при трансмуральном инфаркте миокарда. а - влияние ситолического внутрижелудочного давления на некротизированный участок сердечной мышцы (2-е сутки ИМ); б - увеличение площади инфаркта, истончение стенки в области некроза и дилатация ЛЖ |
 Запомните
Ремоделирование ЛЖ при остром ИМ заключается в формировании следующих структурных изменений: Запомните
Ремоделирование ЛЖ при остром ИМ заключается в формировании следующих структурных изменений:
|
Ремоделирование ЛЖ больше выражено у больных с обширным передним трансмуральным ИМ. В этих случаях ремоделирование начинается уже через 24 ч от начала инфаркта и продолжается в течение длительного времени (недели и месяцы). В конечном счете ремоделирование усугубляет нарушения систолической и диастолической функций желудочка и способствует возникновению левожелудочковой СН.
На выраженность процесса ремоделирования влияют несколько факторов.
1. Размеры ИМ (чем больше площадь инфаркта, тем более выраженными оказываются структурные изменения в ЛЖ).
2. Размер периинфарктной зоны (области ишемизированного или гибернирующего миокарда, непосредственно граничащей с зоной некроза).
3. Механические свойства зоны некроза (в последующем — рубцовой зоны).
4. Величина постнагрузки, в том числе уровень АД, ОПСС, размеры полости ЛЖ и др.
5. Величина преднагрузки (объем венозного возврата крови к сердцу).
6. Гиперактивация САС.
7. Гиперактивация РААС, в том числе тканевых РАС.
8. Гиперпродукция эндотелина и других вазоконстрикторных субстанций.
Последние три фактора имеют особое значение для формирования компенсаторной гипертрофии интактного миокарда, развития кардиофиброза и дилатации ЛЖ (подробнее см. главу 2). Поэтому ограничение активности САС, РААС и тканевых РАС с помощью b-адреноблокаторов, ингибиторов АПФ и некоторых других ЛС способно снизить выраженность процесса ремоделирования.
В целом ремоделирование ЛЖ у больных трансмуральным ИМ, несмотря на компенсаторное значение некоторых его элементов (гипертрофии интактного миокарда, включения в процесс компенсации механизма Старлинга и др.), приводит к повышению смертности больных, быстрому прогрессированию сердечной недостаточности, частому формированию аневризмы ЛЖ и повышению риска разрыва миокарда
Изменения других органов и систем.Функциональные и морфологические изменения других органов и систем, закономерно наблюдающиеся при ИМ, определяются несколькими основными факторами:
- гипоксией органов, связанной с их гипоперфузией, обусловленной нарушениями насосной функции сердца (снижение сердечного выброса, ОЦК, системного АД и др.);
- повышением давления в малом и венозном русле большого круга кровообращения, обусловленным левожелудочковой или правожелудочковой недостаточностью;
- активацией симпатико-адреналовой системы, РААС и тканевых РАС;
- активацией системы свертывания крови и агрегации тромбоцитов;
- системными нарушениями микроциркуляции.
Ухудшение кровообращения в поджелудочной железе, а также активация САС с повышением концентрации катехоламинов, сопровождается усилением гликогенолиза и снижением выработки инсулина. В результате развиваются нарушения углеводного обмена.
Повышение давления в легочных венах и легочных капиллярах, обусловленное систолической и диастолической дисфункцией ЛЖ, ведет к увеличению объема внесосудистой жидкости, нарушениям легочной вентиляции и газообмена и развитию интерстициального отека легких.
Снижение перфузии головного мозга, особенно при наличии сопутствующего церебрального атеросклероза, сопровождается рядом неврологических проявлений, вплоть до развития ишемического инсульта.
Нарушения перфузии почек при ИМ нередко сопровождаются протеинурией, микрогематурией, цилиндрурией. При кардиогенном шоке развивается острая почечная недостаточность.
Повышенная активность системы свертывания крови, характерная для больных ИМ, сопровождается выраженными гематологическими сдвигами (увеличением содержания в крови фибриногена, фибринопептида А, повышением агрегационной способности тромбоцитов и вязкости крови), которые имеют значение не только для формирования тромбоза КА, но и для образования тромбоцитарных агрегатов в микроциркуляторном сосудистом русле.
Чрезмерная активация САС, возникающая при ИМ, способствует усилению периферической вазоконстрикции и развитию тяжелых нарушений сердечного ритма.
| 6.4.3. Клиническая картина «неосложненного» инфаркта миокарда с зубцом Q |

|
В течении трансмурального ИМ (инфаркта с зубцом Q) принято выделять 5 периодов (см. рис. 6.19): 1) продромальный; 2) острейший; 3) острый; 4) подострый и 5) постинфарктный периоды. Клиническая картина каждого из них складывается из:
- типичных клинических проявлений неосложненного течения ИМ;
- клинической симптоматики многочисленных осложнений.
В то же время следует иметь в виду, что “неосложненный” ИМ — весьма условное понятие, поскольку в большинстве случаев трудно представить себе трансмуральное поражение ЛЖ, которое не сопровождалось хотя бы минимальными признаками левожелудочковой недостаточности, нарушениями ритма сердца или рефлекторным коллапсом.
Продромальный период (предынфарктное состояние)
В предыдущих разделах было показано, что у большинства больных ИМ с зубцом Q (70–80%) процесс формирования тотальной тромботической окклюзии может занимать от 2-х до 18 дней. В это время коронарное кровообращение характеризуется крайней нестабильностью, что находит свое отражение в клинической картине заболевания, напоминающей, как правило, один из вариантов нестабильной стенокардии:
- впервые возникшую стенокардию (нестабильного и быстро прогрессирующего течения);
- прогрессирующую стенокардию напряжения;
- спонтанные ангинозные приступы стенокардии покоя (в том числе вариантной стенокардии Принцметала).
В то же время было бы неверным полностью отождествлять симптоматику этого периода инфаркта с клинической картиной нестабильной стенокардии, поскольку только у 15–20% таких больных в дальнейшем развивается ИМ. Из всех проявлений НС особую настороженность должны вызывать следующие признаки.
1. Небольшое время (несколько часов или сутки), прошедшее с момента начала дестабилизации коронарного кровообращения. Именно в этих случаях риск возникновения ИМ и/или внезапной сердечной смерти очень велик. Наоборот, если нестабильная стенокардия продолжается уже 2–3 недели, менее вероятно, что эта клиническая картина относится к проявлениям предынфарктного состояния.
2. Чрезвычайно быстро прогрессирующая стенокардия напряжения, сопровождающаяся резким снижением толерантности к физической нагрузке.
3. Тяжелые повторные ангинозные приступы стенокардии покоя продолжительностью более 20–30 мин, сопровождающиеся одышкой, слабостью, потливостью, снижением АД и т.п.
4. Результаты холтеровского мониторирования ЭКГ: увеличение частоты и общей длительности эпизодов преходящей болевой и безболевой депрессии сегмента RS–Т, а также появление этих изменений при обычной для данного больного физической нагрузке и в покое.
5. Отрицательная динамика ЭКГ, зарегистрированной в покое, в виде депрессии сегмента RS–Т и/или инверсии зубца Т.
В то же время следует иметь в виду, что даже с учетом этих признаков диагноз предынфарктного состояния всегда носит вероятностный характер и окончательно может быть установлен только ретроспективно.
 Запомните
1. Продромальный период (предынфарктное состояние) наблюдается у 70–80% больных трансмуральным ИМ (инфарктом с зубцом Q). 2. Клиническая картина предынфарктного состояния в целом напоминает симптоматику нестабильной стенокардии и характеризуется очень быстрым прогрессированием стенокардии напряжения, появлением повторных тяжелых и длительных приступов стенокардии покоя, отрицательной динамикой ЭКГ, а также учащением и увеличением продолжительности признаков болевой и безболевой ишемии миокарда по данным холтеровского мониторирования ЭКГ. 3. Диагноз предынфарктного состояния всегда носит лишь вероятностный характер и окончательно устанавливается только ретроспективно. Запомните
1. Продромальный период (предынфарктное состояние) наблюдается у 70–80% больных трансмуральным ИМ (инфарктом с зубцом Q). 2. Клиническая картина предынфарктного состояния в целом напоминает симптоматику нестабильной стенокардии и характеризуется очень быстрым прогрессированием стенокардии напряжения, появлением повторных тяжелых и длительных приступов стенокардии покоя, отрицательной динамикой ЭКГ, а также учащением и увеличением продолжительности признаков болевой и безболевой ишемии миокарда по данным холтеровского мониторирования ЭКГ. 3. Диагноз предынфарктного состояния всегда носит лишь вероятностный характер и окончательно устанавливается только ретроспективно.
|
Острейший период
Острейший период трансмурального ИМ — это время от появления первых клинических и/или инструментальных (электрокардиографических) признаков острой ишемии миокарда до начала формирования очага некроза (около 2–3 ч). На протяжении этого периода морфологические изменения в сердечной мышце еще обратимы, и при своевременном применении тромболитических средств сохраняется возможность восстановления коронарного кровотока и предупреждения образования некроза миокарда.
Первые клинические проявления ИМ связаны с завершением процесса полной тромботической окклюзии КА или с внезапным ее развитием (при отсутствии у больного признаков продромального периода). Различают несколько клинических вариантов начала ИМ:
- болевой (ангинозный) вариант начала (status anginosus);
- астматический вариант (status asthmaticus);
- абдоминальный вариант (status abdominalis);
- аритмический вариант;
- цереброваскулярный вариант;
- малосимптомное (бессимптомное) начало ИМ.
Первое систематическое описание ангинозного, астматического и абдоминального (гастралгического) вариантов ИМ было сделано в 1909 г. В.П.Образцовым и Н.Д.Стражеско. Астматический, абдоминальный, аритмический и цереброваскулярный варианты являются по существу осложненной формой ИМ и подробно рассматриваются в разделе: “Осложнения ИМ”. Ниже приведена клиническая картина наиболее распространенного варианта начала ИМ — ангинозного, который наблюдается в 80–95% всех случаев ИМ.
Жалобы
Приступ интенсивных болей в сердце является наиболее характерным клиническим признаком начала ИМ. Боль локализуется за грудиной, нередко распространяясь на всю прекардиальную область слева и справа от грудины и даже на область эпигастрия. В большинстве случаев боль иррадиирует в левую руку, левое плечо, лопатку, шею, реже — в межлопаточное пространство, нижнюю челюсть, в обе руки и т.п.
Интенсивность и характер боли обычно отличаются от приступа стенокардии: больные ИМ характеризуют ее как необычно сильную, мучительную, “жестокую” боль сжимающего, давящего, распирающего или жгучего характера, нередко сопровождающуюся страхом смерти. Боль возникает внезапно, быстро достигая максимальной интенсивности. Она не купируется при сублингвальном приеме нитроглицерина или изосорбида динитрата. Часто боль купируется только после применения наркотических анальгетиков (“предельная” или “морфинная” боль). Продолжительность боли в типичных случаях достигает 40–60 мин, иногда сохраняясь часы и сутки, оправдывая свое название — status anginosus.
Иногда возможно как бы “волнообразное изменение интенсивности болей: после 20–30 мин предельных по силе, “морфинных”, болей наступает кратковременное (на 10–15 мин) ослабление боли, после чего она возобновляется с новой силой.
Следует помнить, что боль при ИМ иногда может пройти самостоятельно, даже если больному не была оказана соответствующая медицинская помощь.
 Запомните
Боль в сердце в типичных случаях ИМ отличается от обычного приступа стенокардии: Запомните
Боль в сердце в типичных случаях ИМ отличается от обычного приступа стенокардии:
|
Гораздо реже болевой синдром при ИМ может быть не столь интенсивным и продолжительным. В этих случаях боли могут быть вполне “терпимыми”, их продолжительность не превышает 15–20–30 мин, иногда боли могут купироваться после приема нескольких таблеток нитроглицерина.
Острая сосудистая недостаточность. У большинства больных трансмуральным ИМ возникновение интенсивного болевого приступа сопровождается признаками болевого шока. Больные жалуются на внезапно появившуюся резкую слабость, головокружение, выраженную потливость, сердцебиения (тахикардию), похолодание конечностей. Появляется апатия и адинамия, а в некоторых случаях даже кратковременное затемнение сознания. Отмечается снижение АД.
Описанные клинические признаки указывают на возникновение острой сосудистой недостаточности, развивающейся, как правило, на высоте болевого синдрома. В результате рефлекторного расширения вен органов брюшной полости и скелетных мышц происходит депонирование крови в этих сосудистых областях, уменьшение притока крови к сердцу, развивается гиповолемия, снижение АД и гипоперфузия головного мозга.
Эта клиническая картина острой сосудистой недостаточности очень напоминает начальные клинические проявления истинного кардиогенного шока, обусловленные резким падением сердечного выброса. Однако в отличие от него, признаки рефлекторного болевого шока кратковременны, быстро, в течение нескольких минут, проходят самостоятельно или при применении лекарственных средств, повышающих сосудистый тонус.
Одышка. Субъективные проявления острой левожелудочковой недостаточности наблюдаются более чем у половины больных трансмуральным ИМ, в том числе у пациентов с болевым (ангинозным) вариантом инфаркта. На фоне продолжающегося болевого приступа или после его купирования появляется ощущение нехватки воздуха, дыхательный дискомфорт, одышка, которые усиливаются в горизонтальном положении больного с низким изголовьем. Эти признаки связаны с быстро развивающейся на фоне выраженной ишемии миокарда диастолической и систолической дисфункцией ЛЖ, повышением КДД в желудочке, среднего давления в ЛП и венах малого круга кровообращения и венозным застоем в легких.
Следует подчеркнуть, что развитие более тяжелых проявлений острой левожелудочковой недостаточности (сердечной астмы или альвеолярного отека легких) в острейшем периоде болевого ИМ не характерны. Исключение составляет астматический вариант начала ИМ, который расценивается как осложненное течение ИМ и рассматривается нами в разделе “Осложнения ИМ”.
Аритмии. У большинства больных трансмуральным ИМ (до 90%) при мониторном наблюдении можно выявить разнообразные нарушения ритма и проводимости, в том числе возникающие в самый ранний период заболевания. Большинство из них сопровождаются жалобами больных на сердцебиения и перебои в работе сердца. Подробное описание отдельных видов аритмий приведено ниже (см. раздел: “Осложнения ИМ”).
 Запомните
Анализируя жалобы больного трансмуральным ИМ, следует особое внимание обратить: Запомните
Анализируя жалобы больного трансмуральным ИМ, следует особое внимание обратить:
|
Анамнез
В анамнезе у подавляющего большинства больных острым ИМ имеются указания на клинические проявления ИБС (стенокардия напряжения или покоя), а также на наличие тех или иных факторов риска, отягощающих течение инфаркта (АГ, ГЛП, курение, сахарный диабет, ожирение, отягощенная наследственность и др.).
Подробно следует расспросить больного или родственников о периоде, непосредственно предшествующем развитию ИМ (продромальном периоде), а также о факторах спровоцировавших развитие ИМ (чрезмерная физическая нагрузка, психоэмоциональное напряжение, инфекции и т.п.).
Физикальное исследование
Целью физикального исследования больного ИМ является не столько установление диагноза ИМ, который подтверждается в основном данными лабораторногого и ЭКГ-исследования, сколько оценка функционального состояния сердечно-сосудистой системы и своевременная диагностика тяжелых осложнений инфаркта.
Осмотр. При общем осмотре в первые минуты или 1–1,5 ч, прошедшие от начала заболевания, обращает на себя внимание выраженное возбуждение и двигательное беспокойство больных, испытывающих в это время сильную боль. Они пытаются менять позу, иногда даже ходить по комнате, садиться в кресло, ложиться в постель в поисках положения, облегчающего страдания. Этот признак, характерный для больных ИМ, отличает их от пациентов со стенокардией, которые во время болевого приступа как бы застывают на месте. После купирования болевого синдрома возбуждение больных с развивающимся ИМ, как правило, проходит. Исключение составляют случаи прогрессирующей левожелудочковой недостаточности, сопровождающейся внезапно появившейся и быстро нарастающей одышкой и удушьем.
При осмотре нередко отмечаются бледность кожных покровов, похолодание конечностей и выраженная потливость, указывающие на возможное развитие острой сосудистой недостаточности (кратковременного рефлекторного болевого шока) или на начальные клинические проявления истинного кардиогенного шока (см. ниже). В большинстве случаев определяется цианоз губ.
Выраженный цианоз, положение ортопноэ в сочетании с влажными мелкопузырчатыми хрипами в нижних отделах легких и увеличением частоты дыхательных движений свидетельствуют о наличии острой левожелудочковой недостаточности.
Пальпация и перкуссия сердца. При пальпации сердца может отмечаться локальная болезненность в левой прекардиальной области. При перкуссии сколько-нибудь заметного расширения полости ЛЖ в острейший период заболевания выявить не удается. Исключение составляют больные с предшествующими инфаркту заболеваниями, сопровождающимися дилатацией ЛЖ (АГ, атеросклеротический и постинфарктный кардиосклероз и др.).
Аускультация сердца. В острейшем периоде ИМ у больных можно выявить несколько аускультативных феноменов:
1. Ослабление и приглушенность I тона на верхушке, связанные с уменьшением сократимости ишемизированного миокарда ЛЖ.
2. Ослабление II тона, обусловленное замедлением раннего диастолического расслабления ЛЖ или снижением давления в аорте. При повышении давления в легочной артерии, обусловленном венозным застоем в малом круге кровообращения, определяется акцент II тона на легочной артерии. Наконец, у некоторых больных с ИМ и выраженным атеросклеротическим уплотнением аорты можно выслушать акцент II тона на аорте.
3. Синусовая тахикардия, которая в первые 2–3 ч от начала ИМ свидетельствует, скорее, не о наличии сердечной недостаточности, а о выраженной активации САС, происходящей на фоне болевого стресса.
4. Синусовая брадикардия, иногда выявляемая у больных ИМ, связана, наоборот, с преобладанием активности парасимпатической нервной системы и угнетением автоматизма СА-узла, что особенно часто наблюдается при ИМ заднедиафрагмальной области ЛЖ. Кроме того, в более редких случаях брадикардия может быть обусловлена СА-блокадой или АВ-блокадой II и даже III степени.
Артериальный пульс и АД. Артериальное давление в первые минуты и часы ИМ может возрастать, что нередко связано с повышенной активностью САС, повышенной концентрацией катехоламинов в крови, появляющимися в результате болевого и психоэмоционального стресса. При развитии острой сосудистой недостаточности АД снижается, главным образом, за счет систолического АД. Одновременно наблюдается уменьшение наполнения, напряжения и величины артериального пульса, а также его учащение.
Острый период
Острый период ИМ соответствует времени формирования очага некроза и возникновения так называемого резорбционно-некротического синдрома, связанного с общей реакцией организма на всасывание (резорбцию) некротических масс в кровь. В этот период начинается также сложный процесс ремоделирования ЛЖ, сопровождающийся нарушением функционального состояния сердечно-сосудистой системы. При неосложненном течении ИМ острый период обычно продолжается около 7–10 дней.
Жалобы
Боль в области сердца. При отсутствии осложнений боли в области сердца в этот период обычно не возникают. Сохранение болевого синдрома в течение нескольких дней от начала заболевания может свидетельствовать о дальнейшем распространении тромботического процесса в коронарной системе и расширении зоны ишемического поражения сердечной мышцы или о вовлечении в патологический процесс перикарда.
Лихорадка. На 2–3-й день заболевания повышается температура тела до 37,2–38°С и выше, что является одним из первых клинических признаков резорбционно-некротического синдрома. Лихорадка сохраняется обычно 3–4 дня, редко около 1 недели. Более длительное повышение температуры тела может указывать на развитие осложнений ИМ: пневмонии, тромбоэндокардита, инфаркта легкого и др.
Одышка и некоторые другие признаки левожелудочковой недостаточности нередко наблюдаются в остром периоде трансмурального ИМ, свидетельствуя о дисфункции ЛЖ. Чувство нехватки воздуха, небольшая тахикардия в течение короткого времени могут выявляться даже в тех случаях, которые расцениваются в целом как неосложненное течение инфаркта. В более тяжелых случаях может развиться интерстициальный или альвеолярный отек легких, который расценивают как очень серьезное осложнение ИМ (подробнее — см. раздел: “Осложнения ИМ”).
Аритмии. В остром периоде заболевания сохраняется высокий риск возникновения разнообразных нарушений ритма и проводимости, в том числе пароксизмальной ЖТ и ФЖ. При неосложненном течении ИМ у больных могут сохраняться умеренно выраженная синусовая тахикардия или брадикардия, единичные экстрасистолы.
Физикальное исследование
Осмотр. Неосложненное течение острого периода ИМ, как правило, не сопровождается какими-нибудь специфическими изменениями, выявляемыми при общем осмотре.
При исследовании сердечно-сосудистой системы в этот период можно выявить небольшое снижение систолического АД. Нередко выявляется умеренная синусовая тахикардия, обусловленная СН или связанная с наличием лихорадки.
При перкуссии сердца можно выявить небольшое смещение влево левой границы относительной тупости, что может указывать на начавшееся ремоделирование ЛЖ, его дилатацию и снижение сократимости.
При аускультации сердца I тон ослаблен, иногда значительно, что связано с резким снижением сократительной способности миокарда ЛЖ, его дилатацией или возникновением относительной недостаточности митрального клапана в результате поражения папиллярных мышц. В последнем случае ослабление I тона нередко сочетается с систолическим шумом на верхушке, проводящимся в левую подмышечную область.
Примерно у 1/3 больных ИМ в остром периоде можно выслушать протодиастолический или пресистолический ритмы галопа (см. выше). Протодиастолический ритм галопа, обусловленный появлением патологического III тона сердца, свидетельствует о прогрессирующем падении сократимости ЛЖ и его объемной перегрузке. Диагностическое значение этого аускультативного феномена повышается при наличии других признаков левожелудочковой недостаточности (одышка, цианоз, влажные хрипы в легких и т.п.).
Иногда на верхушке сердца можно выслушать пресистолический ритм галопа, связанный с появлением патологического IV тона сердца, обусловленного повышением конечно-диастолического давления в ЛЖ и выраженной диастолической ригидностью ишемизированного миокарда.
На 2–4 сутки заболевания при аускультации можно выслушать шум трения перикарда, обусловленный вовлечением в патологический процесс листков перикарда (асептический перикардит), что рассматривается как осложнение ИМ (см. ниже).
Наконец, в более редких случаях на верхушке может появляться систолический шум, сочетающийся с ослаблением I тона, обусловленный поражением папиллярных мышц и развитием относительной недостаточности митрального клапана. Максимум шума определяется на верхушке. Шум проводится в левую подмышечную область.
 Запомните
1. Острый период неосложненного ИМ, продолжающийся около 7–10 дней, характеризуется прежде всего появлением клинических признаков резорбционно-некротического синдрома (кратковременная лихорадка, изменения в анализах крови и т.д.). 2. Небольшая одышка, тахикардия, умеренная дилатация ЛЖ, ослабление I и II тонов, иногда акцент II тона на легочной артерии, появление протодиастолического или пресистолического ритмов галопа, небольшое снижение АД связаны преимущественно с дисфункцией ЛЖ и возможны даже при неосложненном течении ИМ. 3. В остром периоде ИМ сохраняется высокий риск развития таких осложнений как нарушения ритма и проводимости, тяжелая левожелудочковая недостаточность (отек легких), асептический перикардит, разрыв и тампонада сердца, тромбоэмболия мелких ветвей легочной артерии, инфаркт легкого и др. Запомните
1. Острый период неосложненного ИМ, продолжающийся около 7–10 дней, характеризуется прежде всего появлением клинических признаков резорбционно-некротического синдрома (кратковременная лихорадка, изменения в анализах крови и т.д.). 2. Небольшая одышка, тахикардия, умеренная дилатация ЛЖ, ослабление I и II тонов, иногда акцент II тона на легочной артерии, появление протодиастолического или пресистолического ритмов галопа, небольшое снижение АД связаны преимущественно с дисфункцией ЛЖ и возможны даже при неосложненном течении ИМ. 3. В остром периоде ИМ сохраняется высокий риск развития таких осложнений как нарушения ритма и проводимости, тяжелая левожелудочковая недостаточность (отек легких), асептический перикардит, разрыв и тампонада сердца, тромбоэмболия мелких ветвей легочной артерии, инфаркт легкого и др.
|
Подострый период
В подостром периоде ИМ постепенно формируется соединительнотканный рубец, замещающий некротические массы. Продолжается также процесс ремоделирования ЛЖ. Продолжительность подострого периода колеблется в широких пределах и зависит, прежде всего, от объема очага некроза, состояния окружающего миокарда, не вовлеченного в некротический процесс, степени развития коллатералей, наличия сопутствующих заболеваний и осложнений ИМ. Обычно продолжительность подострого периода составляет 4–6 недель.
В целом подострый период протекает относительно более спокойно и благоприятно, чем два предыдущих периода. Состояние больных постепенно стабилизируется. При неосложненном течении заболевания боли в сердце и тяжелые жизнеопасные нарушения ритма (пароксизмальная ЖТ и ФЖ) отсутствуют. Уменьшается частота возникновения экстрасистолии, синусовой тахикардии и других аритмий. У больных с признаками АВ-блокад I и II степени, развившимися в остром периоде, нередко восстанавливается атриовентрикулярная проводимость.
Уменьшаются проявления сердечной недостаточности (одышка, тахикардия), если они имели место в остром периоде. В других случаях, при обширном поражении сердечной мышцы, признаки застойной сердечной недостаточности могут прогрессировать, особенно на фоне активизации режима больного. При этом нарастает одышка, тахикардия, появляются отеки на ногах, увеличивается печень, сохраняются влажные хрипы в нижних отделах легких и т.д.
В большинстве случаев в подостром периоде выявляется тенденция к нормализации АД, хотя нередко уровень систолического АД оказывается ниже, чем до развития ИМ. При аускультации обычно сохраняется приглушенность I тона на верхушке, однако протодиастолический и пресистолический ритмы галопа выслушиваются реже. У больных с относительной недостаточностью митрального клапана, обусловленной дисфункцией клапанного аппарата (папиллярных мышц) продолжает выслушиваться систолический шум на верхушке. Шум трения перикарда отсутствует.
Постинфарктный период
В ближайшем постинфарктном периоде в области рубца увеличивается количество коллагена и завершается его уплотнение (консолидация рубца). Одновременно продолжается формирование ряда компенсаторных механизмов, направленных на поддержание гемодинамики на должном уровне (гиперфункция и гипертрофия неповрежденного миокарда, умеренная дилатация ЛЖ, способствующая, согласно механизму Старлинга, некоторому увеличению сердечного выброса и др.).
Клиническая картина постинфарктного периода зависит от влияния многих факторов:
- объема постинфарктного рубца;
- функционального состояния окружающего миокарда;
- формирования компенсаторных механизмов сердечной деятельности;
- скорости дальнейшего прогрессирования коронарного атеросклероза и т.д.
Если первые три фактора, по сути, определяют степень гемодинамических нарушений на протяжении 2–6 мес. после ИМ, то в отдаленном постинфарктном периоде все большее значение приобретает дальнейшее прогрессирование коронарного атеросклероза, ведущего к новым нарушениям коронарного кровообращения (эпизодам нестабильной стенокардии, повторным ИМ, внезапной сердечной смерти и т.п.).
Уже в ближайшем постинфарктном периоде возможно возобновление стенокардии. Относительно редкие приступы стабильной стенокардии напряжения обычно возникают при многососудистом поражении коронарного русла и обусловлены преходящими нарушениями перфузии миокарда в бассейне так называемой “инфаркт-несвязанной КА”. Если же в этот период появляются частые ангинозные приступы, возникающие у больного при малейшей физической нагрузке, психоэмоциональном напряжении или в покое, это расценивают как один из вариантов нестабильной стенокардии (ранняя постинфарктная стенокардия), требующей неотложной терапии.
Вторая группа субъективных симптомов, наблюдающихся у части больных в послеинфарктном периоде, связана с прогрессированием хронической сердечной недостаточности (одышка, тахикардия, отеки ног, нарастающая слабость, утомляемость и др.). Наконец, в постинфарктном периоде сохраняется повышенный риск возникновения различных нарушений ритма и проводимости.
Данные объективного исследования, проведенного в постинфарктном периоде, нередко подтверждают ту или иную степень нарушения гемодинамики (влажные хрипы в легких, отеки, увеличение печени, цианоз, дилатация ЛЖ и др.).
| 6.4.4. Особенности клинической картины инфаркта миокарда без зубца Q |

|
Клиническая картина ИМ без зубца Q (нетрансмурального) в целом соответствует описанным выше клиническим проявлениям острых коронарных синдромов. Поскольку в основе возникновения нетрансмурального ИМ в большинстве случаев лежит развитие в области “осложненной” атеросклеротической бляшки пристеночного тромба и появление в сердечной мышце участка выраженной и сравнительно длительно существующей ишемии, основным клиническим проявлением ИМ без зубца Q является болевой синдром. В большинстве случаев боли носят характер затянувшихся приступов стенокардии покоя (продолжительностью более 20–30 мин), плохо купирующихся нитроглицерином. Как правило, ангинозные приступы не достигают интенсивности, свойственной формирующемуся трансмуральному ИМ с зубцом Q, и больше напоминают стенокардию покоя, характерную для части больных НС. Иногда загрудинная боль может сопровождаться остро наступающей слабостью, потливостью, одышкой, преходящими нарушениями ритма и проводимости и/или внезапными снижением АД.
Реже ИМ без зубца Q манифестирует менее интенсивными, но более частыми приступами стенокардии напряжения, быстрым снижением толерантности к физической нагрузке, т.е. больше напоминает симптоматику прогрессирующей НС. Во всех этих случаях отсутствие стойкого подъема сегмента RS–Т на фоне болевых приступов заставляет проводить дифференциальную диагностику между НС и ИМ без зубца Q.
Физикальное исследование, как правило, дает мало новой информации, подтверждающей диагноз нетрансмурального ИМ, за исключением преходящего значительного ослабления основных тонов сердца и появления дополнительных тонов (III или IV) во время возникновения ангинозного приступа. Иногда можно выявить преходящие нарушения сердечного ритма и различные изменения АД.
Таким образом, анализ клинических данных в большинстве случаев позволяет предположить развитие у больного ИБС острого коронарного синдрома, однако для того, чтобы подтвердить или опровергнуть наличие ИМ без зубца Q, необходимо целенаправленное лабораторное и инструментальное исследование (см. ниже).
| 6.4.5. Лабораторная диагностика инфаркта миокарда |

|
Лабораторное подтверждение острого ИМ основано на выявлении: 1) неспецифических показателей тканевого некроза и воспалительной реакции миокарда; 2) гиперферментемии и 3) увеличении содержания в крови миоглобина и тропонинов.
Неспецифическая реакция организма на возникновение острого ИМ связана, прежде всего, с распадом мышечных волокон, всасыванием продуктов расщепления белков в кровь и местным асептическим воспалением сердечной мышцы, развивающимся преимущественно в периинфарктной зоне. Основными клинико-лабораторными признаками, отражающими эти процессы, являются:
1. Повышение температуры тела (от субфебрильных цифр до 38,5–39°С).
2. Лейкоцитоз, не превышающий обычно 12–15 х 109/л.
3. Анэозинофилия.
4. Небольшой палочкоядерный сдвиг формулы крови влево.
5. Увеличение СОЭ.
 Запомните
1. При остром ИМ повышение температуры тела и лейкоцитоз выявляются обычно к концу первых суток от начала заболевания и при неосложненном течении инфаркта сохраняются примерно в течение недели. 2. СОЭ увеличивается обычно спустя несколько дней от начала заболевания и может оставаться повышенной на протяжении 2–3 недель и дольше даже при отсутствии осложнений ИМ. 3. Длительное сохранение (более 1 недели) лейкоцитоза или/и умеренной лихорадки у больных острым ИМ свидетельствует о возможном развитии осложнений (пневмония, плеврит, перикардит, тромбоэмболия мелких ветвей легочной артерии и др.). Запомните
1. При остром ИМ повышение температуры тела и лейкоцитоз выявляются обычно к концу первых суток от начала заболевания и при неосложненном течении инфаркта сохраняются примерно в течение недели. 2. СОЭ увеличивается обычно спустя несколько дней от начала заболевания и может оставаться повышенной на протяжении 2–3 недель и дольше даже при отсутствии осложнений ИМ. 3. Длительное сохранение (более 1 недели) лейкоцитоза или/и умеренной лихорадки у больных острым ИМ свидетельствует о возможном развитии осложнений (пневмония, плеврит, перикардит, тромбоэмболия мелких ветвей легочной артерии и др.).
|
Следует подчеркнуть, что выраженность всех приведенных лабораторных признаков ИМ прежде всего зависит от обширности очага поражения, поэтому при небольших по протяженности инфарктах эти изменения могут отсутствовать. Необходимо также помнить, что правильная трактовка этих неспецифических показателей возможна только при сопоставлении с клинической картиной заболевания и данными ЭКГ.
Маркеры некроза миокарда
Тропонины. Наиболее чувствительным и специфичным маркером некроза кардиомиоцитов является повышение концентрации тропонинов I и Т, входящих, как известно, в состав тропомиозинового комплекса сократительного миокарда. В норме кардиоспецифические тропонины в крови не определяются или их концентрация не превышает самых минимальных значений, устанавливаемых отдельно для каждой клинической лаборатории. Некроз кардиомиоцитов сопровождается сравнительно быстрым и значительным увеличением концентрации тропонинов I и Т, уровень которых начинает превышать верхнюю границу нормы уже через 2–6 ч после ангинозного приступа и сохраняется высоким в течение 1–2 недель от начала инфаркта (рис. 6.22, а).
Миоглобин. Очень чувствительным, но малоспецифичным маркером некроза является концентрация миоглобина в крови. Его повышение наблюдается через 2–4 ч после ангинозного приступа и сохраняется в течение 24–48 ч после него. Выход миоглобина из сердечной мышцы и повышение его концентрации в крови происходит еще до формирования очага некроза, т.е. на стадии выраженного ишемического повреждения сердечной мышцы. Следует также помнить, что увеличение концентрации миоглобина в крови может быть обусловлено и другими причинами (кроме инфаркта): болезнями и травмами скелетных мышц, большой физической нагрузкой, алкоголизмом, почечной недостаточностью. Изменение содержания миоглобина при остром ИМ представлено в табл. 6.5 и на рис. 6.22, а.
Таблица 6.5
Изменение содержания миоглобина и тропонинов при остром инфаркте миокарда
| Белок | Начало повышения концентрации, ч | Пик увеличения концентрации, ч | Возвращение к норме, сутки |
| Миоглобин | 2–4 | 4–8 | |
| Тропонин I | 2–6 | 24–48 | 7–14 |
| Тропонин Т | 2–6 | 24–48 | 7–14 |

|
| Рис. 6.22. Динамика концентрации тропонинов и миоглобина (а) и активности некоторых ферментов сыворотки крови (б) при остром инфаркте миокарда. Красным цветом обозначены маркеры некроза, рекомендованные Европейским кардиологическим обществом и ВНОК РФ для лабораторной диагностики инфаркта миокарда (тропонины I и Т, МВ КФК,общая КФК). Пунктиром обозначены верхняя граница нормы и уровень, превышение которого следует расценивать как признак некроза сердечной мышцы («ИМ»). М — кривая концентрации миоглобина, Т — тропонинов |
К сожалению, далеко не все клиники в настоящее время имеют возможность лабораторного определения концентрации тропонинов и миоглобина в крови. Поэтому на практике сохраняет свое значение определение других, менее чувствительных и специфичных, маркеров некроза миокарда. Наиболее ценным из них для диагностики острого ИМ является определение активности нескольких ферментов в сыворотке крови:
- креатинфосфокиназы (КФК), особенно ее МВ-фракции (МВ КФК);
- лактатдегидрогеназы (ЛДГ) и ее изофермента 1 (ЛДГ1);
- аспартатаминотрансферазы (АсАТ).
Основной причиной повышения активности ферментов в сыворотке крови у больных острым ИМ является разрушение миокардиальных клеток и выход (вымывание) высвобождающихся клеточных ферментов в кровь. Динамика активности этих ферментов при остром ИМ представлена в табл. 6.6 и на рис. 6,22, б.
Таблица 6.6
Изменение активности некоторых ферментов при остром инфаркте миокарда
(по И.С. Балаховскому; в модификации)
| Фермент | Начало повышения активности, ч | Пик увеличения активности, ч | Возвращение к норме, сутки |
| МВ-фракция КФК | 4–6 | 12–18 | 2–3 |
| КФК | 6–12 | 3–4 | |
| ЛДГ | 8–10 | 48–72 | 8–14 |
| ЛДГ1 | 8–10 | 24–84 | 10–12 |
| АсАТ | 4–12 | 24–36 | 4–7 |
Креатинфосфокиназа (КФК) и ее фракция МВ КФК. Более специфичным лабораторным тестом острого ИМ является определение МВ-фракции КФК (МВ КФК). Ее активность начинает возрастать уже через 4–6 ч, достигает максимума через 12–18 ч и возвращается к исходным цифрам через 48–72 ч от начала ангинозного приступа. Особое значение придается динамике активности фермента: достоверными признаками острого ИМ считают нарастание активности МВ КФК на 25% в двух пробах, взятых с 4-часовым интервалом или постепенное нарастание активности фермента на протяжении 24 ч. Информативным является повышение активности МВ КФК более 10–13 ЕД/л.
Активность общей КФК при ИМ претерпевает сходную динамику: уже к концу первых суток уровень фермента в 3–20 раз превышает норму, а через 3–4 суток от начала заболевания возвращается к исходным значениям (рис. 6.22, б).
Как известно, КФК в большом количестве содержится в скелетных мышцах, миокарде, головном мозге и щитовидной железе. Поэтому увеличение активности этого фермента в сыворотке крови возможно не только при остром ИМ, но и при целом ряде других клинических ситуаций:
1. При внутримышечных инъекциях.