 |
|
Формула Зоммерфельда — Дирака
Движение электрона вокруг атомного ядра в рамках классической механики можно рассматривать как «линейный осциллятор», который характеризуется «адиабатичным инвариантом», представляющим собой площадь эллипса (в обобщенных координатах):

где —  — обобщенный импульс и координаты электрона, W — энергия, ν — частота. А квантовый постулат утверждает, что площадь замкнутой кривой в фазовой pq — плоскости за один период движения, равна целому числу умноженному на постоянную Планка h (Дебай, 1913 г.). С точки зрения рассмотрения постоянной тонкой структуры наиболее интересным является движение релятивистского электрона в поле ядра атома, когда его масса зависит от скорости движения. В этом случае мы имеем два квантовых условия:
— обобщенный импульс и координаты электрона, W — энергия, ν — частота. А квантовый постулат утверждает, что площадь замкнутой кривой в фазовой pq — плоскости за один период движения, равна целому числу умноженному на постоянную Планка h (Дебай, 1913 г.). С точки зрения рассмотрения постоянной тонкой структуры наиболее интересным является движение релятивистского электрона в поле ядра атома, когда его масса зависит от скорости движения. В этом случае мы имеем два квантовых условия:
 ,
,  ,
,
где n определяет главную полуось эллиптической орбиты электрона (a), а k — его фокальный параметр q:
 ,
,  .
.
В этом случае Зоммерфельд получил выражение для энергии в виде
 .
.
где R — постоянная Ридберга, а Z — порядковый номер атома (для водорода Z = 1).
Дополнительный член  отражает более тонкие детали расщепления спектральных термов водородоподобных атомов, а их число определяется квантовым числом k. Таким образом сами спектральные линии представляют собой системы более тонких линий, которые соответствуют переходам между уровнями высшего состояния (n = n1,k = 1,2,...,n1) и низшего состояния (n = n2,k = 1,2,...,n2). Это и есть т. н. тонкая структура спектральных линий. Зоммерфельд разработал теорию тонкой структуры для водородоподобных атомов (H, He + , Li2 + ), а Фаулер с Пашеном на примере спектра однократно ионизированного гелия He + установили полное соответствие теории с экспериментом.
отражает более тонкие детали расщепления спектральных термов водородоподобных атомов, а их число определяется квантовым числом k. Таким образом сами спектральные линии представляют собой системы более тонких линий, которые соответствуют переходам между уровнями высшего состояния (n = n1,k = 1,2,...,n1) и низшего состояния (n = n2,k = 1,2,...,n2). Это и есть т. н. тонкая структура спектральных линий. Зоммерфельд разработал теорию тонкой структуры для водородоподобных атомов (H, He + , Li2 + ), а Фаулер с Пашеном на примере спектра однократно ионизированного гелия He + установили полное соответствие теории с экспериментом.
Зоммерфельд (1916 г.) еще задолго до возникновения квантовой механики Шредингера получил феноменологичную формулу для водородных термов в виде:
 ,
,
где α — постоянная тонкой структуры, Z — порядковый номер атома, E0 = mc2 — энергия покоя, nr — радиальное квантовое число, а nϕ — азимутальное квантове число. Позднее эту формулу получил Дирак используя релятивистское уравнения Шредингера. Поэтому сейчас эта формула и носит имя Зоммерфельда — Дирака.
Появление тонкой структуры термов связана с прецессией электронов вокруг ядра атома. Поэтому появление тонкой структуры можно обнаружить по резонансному эффекту в области ультракоротких электромагнитных волн. В случае Z = 1 (атом водорода) величина расщепления близка к

Поскольку длина электромагнитной волны равна

Поэтому для n = 2 это будет почти 1 см.
20. Атомные спектры. Устройство простейшего спектрометра.
Всякий спектр представляет собой развертку (разложение) излучения на его составляющие. Для получения и измерения спектров используется специальный прибор – спектрометр. На рис. 1.4 изображен полный спектр электромагнитного излучения.
Видимый свет составляет только небольшую часть всего спектра электромагнитного излучения
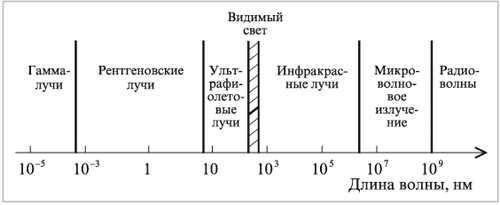
|
| Рис. 1.4.Спектр электромагнитного излучения |
и является примером непрерывного (сплошного) излучения. В непрерывном излучении содержатся все длины волн в пределах некоторого диапазона. Примером непрерывного спектра может служить известное всем природное явление – радуга.
Когда пучок непрерывного излучения, например белый свет, пропускают через газообразный образец какого-либо элемента, в прошедшем через образец пучке недостает излучения с определенными длинами волн (рис. 1.5). Спектр поглощенного этим образцом излучения называется атомным спектром поглощения. Волны излучения, поглощенного атомами образца, обнаруживаются по темным линиям на фоне непрерывного спектра после прохождения излучения через дифракционную решетку.
Рис. 1.5.Устройство спектрометра

|
Если элементы в их газообразном состоянии нагревать до высоких температур или пропускать через них электрический разряд, они испускают излучение с определенными длинами волн. Спектр такого излучения называется атомным спектром испускания, или атомным эмиссионным спектром. Линии в спектре испускания в точности соответствуют линиям в спектре поглощения. На рис. 1.6 приведен атомный эмиссионный спектр водорода.
 Рис. 1.6. Спектр испускания атома водорода (приведены три серии спектральных линий, относящихся к электронным переходам из возбужденных состояний на более низкие уровни энергии) Рис. 1.6. Спектр испускания атома водорода (приведены три серии спектральных линий, относящихся к электронным переходам из возбужденных состояний на более низкие уровни энергии)
|
21. Спектр атомов водорода
При изучении излучения ученым удалось установить общие закономерности в характере спектров и найти ряд эмпирических законов, которым они подчиняются. Было установлено, что спектральные линии всех элементов можно разбить на ряд серий.
В 1885 году Бальмеру удалось найти формулу, описывающую распределение спектральных линий видимого спектра водорода:
 если
если
 серия Лаймана;
серия Лаймана;
 серия Бальмера;
серия Бальмера;
 серия Пашена;
серия Пашена;
 серия Брэккета и т.д.
серия Брэккета и т.д.
