 |
|
Спектр атома водорода
Модель атома Бора
Модель Бора
Представьте, что электроны в атоме движутся по определенным электронным орбитам - по аналогии с движениями планет Солнечной системы. Каждая планета движется по своей орбите, так и электроны вращаются вокруг ядра атома. Каждая такая орбита для электрона получила название "уровень энергии". Энергия электронов в атоме может изменяться только скачкообразно. Т.е. электрон может перескакивать с одной орбиты на другую и обратно (но не может занимать положение между орбитами). Говорят, что энергетические состояния электронов в атоме квантованы.
Энергия электрона зависит от радиуса его орбиты. Минимальная энергия у электрона, который находится на ближайшей к ядру орбите. При поглощении кванта энергии электрон переходит на орбиту с более высокой энергией (возбужденное состояние). И наоборот, при переходе с высокого энергетического уровня на более низкий - электрон отдает (излучает) квант энергии.

Кроме того, Бор указал, что разные энергетические уровни содержат разное количество электронов: первый уровень - до 2 электронов; второй уровень - до 8 электронов…
К сожалению, описать атомы со сложной структурой, опираясь на модель Бора, не представляется возможным. Поэтому, в 20-х годах прошлого века получила широкое распространение квантово-механическая модель (КММ) атома.
23. Спектральные серии
Спектральная серия
СПЕКТРАЛЬНАЯ СЕРИЯ - группа спектральных линий в атомных спектрах, частоты к-рых подчиняются определ. закономерностям. Линии определённой С. с. в спектрах испускания возникают при всех разрешённых квантовых переходах с разл. нач. верх. уровней энергии на один и тот же конечный ниж. уровень (в спектрах поглощения - при обратных переходах). С. с. наиб. чётко проявляются в спектрах атомов и ионов с одним и двумя электронами во внеш. оболочке (в спектрах водорода и водородоподобных атомов, гелия и гелийподобных атомов, атомов щелочных металлов и т. д.).
Спектры атома водорода и ионов с одним электроном состоят из С. с., линии к-рых характеризуют волновые числа: где n0 и - главные квантовые числа нижнего и верхних уровней энергии, между к-рыми происходит соответствующий квантовый переход, Z - спектроскопич. символ (для нейтральных атомов Z= 1),  , т и М - массы электрона и ядра атома соответственно, R - Ридберга постоянная .Для атома водорода RM = 109677,583436 см-1. В зависимости от п0 для водородоподобных систем получаются различные С. с.: при n0 = 1 - серия Лаймана, при n0 = 2 - серия Бальмера, n0= 3 - серия Пашена, n0 = 4 - серия Брэкета, n0 = 5 -серия Пфунда, при n0 = 6 - серия Хамфри. Линии этих серий имеют обозначения: для серии Лаймана (в порядке возрастания v)
, т и М - массы электрона и ядра атома соответственно, R - Ридберга постоянная .Для атома водорода RM = 109677,583436 см-1. В зависимости от п0 для водородоподобных систем получаются различные С. с.: при n0 = 1 - серия Лаймана, при n0 = 2 - серия Бальмера, n0= 3 - серия Пашена, n0 = 4 - серия Брэкета, n0 = 5 -серия Пфунда, при n0 = 6 - серия Хамфри. Линии этих серий имеют обозначения: для серии Лаймана (в порядке возрастания v) 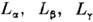 и т. д.; Бальмера -
и т. д.; Бальмера -  и т. д. Расстояния между линиями С. с. с ростом n1 уменьшаются, и С. с. сходится к границе серии (КВ-границе, соответствующей
и т. д. Расстояния между линиями С. с. с ростом n1 уменьшаются, и С. с. сходится к границе серии (КВ-границе, соответствующей  ), за пределами к-рой находится непрерывный спектр. Серии Лаймана и Бальмера обособлены, остальные С. с. частично перекрываются. Границы первых трёх С. с. атома водорода - 912, 3648 и 8208
), за пределами к-рой находится непрерывный спектр. Серии Лаймана и Бальмера обособлены, остальные С. с. частично перекрываются. Границы первых трёх С. с. атома водорода - 912, 3648 и 8208  .
.
Атомы щелочных элементов близки по строению к атому водорода, однако они обладают более сложной энергетич. структурой. Для них выделяют в осн. 4 С. с.: n0s - п1р - главная серия, п0р - п1s - резкая (или первая побочная) серия, п0р - n1d - диффузная (или вторая побочная) серия, (п0+ 1)d - n1f - фундаментальная (или серия Бергмана); здесь n0 - гл. квантовое число осн. состояния, s-, p-, d- и f-состояния соответствуют l = 0, 1, 2, 3 [эти обозначения дали названия С. с.: s (sharp) - резкая,  (principal) - главная, d (diffuse) - диффузная, f (fundamental) - фунда ментальная].
(principal) - главная, d (diffuse) - диффузная, f (fundamental) - фунда ментальная].
В рентг. спектроскопии С. с. обозначают буквами К, L, М и т. д. в соответствии с уровнем (слоем) ниж. состояния (п0 = 1, 2, 3 и т. д.) по мере его удаления от ядра атома (см. Рентгеновские спектры).
24. Водородоподобные атомы. Трудности теории Бора