 |
|
Реакції з простими речовинами
2Е + O2  2ЕO ( Е = Zn, Cd, Hg )
2ЕO ( Е = Zn, Cd, Hg )
Е + S  ЕS ( Е = Zn, Cd ).
ЕS ( Е = Zn, Cd ).
Hg реагує з S за звичайних умов:
Hg + S → HgS
Е + Г2  ЕГ2 ( Е = Zn, Cd; Г = F, Cl, Br, I ).
ЕГ2 ( Е = Zn, Cd; Г = F, Cl, Br, I ).
Hg взаємодіє з галогенами за звичайних умов – спочатку утворюються галогеніди Hg2Г2, а вже потім HgГ2.
З іншими металами Zn, Cd, Hg утворюють сплави. Сплави ртуті називають амальгамами.
Реакції з найважливішими реагентами:
E + H2SO4(розб.)→ ESO4 + H2 ( E = Zn, Cd )
4E + 5H2SO4(конц.) → 4ESO4 + H2S + 4H2O (E = Zn, Cd)
Hg + 2H2SO4(конц.) → HgSO4 + SO2 + 2H2O
E + 2HCl → ECl2 + H2 ( E = Zn, Cd )
3E + 2NH3  E3N2 + 3H2 (E = Zn, Cd )
E3N2 + 3H2 (E = Zn, Cd )
4Zn + 10HNO3(розб.) → 4Zn(NO3)2 + NH4NO3 + 3H2O
3Cd + 8HNO3(розб.) → 3Cd(NO3)2 + 2NO + 4H2O
6Hg + 8HNO3 (розб.)→ 3Hg2(NO3)2 + 2NO + 4H2O
Hg + 4HNO3(конц.) → Hg(NO3)2 + 2NO2 + 2H2O
Zn + 2NaOH + 2H2O  Na2[Zn(OH)4] + H2.
Na2[Zn(OH)4] + H2.
Бінарні сполуки
Сполуки з воднем
Гідриди ЕН2 – тверді, нестійкі речовини. Одержують взаємодією йодидів металів з алюмогідридом літію в середовищі диетилового ефіру:
2ЕI2 + LiAlH4 → 2EH2 + LiI + AlI3.
Галогеніди
Ступеню окиснення +2 відповідають галогеніди ЕГ2. Відомі галогеніди Hg(І) – Hg2Г2 ( Г = F, Cl, Br, I). Тривіальні назви Hg2Cl2 та HgCl2 - каломель та сулема відповідно. ЕГ2, як правило, безбарвні кристалічні речовини. Крім HgBr2, HgI2 та фторидів, всі інші галогеніди ЕГ2 добре розчиняються у воді.
Hg2Г2 – тверді речовини різноманітного забарвлення (Hg2F2 та Hg2I2 – жовті, Hg2Cl2 – білий), мало розчинні у воді, нестійкі, розкладаються, диспропорціонуючи, під дією світла чи нагрівання:
Hg2Г2 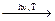 Hg + HgГ2.
Hg + HgГ2.
ЕГ2 одержують прямим синтезом або розчиненням в галогеноводневих кислотах металів, оксидів, гідроксидів, сульфідів, карбонатів:
Zn + 2HCl → ZnCl2 + H2;
HgO + 2HF → HgF2 + H2O;
Zn(OH)2 + 2HF → ZnF2 + 2H2O;
(ZnOH)2CO3 + 4HI → 2ZnI2 + CO2 + 3H2O;
ZnS + 2HCl → ZnCl2 + H2S;
CdCO3 + 2HI → CdI2 + CO2 + H2O.
Hg2Г2 – взаємодією розчинів солей Hg(І) з галогенідами лужних
металів:
Hg2(NO3)2 + 2KI → Hg2I2 + 2KNO3.
У водних розчинах EГ2 гідролізують з утворенням гідроксогалогенідів та оксогалогенідів:
ZnCl2 + H2O  ZnOHCl + HCl;
ZnOHCl + HCl;
2HgCl2 + H2O  Hg2OCl2 + 2HCl.
Hg2OCl2 + 2HCl.
З галогенідами лужних та лужноземельних металів ЕГ2, крім HgF2, утворюють комплекси [EГ4]2- та [EГ6]4-. Найбільш стійкі [HgBr4]2- та [HgI4]2- :
2KI + Hg(NO3)2 → HgI2↓ + 2KNO3
HgI2 + 2KI → K2[HgI4].
При дії розчину NH3 на ZnГ2 та CdГ2 утворюються амінні комплекси
[E(NH3)4]Г2. Продукт взаємодії HgCl2 з NH3 залежить від наявності у розчині NH4Cl :
HgCl2 + 2NH3 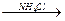 [Hg(NH3)2]Cl2↓;
[Hg(NH3)2]Cl2↓;
плавкий білий преципітат
HgCl2 + 2NH3 → [H2NHg]Cl + NH4Cl.
неплавкий білий преципітат,
амідохлорид ртуті
Галогеніди Hg(І) проявляють властивості окисників:
HgCl2 + SO2 + 2H2O  Hg + H2SO4 + 2HCl;
Hg + H2SO4 + 2HCl;
HgCl2 + H2C2O4 → Hg2Cl2 + 2HCl + 2CO2;
HgCl2 + SnCl2 → Hg2Cl2 + SnCl4.
Галогеніди Hg(І) в залежності від умов можуть окиснюватись, відновлюватись, диспропорціювати:
Hg2Cl2 + Cl2 → 2HgCl;
Hg2Cl2 + SnCl2 → 2Hg + SnCl4;
Hg2Cl2  HgCl2 + Hg.
HgCl2 + Hg.
Оксиди
Ступеню окиснення +2 відповідають оксиди ЕО. Відомий оксид Hg(І) Hg2О. Оксиди ЕО та Hg2О – кристалічні сполуки різного кольору (ZnО - білий, CdО, Hg2О – чорні, HgО – червоний чи оранжевий в залежності від дисперсності), практично нерозчинні у воді; оксиди Hg термічно нестійкі.
ЕО одержуюють прямим синтезом чи прожарюванням гідроксидів, нітратів, карбонатів:
2Е + О2  2ЕО;
2ЕО;
Е(ОН)2  ЕО + Н2О ( Е = Zn, Cd);
ЕО + Н2О ( Е = Zn, Cd);
2E(NO3)2  2ЕO + 4NO2 + O2;
2ЕO + 4NO2 + O2;
CdCO3  CdO + CO2;
CdO + CO2;
(ZnOH)2CO3  2ZnO + CO2 + H2O.
2ZnO + CO2 + H2O.
Оксиди Нg - взаємодією розчинів солей Нg з лугами:
Hg(NO3)2 + 2KOH → 2KNO3 + HgO + 2H2O;
Hg2(NO3)2 + 2KOH → КNO3 + Hg2O + H2O.
Оксиди Нg проявляють основні властивості; ZnО - амфотерний, CdО – переважно основний. При взаємодії ЕО з кислотами утворюються стійкі аквакомплекси [Е(Н2О)4]2+ та [Е(Н2О)6]2+. З лугами ZnO утворює гідроксокомплекси [Zn(ОН)4]2- та [Е(ОН)6]4-:
ZnO + 2HNO3 → Zn(NO3)2 + H2O;
ZnO + 2KOH + H2O → K2[Zn(OH)4];
HgO - окисник; ZnO та CdO взаємодіюють тільки з сильними відновниками:
HgО + Fe → Hg + FeO
ZnO + C  Zn + CO
Zn + CO
CdO + H2  Cd + H2O.
Cd + H2O.
Hg2O нестійкий, диспропорціонує при нагріванні та освітленні:
Hg2O  Hg + HgО;
Hg + HgО;
HgО реагує з NH3, утворюючи малорозчинну сполуку жовтого кольору – основу Міллона:
2HgO + NH3 + H2O → [Hg2N]OH∙2H2O.
Іон [Hg2N]+ можна вважати іоном NH4+, в якому чотири атома Н замінені на два атома Нg.