 |
|
Елементи групи ІІІА
ІІІА групу складають елементи 6В, 13Al, 31Ga, 49In, 89Tl. Будова зовнішніх
| електронних рівнів – ns2np1, | | , де n (номер періоду) = 2, 3, 4, 5, 6 |
| ns np |
(таблиця 5).
Елементи групи ІІІ А
Таблиця 5
| Cимвол елементу | B | Al | Ga | In | Tl |
| Українська назва | Бор | Алюміній | Галій | Індій | Талій |
| Російська назва | Бор | Алюминий | Галлий | Индий | Таллий |
| Латинська назва | Borum | Aluminium | Gallium | Indium | Tallium |
| Рік відкриття | |||||
| Автор відкриття | Ж.Л.Гей-Люссак, Л.Ж.Тернар | Х.К.Ерстед | П.Е.Лекок де Буабодран | Ф.Рейх, Є.Ріхтер | У.Крукс |
| Вміст у земній корі, масова частка, % | 5·10-3 | 8,8 | 1,5·10-3 | 1,4·10-5 | 3·10-4 |
| Основні природні сполуки | Na2B4O7·10H2O; Na2B4O7·4H2O; H3BO3 | Al2O3·nH2O; Na3AlF6 | CuGaS2; як домішки мінералів алюмінію, цинку, заліза | FeIn2S4; CuInS2; як домішки мінералів цинку | TlAsS2; (Tl, Cu, Ag)2Se; як домішки мінералів цинку, заліза, свинцю |
| Агрегатний стан (форма існування) у звичайних умовах | Твердий кристалічний чорний неметал | Сріблястий метал | Сріблясто-білий метал | Сріблясто-білий метал | Сріблясто-білий метал |
| Густина, г/см3, 298 К | 2,34 | 2,70 | 5,90 | 7,31 | 11,85 |
| Температура плавлення, °С | 29,78 | 156,4 | |||
| Вміст в організмі людини, масова частка,% | 10‾5 | 10‾5 |
Продовження таблиці 5
| B | Al | Ga | In | Tl | |
| Місце найбільшого накопичення в організмі людини | Легені, щитоподібна залоза, селезінка, печінка, мозок, нирки, серцевий м’яз | Сироватка крові, легені, печінка, кістки, нирки, мозок | |||
| Біологічна роль | Бере участь у вуглеводо-фосфорному обміні, підсилює дію інсуліну, зменшує дію вітамінів В2 та В12, кишкової амілази та протеїну, гальмує окислення адреналіну | Сприяє розвитку та регенерації епітеліальної, сполучної та кісткової тканини, впливає на активність ферментів та травних залоз | Не з’ясована | Не з’ясована | Проявляє токсичну дію, інгібує ферменти, що мають у своєму складі HS – групу |
| Найважливіші фармацевтичні препарати | Н3ВО3 – як дезинфікуючий засіб; для лікування гіпотрофій; в стоматології. Na2B4O7 – антисептичний засіб | Al2(SO4)3 проявляє в’яжучу, протизапальну, протимікробну та кровоспиняючу дію; Al(OH)3 – як адсорбуючий, обгортаючий засіб; проявляє антацидну дію; в стоматології. KAl(SO4)2·12H2O – як в’яжучий, проти-запальний, кровоспиняючий засіб. Al2O3; K2O·Al2O3·6SiO2; Al2O3·2SiO2·2H2O – в стоматології | В сплавах з золотом, оловом – у стоматології; Ga(NO3)3 – проявляє протипухлинну дію; радіоактивний 72Ga – для лікування та діагностики рака кісток | В сплавах з золотом – у стоматології. Радіоактивний 115In – як індикатор у діагностиці | В сплавах з золотом – у стоматології. Радіоактивний 204Tl – для лікування гострих і хронічних захворювань нервової системи, гнійних отитів, травм периферійної нервової системи |
3.1. Фізичні характеристики елементів
Таблиця 6
| Елемент, Е | B | Al | Ga | In | Tl |
| Радіус атома, нм | 0,088 | 0,126 | 0,127 | 0,144 | 0,148 |
| Радіус іона, нм Е3+ Е+ | 0,027 - | 0,053 - | 0,062 - | 0,080 0,130 | 0,089 0,144 |
| Перший потенціал іонізації, еВ | 8,298 | 5,986 | 5,998 | 5,786 | 6,108 |
| Спорідненість до електрону, еВ | 0,30 | 0,20 | 0,39 | 0,20 | 0,32 |
| Електронегативність | 2,0 | 1,6 | 1,8 | 1,49 | 1,44 |
| Ступінь окислення Е у сполуках (виділені найбільш характерні) | +3 -3 | +3 | +1, +2 +3 | +1, +2 +3 | +1, +3 |
3.2. Прості речовини. Бор одержують з природної сировини за схемою:
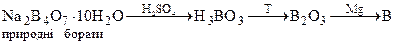
Інші елементи одержують електролізом солей.
За хімічними властивостями бор – типовий неметал, Al, Ga, In і Tl – метали. За звичайних умов бор інертний, але при високих температурах він активно реагує з киснем, сіркою, азотом, вуглецем. У кислотах, що не є окисниками, бор не розчиняється.
Алюміній – більш-менш активний метал, однак, міцна оксидна плівка захищає його від окислення киснем повітря. З галогенами він реагує за звичайних умов. З сіркою, азотом і вуглецем – при високих температурах. Взаємодіє з кислотами та лугами.
Ga, In і Tl за хімічними властивостями близькі до алюмінію, незважаючи на те, що луги на талій не діють.
Реакції з простими речовинами:
2E + 3Г2 ® 2ЕГ3 (Е = B, Al, Ga, In, Tl);
2Е + Г2 ® 2ЕГ (Е = Ga, In, Tl);
4Е + 3О2 ® 2Е2О3 (Е = B, Al, Ga, In, Tl), а Tl утворює ще і Tl2O;
2Е + 3S ® Е2S3 (Е = B, Al, Ga, In, Tl), а Tl утворює ще і Tl2S;
2Е + N2 ® 2EN (Е = B, Al);
E + P ® EP (Е = B, Al, Ga, In), а Tl утворює Tl3P9, TlP3, TlP5;
4Е + 3C ® E4C3 (Е = B, Al), а B утворює ще і B4C, B14C2.
З металами бор утворює бориди, наприклад MgB2, CrB, HfB2, TaB2 тощо, а Al, Ga, In, Tl – сплави.
Реакції з найважливішими реагентами :
2Tl + 2H2O ® 2TlOH + H2;
2E + 6HCl ® 2ECl3 + 3H2 (E = Al, Ga, In);
2Tl + 2HCl ® 2TlCl + H2;
2E + 6H2SO4конц ® E2(SO4)3 + 3SO2 + 6H2O (E = Ga, In);
2Tl + 2H2SO4конц ® Tl2SO4 + SO2 + 2H2O;
2B + 3H2SO4конц ® 2H3BO3 + 3SO2;
2E + 3H2SO4розв ® E2(SO4)3 + 3H2 (E = Al, Ga, In);
2Tl + H2SO4розв ® Tl2SO4 + H2;
E + 6HNO3конц ® E(NO3)3 + 3NO2 + 3H2O (E = Ga, In);
Tl + 2HNO3конц ® TlNO3 + NO2 + H2O;
B + 3HNO3конц ® H3BO3 + 3NO2;
E + 4HNO3розв ® E(NO3)3 + NO + 2H2O (E = Al, Ga, In);
3Tl + 4HNO3розв ® 3TlNO3 + NO + 2H2O;
2E + 6NaOH +3H2O ® 2Na3[E(OH)6] + 3H2 (E = Al, Ga, In);
2Bаморфний + 2NaOH +2H2O ® 2NaBO2 + 3H2;
3.3. Бінарні сполуки
3.3.1. Сполуки з воднем. Найбільш поширеними водневими сполуками елементів ІІІА групи є водневі сполуки бору, або борани, складу B2H6 (найбільш стійкі), B4H10, B5H9, B6H10 тощо. Борани утворюються при дії кислоти на борид магнію. Вони дуже реакційно здатні.
З киснем реагують з вибухом:
B2H6 + 3O2 ® 3H2O + B2O3.
Розкладаються водою:
B2H6 + 6H2O ® 2H3BO3 + 6H2.
В молекулах боранів існує трицентровий електронно-дефіцитний зв’язок між атомами бору, утворений за допомогою водневих містків:
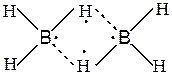
Молекула B2H6 являє собою два тетраедра, що з’єднані вздовж ребра.
Відомий гідрид алюмінію, який має полімерну будову –(AlH3)n.
3.3.2. Галогеніди. Всі елементи ІІІА групи утворюють з усіма галогенами – ЕГ3. Для талію ще відомі галогеніди складу ТlГ.
Галогеніди бору – типові галогенангідриди (BF3 та BCl3 – гази, BBr3 – рідина, ВІ3 – тверда речовина), розкладаються водою :
BГ3 + 3H2O ® H3BO3 + 3HГ (Г = Cl, Br, I);
Гідроліз BF3 відбувається за рівнянням:
4BF3 + 3H2O ® H3BO3 + 3H[BF4];
BF3 взаємодіє з фторидами з утворенням комплексного іону:
BF3 + F‾ ® [BF4]‾.
Галогеніди інших елементів – солі, добре розчинні у воді (крім фторидів), сильно гідролізують :
EГ3 + 2H2O D E(OH)2Г + 2HГ.
Галогеніди утворюють комплексні сполуки, наприклад, K3[InBr6], K[AlCl4].
Галогеніди талію TlГ3 – окисники; а TlГ – типові солі, у водних розчинах не гідролізують. TlF, на відміну від TlF3 добре розчиняється у воді.
3.3.3. Оксиди. Елементи ІІІ А групи утворюють оксиди Е2О3, а талій – ще і Tl2O. Всі оксиди є твердими речовинами.
В2О3 – кислотний оксид, розчиняється у воді з утворенням ортоборної кислоти:
В2О3+3Н2О®2Н3ВО3.
Інші оксиди Е2О3 у воді не розчиняються.
Al2O3, Ga2O3 та In2O3 – амфотерні: взаємодіють з лугами:
Е2О3+6NaOH+3H2O®2Na3[E(OH)6]
та з кислотами:
Е2О3+6HNO3®2E(NO3)3+3H2O.
Tl2O3, Tl2O – основні оксиди. Tl2O розчиняється у воді з утворенням сильної основи TlOH:
Tl2O+H2O®2TlOH.
3.3.4. Сполуки з іншими елементами. Елементи ІІІ А групи утворюють сульфіди E2S3, а талій – ще і Tl2S. Сульфіди бору, алюмінію, галію повністю гідролізують;
E2S3+6H2O→2E(OH)3+3H2S.
Сульфіди індію та талію E2S3 не взаємодіють ні з водою, ні з кислотами.
Елементи ІІІ А групи утворюють сполуки з азотом – нітриди EN. Алмазоподібна модифікація BN більш тверда та термостійка, ніж алмаз.
Фосфіди ЕР стійкі сполуки, мають властивості напівпровідників.
З карбідів найбільше значення має карбід боруВ4С. Це хімічно інертна сполука, тверда, як алмаз, добре проводить електричний струм.
3.4. Гідроксиди та їх похідні. Всі елементи ІІІ А групи утворюють гідроксиди Е(ОН)3, а талій – ще і TlOH. Хімічні властивості гідроксидів зі збільшенням порядкового номеру елемента закономірно змінюються: Н3ВО3 – кислота, Al(OH)3, Ga(OH)3, In(OH)3 – амфотерні гідроксиди, Tl(OH)3 – основа, TlOH – сильна, розчинна у воді основа.
Гідроксиди алюмінію, галію, індію та талію одержують дією лугів на розчинні солі:
E(NO3)3+3NaOH®E(OH)3+3NaNO3.
Ці гідроксиди термічно нестійкі:
2E(OH)3  E2O3+3H2O.
E2O3+3H2O.
Гідроксид Tl(I) також розкладається при нагріванні:
2TlOH  Tl2O+H2O.
Tl2O+H2O.
Амфотерні гідроксиди алюмінію, галію та індію взаємодіють з лугами та кислотами:
E(OH)3+3NaOH®Na3[E(OH)6];
E(OH)3+3HNO3®E(NO3)3+3H2O.
Солі сильних кислот розчиняються у воді та частково гідролізують. Розчинні солі слабких кислот гідролізують повністю:
Al2(CO3)3+6H2O®2Al(OH)3+3H2O+3CO2.
Ортоборну кислоту H3BO3 одержують або розчиненням у воді оксиду, або витисненням її з тетраборату натрію сильними кислотами:
Na2B4O7+H2SO4+5H2O®4H3BO3+Na2SO4.
Н3ВО3 – дуже слабка кислота. При нейтралізації її лугами утворюються солі не ортоформи, а поліборних кислот, зокрема тетраборної Н2В4О7, яка у вільному стані не існує:
4H3BO3+2NaOH®Na2B4O7+7H2O.
При нагріванні Н3ВО3 втрачає воду:
H3BO3 

 B2O3.
B2O3.
Лабораторна робота