 |
|
Деякі важливі фізичні характеристики p-елементів VА групи наведені у таблиці 10.
Таблиця 10
| Елемент, Е | N | P | As | Sb | Bi |
 Радіус атома, нм Радіус атома, нм
| 0,075 | 0,106 | 0,120 | 0,140 | 0,146 |
| Радіус іона, нм: Е3- Е3+ Е5+ | 0,148 0,116 0,13 | 0,186 0,044 0,017 | 0,192 0,058 0,046 | 0,208 0,076 0,060 | 0,213 0,103 0,076 |
| Перший потенціал іонізації, еВ | 14,535 | 10,487 | 9,815 | 8,64 | 7,29 |
| Спорідненість до електрону, еВ | -0,21 | 0,8 | 1,07 | 0,94 | 0,95 |
| Електронегативність | 3,07 | 2,06 | 2,20 | 1,82 | 1,67 |
| Ступені окислення Е у сполуках (виділені найбільш характерні) | -3, -2, -1,+1, +2,+3, +4,+5 | -3 +1 +3, +4 +5 | -3 +3 +5 | -3 +3 +5 | -3 +3 +5 |
5.2. Прості речовини
В промисловості азот одержують ректифікацією рідкого повітря. В лабораторії:
2NH3 + 3CuO → N2 + 3Cu + 3H2O;
4NH3 +3O2 → 2N2 + 6H2О;
NH4NO2 → N2 + 2H2O;
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O;
5Mg + 12HNO3p → N2 + 5Mg(NO3)2 + 6H2O.
Фосфор одержують в електричних печах за реакцією:
Ca3(PO4)2 + 5C + 3SiO2 → 2P + 3CaSiO3 + 5CO.
У разі швидкої конденсації парів під водою утворюється білий фосфор. Червоний фосфор утворюється з білого при нагріванні у відсутності повітря, чорний – з білого, нагріванням його при високому тиску.
Миш’як отримують розкладом природної сполуки арсенопіриту.
Сурму, миш’як, вісмут одержують з природних сульфідів.
Азот і фосфор – типові неметали, сурма, миш’як мають металічні та неметалічні модифікації, вісмут – метал.
Молекулярний азот хімічно малоактивний, за кімнатної температури реагує тільки з літієм. При активації молекул ( нагрівання, електричний розряд, каталізатор та ін.) азот окислює багато металів і неметалів, утворюючи нітриди. Окислюється лише фтором та киснем.
P, As, Sb, Bi мають більш високу хімічну активність. Вони можуть і відновлюватись, і окислюватись: з легкістю реагують з неметалами – киснем, сіркою, галогенами тощо, з багатьма металами. Не взаємодіють з кислотами-неокислювачами, при нагріванні реагують з кислотами-окислювачами.
При нагріванні у воді та у розчинах лугів білий та червоний фосфор диспропорціонує:
P04 + 3NaOH +3 H2O → P‾3H3 + 3NaH2P+1O2
Сурма та вісмут стійкі до води та лугів. Миш’як у воді не розчиняється , а лугами при нагріванні окислюється. При переході від миш’яку до вісмуту стабілізується більш низький ступінь окислення +3; хімічний зв’язок у сполуках стає більш іонним.
Реакції з простими речовинами. З лужними та лужноземельними металами утворюють нітриди, фосфіди, арсеніди, стибіди, вісмутіди складу Ме+13Е або Ме+23Е2. З іншими металами утворюють сполуки змінного складу МехЕу.
N2 + 6Li → 2Li3N;
N2 + 3H2  2NH3;
2NH3;
4E + 3O2 → 2E2O3 ( E = P,As,Sb, Bi );
4P + 5O2  2P2O5;
2P2O5;
N2 + O2  2NO;
2NO;
2E + 5S → E2S5 → ( E = P, As, Sb, Bi );
2E + 3Г2 → 2ЕГ3 ( E = P, As, Sb, Bi; Г = F, Cl, Br, I );
N2 + 3F2  2NF3.
2NF3.
Реакції з найважливішими реагентами:
Bi + 6HNO3p → Bi(NO3)3 + 3NO2 + 3H2O;
2As + 3H2SO4конц → 2HAsO2 + 3SO2 + 2H2O;
2Bi + 6H2SO4конц → Bi2(SO4)3 + 3SO2 + 6H2O;
2As + 6NaOH → 2Na3AsO3 + 3H2;
3P + 5HNO3конц + 2H2O → 3H3PO4 + 5NO;
2Sb + 10HNO3конц → Sb2O5 + 10NO2 + 5H2O.
З соляною кислотою не реагують.
5.3. Бінарні сполуки
5.3.1. Сполуки з воднем. Для елементів групи VA відомі водневі сполуки складу ЕН3. Для азоту, крім того ще і N2H4 (гідразин) та HN3 (азотистоводнева кислота), а для фрсфору – P2H4 (дифосфін ).
ЕН3 – отруйні ( крім NH3 ) гази, малорозчинні у воді (крім NH3). AsH3, SbH3, BiH3 – термічно нестійкі.
Аномальна поведінка NH3 пов’язана з асоціацією молекул за рахунок водневих зв’язків.
N2H4, P2H4, HN3 – рідини. N2H4 та HN3 – вибухонебезпечні сполуки, а P2H4 – самозапалюється у повітрі.
В лабораторії NH3 одержують дією лугів на солі амонію:
2NH4Cl + Ca(OH)2 → 2NH3 + 2H2O + CaCl2
В промисловості:
1. Синтезом з простих речовин за умов: Т=450оС, Р=30МПа (1000ат), каталізатор – губчате залізо з активуючими домішками ( Al2O3, K2O та інші):
N2 + 3H2 → 2NH3
2. Дією води на нітриди активних металів:
AlN + 3H2O → Al(OH)3 + NH3
Гідразин можна одержати окисленням NH3:
2NH3 + NaClO → N2H4 + NaCl + H2O
HN3 – за реакцією:
N2H4 + HNO2 → HN3 + 2H2O
PH3 – розкладом фосфідів водою, кислотами:
Ca3P2 + 6H2О → 3Ca(OH)2 + 2PH3,
або взаємодією білого фосфору з концентрованим розчином лугу:
4P + 3NaOH + 3H2O → PH3 + 3NaH2PO2.
гіпофосфіт
натрію
AsH3, SbH3, BiH3 – одержують дією кислот на сполуки елементів з металами:
Ca3E2 + 6HCl → 3CaCl2 + 2EH3.
AsH3, SbH3 можна одержати відновленням сполук елементів воднем під час його виділення:
H3AsO3 + 3Zn + 6HCl → AsH3 + 3ZnCl2 + 3H2O
Арсин утворюється при наявності у розчині будь-якої сполуки миш’яку. На цьому базується реакція Марша для виявлення миш’яку:
2AsH3  2As + 3H2
2As + 3H2
Утворюється “миш’якове дзеркало” – чорний блискучий шар миш’яку. Аналогічно утворюється і “сурм’яне дзеркало”. Розрізняють їх дією сильних окисників (HNO3, NaClO ) – As розчиняється з утворенням H3AsO4, а Sb переходить у білий осад Sb2O5∙xH2O.
EH3, N2H4, P2H4 – сильні відновники:
4NH3 + 3O2 → 2N2 + 6H2O;
2NH3 + Г2 → 6HГ + N2 (Г=Cl, Br);
2NH3 + 2KMnO4 → N2 + 2MnO2 + 2KOH + 2H2O;
2NH3 + NaClO → N2H4 + NaCl + H2O;
2PH3 + 4O2 → P2O5 + 3H2O;
5PH3 +8KMnO4 + 12H2SO4 → 5H3PO4 + 8MnSO4 + 4K2SO4+ 12H2O;
N2H4 + O2 → N2 + 2H2O.
Для NH3 та N2H4 характерні реакції приєднання за рахунок донорно-акцепторної взаємодії: NH3 та N2H4 як ліганди входять до складу багатьох комплексних сполук, реагують з водою, кислотами:
NH3 + H2O D NH4+ + OH-;
Іон амонію
N2H4 + H2O D N2H5+ + OH-;
Іон гідразонію
NH3 + HCl → NH4Cl;
N2H4 + HCl → N2H5Cl;
CuSO4 + 4NH3 → [Cu(NH3)4]SO4;
ZnCl2 + 2N2H4 → [Zn(N2H4)2]Cl2.
Здатність до реакцій приєднання в ряду NH3, PH3, AsH3, SbH3 послаблюється . AsH3 та SbH3 не утворюють комплексних сполук, з водою та кислотами не реагують. РН3 з водою не взаємодіє, але з сильними кислотами утворює солі фосфонію:
PH3 + HI → PH4I
PH3 також входить до складу деяких комплексних сполук як ліганд.
При нагріванні солі амонію розкладаються. Характер розкладу залежить від аніону: якщо сіль утворена леткою кислотою, то продуктом розкладу є кислота та аміак, які при охолодженні можуть знову з’єднуватись, утворюючи вихідну сіль. Якщо кислота багатоосновна, нелетка, не є окисником, то утворюються аміак та кисла сіль амонію (або кислота). Якщо ж сіль амонію утворена кислотою, аніон якої сильний окисник, то розклад солі супроводжується окисленням аміаку до вільного азоту чи до оксидів азоту:
(NH4)2CO3  2NH3 + CO2 + H2O;
2NH3 + CO2 + H2O;
NH4Cl  NH3 + HCl;
NH3 + HCl;
(NH4)2SO4  NH3 + NH4HSO4;
NH3 + NH4HSO4;
NH4H2PO4  NH3 + H3PO4;
NH3 + H3PO4;
NH4NO2  N2 + 2H2O;
N2 + 2H2O;
NH4NO3  N2O + 2H2O;
N2O + 2H2O;
(NH4)2Cr2O7  N2 + Cr2O3 + 4H2O.
N2 + Cr2O3 + 4H2O.
Для аміаку характерні також реакції заміщення атомів водню атомами металів, галогенів, гідроксидом:
2NH3 + 2Na → 2NaNH2 + H2;
4NH3 + 3F2 → NF3 + 3NH4F.
При заміщенні трьох атомів водню утворюються нітриди:
2Al + 2NH3  2AlN + 3H2
2AlN + 3H2
Нітриди активних металів розкладаються водою:
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
При заміщенні двох атомів водню утворюються іміди, а одного – аміди. Продуктом заміщення одного атому водню гідроксильною групою є гідроксиламін N‾1H2OH. Це кристалічна речовина, сильний відновник, хоч може бути і окисником. У розчині – слабка основа:
NH2OH + HCl → [NH3OH]Cl
HN3( 2) – у розчині слабка одноосновна кислота, азотистоводнева або азидоводнева. Її солі, азиди, як правило, вибухонебезпечні; так, Pb(N3)2 використовують як детонатор.
2) – у розчині слабка одноосновна кислота, азотистоводнева або азидоводнева. Її солі, азиди, як правило, вибухонебезпечні; так, Pb(N3)2 використовують як детонатор.
HN3 та азиди можуть бути і окисниками, і відновниками:
Сu + 3H  2 → Cu(N3)2 +
2 → Cu(N3)2 + 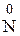 2 +
2 +  H3;
H3;
6KMnO4+5HNN2 + 9H2SO4 → 6MnSO4+3K2SO4+5N2+5HNO3+9H2O.
5.3.2. Сполуки з галогенами
Відомі сполуки з галогенами складу ЕГ3 і ЕГ5 (крім азоту).
| Сполуки з галогенами | N | P | As | Sb | Bi |
| ЕГ3 | NГ3 | РГ3 | AsГ3 | SbГ3 | BiГ3 |
| (Г= F, Cl, I) | (Г = F, Cl, Br, I) | ||||
| ЕГ5 | – | РГ5 | AsF5 | SbF5, SbCl5 | BiF5 |
| (Г=F, Cl, Br) |
ЕГ3 та ЕГ5 – гази, рідини, тверді речовини, мають низькі температури плавлення, крім BiГ3, – твердих речовин з високими температурами плавлення. NГ3,крім NF3, – вибухонебезпечні речовини.
Одержують NГ3 взаємодією галогенів з аміаком чи солями амонію:
4NH3 + 3F2 → NF3 + 3NH4F;
NH4Cl + 3Cl2 → NCl3 + 4HCl.
ЕГ3, ЕГ5(Е=P, As, Sb, Bi) – синтезом із простих речовин:
2P +3Г2 → 2РГ3;
2Sb + 5Cl2  2SbCl5.
2SbCl5.
ЕГ3 можна одержати термічним розкладом ЕГ5:
SbCl5 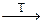 SbCl3 + Cl2.
SbCl3 + Cl2.
РГ3, AsГ3, EГ5 – галогенангідриди, гідролізують:
PCl3 + 3H2O → H3PO3 + 3HCl;
AsCl3 2H2O → HАsO2 + 3HCl;
ЕГ5 +4H2O → H3EO4 + 5HГ (E=P,As).
Гідроліз PCl5 відбувається ступінчато:
PCl5 + H2O → POCl3 + 2HCl;
оксохлорид
фосфору(V)
POCl3 + 3H2O → H3PO4 + 3HCl
SbГ3, BiГ3 – солі, гідролізують з утворенням оксосолей:
ЕCl3 + H2O D EOCl + 2HCl (E=Sb, Bi).
ЕГ3, крім NГ3 та EГ5, схильні до комплексоутворення:
EF5 + KF → K[EF6] (E=P,As,Sb).
5.3.3. Оксиди
Для азоту відомі оксиди, що відповідають всім ступеням окислення – від +1 до +5. Для P,As,Sb,Bi – оксиди складу Е2О3 та Е2О5.
NO, E2O3 (E = As, Sb, Bi), P2O3, P2O5 можна одержати синтезом з простих речовин:
N2 + O2 → 2NO;
4P + 5O2 → 2P2O5;
4Sb + 3O2 → 2Sb2O3.
N2O одержують термічним розкладом NH4NO3:
NH4NO3 → N2O + 2H2O.
NO одержують в промисловості окисленням аміаку:
4NH3 + 5O2  4NО + 6H2O,
4NО + 6H2O,
а в лабораторії – відновленням розбавленої азотної кислоти міддю:
3Cu + 8HNO2p → 3Cu(NO3)2 + 2NO + 4H2O.
NO2 одержують у промисловості окисленням NO киснем повітря:
2NO + O2 → 2NO2,
а в лабораторії :
Cu + 4HNO3конц → Cu(NO3)2 + 2NO2 + 2H2O.
N2O3 – за реакцією:
NO + NO2 D N2O3.
N2O5 – дегідратацією HNO3 фосфорним ангідридом:
2HNO3 + P2O5 → 2HPO3 + N2O5, або
N2O3 + 2O3 → N2O5 + 2O2
As2O5, Sb2O5, As2O3, Sb2O3, Bi2O3 – окисленням простих речовин:
2Sb + 10HNO3конц → Sb2O5 + 10NO2 + 5H2O,
або прокалюванням гідроксидів:
2Bi(OH)3 → Bi2O3 + 3H2O
Всі оксиди, крім NO,P2O3, термічно нестійкі:
N2O3 D NO + NO2;
2N2O5  4NO2 + O2;
4NO2 + O2;
2N2O  2N2 + O2;
2N2 + O2;
2NO2  2NO + O2;
2NO + O2;
As2O5  As2O3 + O2;
As2O3 + O2;
Bi2O5  Bi2О3 + O2.
Bi2О3 + O2.
NO2 за низьких температур димеризується:
2NO2  N2O4, ΔH=-57кДж.
N2O4, ΔH=-57кДж.
N2O та NO з водою не реагують; NO2,розчиняючись у воді та в лугах, диспропорціонує:
2NO2 + H2O → HNO2 + HNO3;
2NO2 + KOH → KNO2 + KNO3 + H2O.
Оксиди N(III,V), P(III,V), As(III,V), взаємодіючи з водою, утворюють відповідні кислоти.
Sb2O5 розчиняється у лугах, Sb2O3 – у лугах та в соляній кислоті , а Bi2O3 – у кислотах:
Sb2O5 + 2KOH + 5H2O → 2K[Sb(OH)6];
Sb2O3 + 6NaOH + 3H2O → 2Na3[Sb(OH)6];
Sb2O3 + 6HCl → 2SbCl3 + 3H2O;
Bi2O3 + 6HNO3 → 2Bi(NO3)3 + 3H2O.
Всі оксиди азоту – окисники, найбільш сильний окисник N2O5.
Sb2O5 – сильний окисник у кислому середовищі:
Sb2O5 + 10HCl → 2SbCl3 + 2Cl2 + 5H2O.
NO, N2O3, NO2, E2O3 (E = As, Sb, Bi) окислюються дією сильних окисників:
2Bi2O3 + 2O3 → 2Bi2O5 + O2;
3As2O3 + 4HNO3 + 7H2O → 6H3AsO4 + 4NO.
Характерною властивістю NО є легкість взаємодії з киснем за звичайних умов:
2NO + O2 → 2NO2.
NO схильний до комплексоутворення. Як ліганд входить до складу деяких комплексних сполук:
[Fe(H2O)6]SO4 + NO D [Fe(H2O)5 NO]SO4 + H2O.
5.3.4. Сполуки з іншими елементами
Елементи групи VA утворюють багато сполук з сіркою. Для азоту та фосфору найбільш стійкі S4N4 та P4S3, для миш’яку, сурми, вісмуту найбільш характерні сполуки складу E2S3 та E2S5. Всі сполуки з сіркою, крім S4N4, – забарвлені, тверді речовини, не розчинні у воді; S4N4 – темно-червона рідина.
E2S3 та E2S5 одержують дією сірководню чи сульфідів лужних металів на сполуки As, Sb, Bi:
2HAsO2 + 3H2S 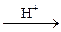 As2S3 + 4H2O;
As2S3 + 4H2O;
2H3AsO4 + 5H2S 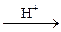 As2S5 + 8H2O;
As2S5 + 8H2O;
2SbCl3 + 3Na2S → Sb2S3 + 6NaCl;
2BiCl3 + 3H2S → Bi2S3 + 6HCl.
E2S3, E2S5, P4S3 можна одержати, сплавляючи прості речовини з сіркою:
2Bi + 3S  Bi2S3;
Bi2S3;
P4 + 3S  P4S3.
P4S3.
S4N4 – взаємодією сірки та рідкого аміаку:
10S + 16NH3 D 6(NH4)2 S+ S4N4.
Всі сполуки елементів з сіркою, крім Bi2S3 та S4N4, є тіоангідридами. Тіокислоти, що їм відповідають, розкладаються у момент утворення при дії сильних кислот на тіосолі:
(NH4)3AsS3 + 3HCl → H3AsS3 + 3NH4Cl;
2H3AsS3 → As2S3 + 3H2S.
Сульфіди P, As, Sb утворюють тіосолі при взаємодії з сульфідами лужних металів та сульфідом амонію:
As2S3 + 3Na2S → 2Na3AsS3;
As2S3 + 3(NH4)2S → 2(NH4)3AsS3;
Sb2S3 + 3(NH4)2S → 2(NH4)3SbS3;
As2S5 + 3(NH4)2S → 2(NH4)3AsS4.
Bi2S3 у сульфіді амонію не розчиняється.
Сульфіди As,Sb, Bi не розчиняються у кислотах-неокисниках, а розчиняються в концентрованих розчинах кислот-окисників:
3As2S5 + 40HNO3 + 4H2O → 6H3AsO4 + 15H2SO4 + 40NO.
5.5. Гідроксиди та їх похідні
Для всіх елементів групи VA відомі гідроксиди, що відповідають ступеням окислення +3 та +5 ( крім вісмуту ) , а для фосфору – ще і +1 та +4 (табл. 11).