 |
|
Молекулярні спектри
На вiдмiну вiд атомiв, енергiя молекули визначається не тiльки енергетичним станом електронної оболонки, але й коливаннями ядер атомiв, що входять до складу молекули, а також енергiєю обертання ядер навколо загального центра мас. Взагалi, цi три види руху взаємопов’язанi, але в достатньому наближеннi можна знехтувати їх взаємним впливом. Тодi повна енергiя молекули може бути подана у виглядi суми електронної, коливальної та обертальної енергiй:
Е = Еел + Екол + Еоб .
Кожний з цих видiв енергiї пiдпорядковується квантовим законам, тобто може приймати строго визначенi значення. В результатi частота свiтла, що випромiнюється або поглинається при змiнi енергетичного стану молекули, визначається рівністю:
v = DЕ/h = DЕел/h + DЕкол/h + DЕоб/h,
завдяки чому спектр молекули містить окремі, близько розташовані лiнiї, що складають смуги.
Теорiя та експеримент показує, що найбiльше значення набувають рiзницi електронних енергiй, а найменше – рiзницi обертальних енергiй, тобто
DЕел > DЕкол > DЕоб ,
 .
.
Розглянемо структуру енергетичних рiвнiв молекули (мал. 9.7).
Електронна оболонка молекули, як i атома, може знаходитись в рiзних енергетичних станах. Нехай рiвнi Еел та Е¢ел вiдповiдають основнiй та збудженiй електронним конфiгурацiям. Кожнiй з цих електронних конфiгурацiй вiдповiдають свої коливання ядер, в результатi чого ми одержимо два набори коливальних рiвнiв для основної та збудженої електронних конфiгурацiй. Завдяки обертанню молекули кожний коливальний рiвень розпадається на ряд обертальних пiдрiвнiв.

Мал. 9.7.Структура енергетичних рівнів молекули.
Молекулярнi спектри займають широкий дiапазон електромагнiтного випромiнювання.
Нехай збудження молекули незначне, так що
DЕел = 0, DЕкол = 0, DЕоб ¹ 0.
У цьому випадку спостерiгаємо переходи мiж обертальними пiдрiвнями в межах одного коливального рiвня (мал. 9.7, 1). Частоти, що випромiнюються або поглинаються при таких переходах, утворюють чисто обертальний спектр, що складається з окремих лiнiй, розташованих в далекiй iнфрачервонiй та мiкрохвильовiй областях (l ~ 0.1–1 мм).
Нехай збудження молекули приводить до змiни коливальної енергiї ядер, тобто:
DЕел = 0, DЕкол ¹ 0, Еоб ¹ 0.
В цьому випадку виникає коливально-обертальний спектр, який розташований в ближнiй iнфрачервонiй областi. Вiн складається зi смуг, якi розпадаються на окремi лiнiї, що зумовленi переходами мiж обертальними пiдрiвнями у межах одного й того ж електронного рiвня (мал. 9.7, 2).
При значному збудженнi молекули
DЕел ¹ 0, DЕкол ¹ 0, DЕоб ¹ 0.
Електронно-коливально-обертальний спектр, що спостерігається при цьому, лежить у видимiй та ультрафiолетовiй областях. Вiн складається зi смуг, утворених окремими лiнiями, якi вiдповiдають переходам мiж обертальними пiдрiвнями рiзних електронних конфiгурацiй (мал. 9.7, 3).
Спектри поглинання (абсорбцiї) та випромiнювання (емiсiї) даного сорту молекул строго iндивiдуальнi та специфiчнi, що дозволяє використовувати їх для проведення якiсного та кiлькiсного аналiзiв. Особливо важливим джерелом iнформацiї про будову органiчних молекул та характер мiжмолекулярних взаємодiй є абсорбцiйнi коливальнi та електроннi спектри. Завдяки встановленiй вiдповiдностi мiж спостерiгаємими частотами та коливаннями рiзних груп атомiв в молекулi стало можливим по коливальному спектру визначати присутнiсть у молекулi окремих груп атомів та зв’язкiв, тобто визначати склад молекули. Для iдентифiкацiї речовин, визначення їх концентрацiї, структурних параметрiв макромолекул та їх оточення вимiрюється ступiнь поглинання свiтла. Поглинання свiтла проявляється в послабленнi свiтлового потоку, що пройшов дослiджуваний зразок (розчин або речовину). Воно буде тим бiльшим, чим бiльша концентрацiя С дослiджуваної речовини в розчинi, товщина кювети з розчином L та здатнiсть речовини до поглинання, що характеризується коефіцієнтом æ1. Цi закономiрностi вiдображенi в законi Бугера-Ламберта-Бера
 ,
,
який можна подати у виглядi
D = lg(I0/I) = æ1cL,
де D – оптична густина зразка; I0, I – iнтенсивностi падаючого свiтла та свiтла, що пройшло речовину, вiдповiдно; æ1 – коефiцiєнт поглинання.
Дослiдження поглинання свiтла рiзними речовинами здiйснюють за допомогою спектрофотометрiв. Принципову схему спектрофотометра подано на мал. 9.8.

Мал. 9.8.Принципова схема спектрофотометра.
Свiтло вiд джерела випромiнювання (1) проходить через монохроматор (2) для видiлення складової з певною довжиною хвилi. Розчин дослiджуваної речовини та чистий розчинник знаходяться в двох кюветах (3, 4), розмiщених в спеціальних держаках. Свiтло проходить через кювету i падає на фотоелемент (5), вихiдний сигнал якого реєструється вимiрювальним приладом (6).

| а) | б) |
Мал. 9.9.Спектри поглинання у вигляді залежностей
D = f (l) і t = f (l).
Принцип роботи спектрофотометра полягає у вимiрюваннi iнтенсивностi свiтла, що пройшло через розчинник, та інтенсивності світла, що пройшло через розчин речовини у тому ж розчиннику. Рiзниця цих iнтенсивностей дозволяє зробити висновок про ступiнь поглинання свiтла розчиненою речовиною. Для одержання спектра ця операцiя повторюється для багатьох довжин хвиль. Спектр подають у виглядi залежностi D = f (l), або t = f (l) (мал. 9.9, а, б), де
t = I / I0 – коефiцiєнт пропускання.
ЛЮМIНЕСЦЕНЦIЯ
Згiдно з законом Кiрхгофа, теплове випромiнювання будь-якого тiла у будь-якiй областi спектра завжди менше за теплове випромiнювання абсолютно чорного тiла у тiй же областi спектра i при тiй самiй температурi.
| 
| |
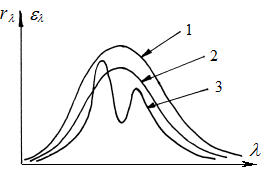
| Мал. 9.10.Експериментальні криві розподілу енергії в спектрах випромінювання абсолютно чорного (1), сірого (2) та довільного (3) тіл. | Мал. 9.11. Криві розподілу енергії в спектрах люмінесцентного випромінювання і випромінювання абсолютно чорного і сірого тіл при однакових температурах. |
Наведенi на мал. 9.10 експериментальнi кривi rl = f (l) розподiлу енергiї у спектрi випромiнювання сiрого тiла (2) та довiльного тiла, теплове випромiнювання якого являється селективним (3), розташованi нижче кривої el = f (l) розподiлу енергiї у спектрi випромiнювання абсолютно чорного тiла (1).
Якщо при дослiдженнi спектральної густини енергетичної свiтностi rl якого-небудь тiла виявиться, що на окремих дiлянках спектра вона перевищує спектральну густину енергетичної свiтностi абсолютно чорного тiла el, то можна стверджувати, що на цих дiлянках спектра тiло є джерелом випромiнювання, надлишкового над тепловим (мал. 9.11).
Оптичне випромiнювання тiла, яке є надлишковим над тепловим випромiнюванням того ж самого тiла в данiй спектральнiй областi при тiй же температурi i має тривалiсть свiчення бiльшу за 10–10 с, зветься люмiнесценцiєю.
Види люмінесценції
Початковим актом люмiнесценцiї є збудження атома або молекули. В залежностi вiд способу збудження розрiзняють такі види люмiнесценцiї:
1. Електролюмiнесценцiя (свiчення газiв при електричному розрядi).
2. Катодолюмiнесценцiя (свiчення, збуджене ударами електронiв).
3. Хемолюмiнесценцiя (свiчення, яке супроводжує екзотермiчнi хiмiчнi реакцiї).
4. Радiолюмiнесценцiя (свiчення пiд дiєю ядерного випромiнювання).
5. Бiолюмiнесценцiя (свiчення бiооб’єктiв).
6. Фотолюмiнесценцiя (свiчення пiд дiєю оптичного випромiнювання видимої або ультрафiолетової областей).
Незалежно вiд способу збудження люмiнесцентне випромiнювання має ряд особливостей, а саме:
а) люмiнесцентне випромiнювання триває деякий час пiсля усунення причин, що його викликає (це дозволяє вiдрiзняти люмiнесценцiю вiд розсiяного або вiдбитого випромiнювань).
б) кожна речовина має певний, характерний саме для нього, спектр люмiнесценцiї.