 |
|
ОСНОВНІ ЗАЛЕЖНОСТІ І РОЗРАХУНКОВІ ФОРМУЛИ
ДО РОЗДІЛУ ІІІ
1. Рівняння простої перегонки:
 , (ІІІ.1)
, (ІІІ.1)
де F – початкова кількість суміші, що переганяється; W – залишок рідини в кубі після перегонки; у* та х – рівноважні концентрації НК компонента в парі і в рідині; хF – вміст НК компонента в початковій суміші; хW – вміст НК компонента в залишку після перегонки.
Середній склад перегнаної рідини:
 . (ІІІ.2)
. (ІІІ.2)
Розрахунок за рівняннями (ІІІ.1) і (ІІІ.2) здійснюють, застосовуючи або молярні кількості і молярні концентрації, або масові кількості чи масові концентрації.
2. Під час перегонки рідини з водяною парою (або інертним газом) витрату пари розраховують за рівнянням:
 , (ІІІ.3)
, (ІІІ.3)
де GB – кількість водяної пари, що виходить з парою рідини, яка переганяється, кг; G – кількість рідини, що переганяється, кг; MB , M – мольні маси води і рідини, що переганяються; P – тиск насиченої пари рідини, що переганяється, за температури перегонки; П – загальний тиск суміші парів; j – коефіцієнт, що враховує неповноту насичення водяної пари парою речовини, що переганяється (під час орієнтовних розрахунків приймають j = 0,7 – 0,8).
3. Рівняння матеріального балансу ректифікаційної колони безперервної дії (для ректифікаційних колон, що обігріваються глухою парою):
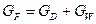 (ІІІ.4)
(ІІІ.4)
 , (ІІІ.5)
, (ІІІ.5)
де GF , GD, GW – масові або молярні витрати живлення, дистиляту і кубового залишку; хF, хD, хW – вміст НК компонента в живленні, дистиляті і кубовому залишку, масові або молярні частки.
4. Рівняння робочих ліній (у разі живлення колони киплячою сумішшю):
а) верхньої (зміцнювальної) частини ректифікаційної колони
 , (ІІІ.6)
, (ІІІ.6)
б) нижньої (вичерпної) частини колони
 , (ІІІ.7)
, (ІІІ.7)
де у і х – змінні за висотою колони нерівноважні концентрації (мольні частки) НК компонента в парі та рідині в певному перетині колони. Для тарілчастих колон:
у – мольна частка НК компонента в парі, що входить знизу на тарілку; х – мольна частка НК компоненту в рідині, яка стікає з цієї тарілки; 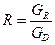 –флегмове число;
–флегмове число;  – відносна (на 1 кмоль дистиляту) мольна витрата живлення.
– відносна (на 1 кмоль дистиляту) мольна витрата живлення.

Рис. ІІІ.1. Схема ректифікаційної колони
У ректифікаційній колоні, на відміну від абсорбційної, приймають на підставі теоретичних передумов сталими за висотою колони загальні молярні витрати пари і рідини. Відповідно до цього в рівняннях (ІІІ. 6) і (ІІІ. 7) застосовуються молярні витрати і концентрації.
У верхній частині колони, вище від введення вихідної рідкої суміші, стала за висотою колони молярна витрата рідини дорівнює GR, у нижній частині колони вона дорівнює (GR + GF) – див. рис. ІІІ. 1. Стала за висотою мольна витрата пари GV є однаковою у верхній і в нижній частині колони.
При використанні відносних молярних витрат рівняння матеріального балансу колони (ІІІ.4) і (ІІІ.5) запишуться:
 , (ІІІ.8)
, (ІІІ.8)
 , (ІІІ.9)
, (ІІІ.9)
де  – відносна мольна витрата кубового залишку; хF, xD, хW – мольні частки НК компонента в живленні, дистиляті, кубовому залишку.
– відносна мольна витрата кубового залишку; хF, xD, хW – мольні частки НК компонента в живленні, дистиляті, кубовому залишку.
5. Мінімальне флегмове число в ректифікаційній колоні безперервної дії, коли крива рівноваги не має точок перегину (западин), визначають за рівнянням:
 , (ІІІ.10)
, (ІІІ.10)
де xD – мольна частка НК компонента в дистиляті; хF, – те саме в початковій рідині (живленні) колони;  – те саме в парі, рівноважній з рідиною живлення.
– те саме в парі, рівноважній з рідиною живлення.
Робоче (реальне) флегмове число:
 , (ІІІ.11)
, (ІІІ.11)
тут j > 1 – коефіцієнт надлишку флегми.
При розрахунках ректифікаційних колон робоче флегмове число здебільшого визначають за формулою
 (ІІІ.12)
(ІІІ.12)
Якщо на кривій рівноваги є западина, то величину 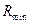 визначають графічно – див. приклад ІІІ.16.
визначають графічно – див. приклад ІІІ.16.
6. Витрату тепла в кубі-випарнику ректифікаційної колони неперервної дії визначають з рівняння теплового балансу колони з дефлегматором-конденсатором (рис. ІІІ.1):
 , (ІІІ.13)
, (ІІІ.13)
де QК – витрата тепла, яку одержує кипляча рідина від гріючої пари, що конденсується, в кубі-випарнику, Вт; QД – витрата тепла, що відбирається охолоджувальною водою від пари, що конденсується в дефлегматорі парів, Вт; Qвтр– теплові втрати колони у довкілля, Вт; GF, GD, GW – масові витрати живлення, дистиляту, кубового залишку, кг/с; iF, iD, iW – відповідні питомі ентальпії, Дж/кг.
З рівняння (ІІІ. 13) одержуємо:
 , (ІІІ.14)
, (ІІІ.14)
де cD, сW, cF – середні питомі теплоємності, Дж/(кг×К); tD, tW, tF – відповідні температури, °С.
Витрата тепла, що віддається охолоджувальній воді в дефлегматорі:
 , (ІІІ.15)
, (ІІІ.15)
де R – флегмове число; rD – питома теплота конденсації пари в дефлегматорі, Дж/кг.
7. Діаметр тарілчастої ректифікаційної колони визначають за рівнянням
 , (ІІІ.16)
, (ІІІ.16)
де V – витрата пари, що проходить колоною, м3/с; w – швидкість пари, віднесена до повного поперечного перерізу колони, м/с.
Допустиму оптимальну швидкість пари в колоні розраховують за формулою
 , (ІІІ.17)
, (ІІІ.17)
в якій С – коефіцієнт, що залежить від конструкції тарілок, відстані між тарілками, робочого тиску в колоні, навантаження колони за рідиною; rр і rп – густина рідини і пари, кг/м3.
У випадку, коли rр >> rп
 . (ІІІ.17a)
. (ІІІ.17a)
На рис. ІІІ.2 за даними, наведеними в [2], подано значення коефіцієнта С залежно від відстані між тарілками h для ректифікаційних колон, що працюють за атмосферного тиску і середніх навантаженнях за рідиною.
Після визначення за рівнянням (ІІІ.16) діаметра колони його уточнюють відповідно до наявних нормативів.

Рис. ІІІ.2. Значення коефіцієнта C: А, Б – ковпачкові тарілки
з круглими ковпачками; В – сітчасті тарілки
8. Визначення висоти тарільчастої колони (відстані HT між верхньою і нижньою тарілками) ректифікаційної колони виконують за рівнянням:
 , (ІІІ.18)
, (ІІІ.18)
де п – кількість тарілок в колоні; h – відстань між тарілками.
Розрахунок необхідної кількості тарілок п виконують графічно, використовуючи кінетичні закономірності – рівняння масопередачі і розрахункові залежності для коефіцієнтів масовіддачі (або кількості одиниць перенесення) у паровій і рідкій фазах на тарілці [2, 5].
Під час наближених розрахунків застосовують теоретично менш обгрунтований, але простіший метод визначення кількості тарілок за допомогою так званого середнього ККД тарілок (ККД колони):
 , (ІІІ.19)
, (ІІІ.19)
де nT – кількість теоретичних тарілок – ступенів зміни концентрації, яку знаходять графічною побудовою між рівноважною і робочими лініями на у–х діаграмі – див. рис. ІІІ.3.

Рис. ІІІ.3. Графічне визначення кількості ступенів зміни концентрації
(теоретичних тарілок) в ректифікаційній колоні: АВ – робоча лінія верхньої
частини колони; АС – робоча лінія нижньої частини колони
Величина середнього ККД тарілок h, який вводять для обліку реальних умов масообміну на тарілках, залежить від багатьох змінних величин (конструкція і розміри тарілки, гідродинамічні чинники, фізико-хімічні властивості пари і рідини). Значення h визначають за дослідними даними, переважно вони знаходяться в межах 0,3–0,8.
На тарілках з перехресним потоком пари і рідини зі збільшенням довжини шляху рідини по тарілці, тобто часу перебування рідини на тарілці, масообмін поліпшується, величина середнього ККД h зростає.
На рис. ІІІ. 4 наведено значення середнього ККД тарілок, отримане за дослідними даними для промислових ректифікаційних колон порівняно невеликого діаметра. На осі абсцис на цьому графіку відкладено добутки коефіцієнта відносної леткості компонентів, що розділяються, a [див. рівняння (3.4)] на коефіцієнт динамічної в'язкості рідини живлення m (в мПа×с) за середньої температури в колоні. Під час визначення середнього ККД тарілок в колонах великого діаметра (з довжиною шляху рідини l > 0,9 м) рекомендують до значень, знайдених згідно з рис. ІІІ. 4, додавати поправку D:
 (ІІІ.20)
(ІІІ.20)
Значення поправки D для сумішей з a×m = 0,l ÷ l,0 наведено на рис. ІІІ.5.

Рис. ІІІ.4. Діаграма для наближеного визначення середнього ККД тарілок
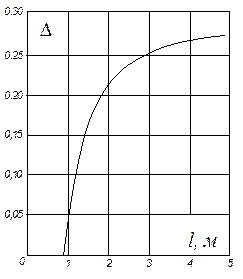
Рис. ІІІ.5. Залежність поправки D від довжини шляху рідини на тарілці l
9. Коефіцієнтом збагачення (коефіцієнтом корисної дії) окремої тарілки називають величину:
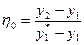 , (ІІІ.21)
, (ІІІ.21)
де у1 – мольна частка НК компоненту в парі, що надходить знизу на тарілку; у2 – те саме в парі, що йде з тарілки; у  – тесаме в парі, що є в рівновазі з рідиною, яка стікає з тарілки.
– тесаме в парі, що є в рівновазі з рідиною, яка стікає з тарілки.
Якщо рідина на тарілці повністю перемішується, то у  – частка НК компоненту в парі, що є в рівновазі з рідиною на тарілці.
– частка НК компоненту в парі, що є в рівновазі з рідиною на тарілці.
10. Діаметр і висоту насадкової ректифікаційної колони вибирають так само, як і для насадкової абсорбційної колони.
Діаметр насадкової колони розраховують за рівнянням (ІІІ.16). Фіктивну швидкість пари в точці захлинання w3 за rр >> rп – розраховують за рівнянням (2. 32), але з іншим значенням А. Для ректифікаційних колон А = – 0,125.
Висоту шару насадки Нн за плівкового режиму роботи колони знаходять окремо для верхньої і для нижньої частини апарата згідно з рівнянням
 , (ІІІ.22)
, (ІІІ.22)
подібно до рівняння (ІІ.10).
Тут G – стала за висотою колони молярна витрата пари, кмоль/с; Ку – коефіцієнт масоперенесення, кмоль/(м2×с·Dу = 1);  – площа поперечного перерізу колони, м2; s – питома поверхня насадки, м2/м3; y – коефіцієнт змочуваності насадки, безрозмірний; у* і у – рівноважна і робоча концентрації (молярні частки) НК компонента в парі.
– площа поперечного перерізу колони, м2; s – питома поверхня насадки, м2/м3; y – коефіцієнт змочуваності насадки, безрозмірний; у* і у – рівноважна і робоча концентрації (молярні частки) НК компонента в парі.
Для насадкових ректифікаційних колон, що працюють в режимі емульгування, еквівалентну висоту насадки hе (в точці інверсії) можна визначити з рівняння:
 , (ІІІ.23)
, (ІІІ.23)
де  – еквівалентний діаметр насадки, м;
– еквівалентний діаметр насадки, м; 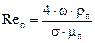 – критерій Рейнольдса;
– критерій Рейнольдса;  – відношення потоків пари і рідини: відповідно у верхній частині колони
– відношення потоків пари і рідини: відповідно у верхній частині колони  ; в нижній частині колони
; в нижній частині колони  , – див. рівняння (ІІІ. 6) і (ІІІ. 7); m – тангенс кута нахилу рівноважної лінії.
, – див. рівняння (ІІІ. 6) і (ІІІ. 7); m – тангенс кута нахилу рівноважної лінії.
Висоту шару насадки Нн знаходять за рівнянням (ІІІ. 22).
ПРИКЛАДИ
Приклад ІІІ. 1.Обчислити склад рівноважної парової фази за температури 50 °С для рідини, що складається з суміші гексана і води, передбачаючи їх повну взаємну нерозчинність.
Розв’язування. Тиск насиченої пари гексана за температури 50 оС дорівнює 400 мм рт. ст. (рис. 1Д). Тиск насиченої пари води за 50 °С становить
92,5 мм рт. ст. ( табл. 1Д Додатка). У разі повної взаємної нерозчинності компонентів парціальний тиск р кожного з них дорівнює тиску його насиченої пари Р.
Загальний тиск суміші пари:

Мольну частку гексана в паровій фазі знайдемо за рівнянням (І.1):

Мольна частка води:
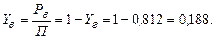
Приклад ІІІ. 2.Визначити температуру кипіння за атмосферного тиску рідкої суміші толуолу і води, враховуючи їх повну взаємну нерозчинність.
Розв’язування.Задана суміш кипітиме за такої температури, за якої сума тиску насиченої пари толуолу і води становитиме 760 мм рт. ст.
З діаграми (рис. 4Д) видно, що перетин кривої тиску насиченої пари толуолу з кривою тиску насиченої пари води (відкладеного від 760 мм рт. ст. зверху вниз) проходить за 84 оС. Оскільки точка перетину цих кривих відповідає такій температурі, за якої сума тисків насиченої пари дорівнює 760 мм рт. ст., то ця температура і буде температурою кипіння суміші.
Приклад ІІІ. 3.Обчислити склад рівноважної парової фази за 60 оС для рідкої суміші, що складається з 40 % (мол.) бензолу і 60 % (мол.) толуолу, вважаючи, що задана суміш характеризується законом Рауля. Знайти також, якого складу рідка суміш бензолу і толуолу кипить за 90 оС під тиском 760 мм рт. ст.
Розв’язування. Тиск насиченої пари бензолу і толуолу за 60 °С визначаємо згідно з рис. 4Д: для бензолу Рб = 385 мм рт. ст.; для толуолу Рт = 140 мм рт. ст.
Парціальний тиск бензолу і толуолу визначаємо за формулою:

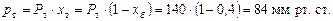
Загальний тиск:

Склад парової фази визначаємо за формулою (І. 1):
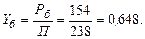
Отже, рівноважна пара містить 64,8 % (мол.) бензолу і 35,2 % (мол.) толуолу.
Для визначення складу рідини, що кипить під тиском 760 мм рт. ст. за 90 °С, напишемо рівняння
 або
або  ,
,
звідки 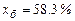 ;
;  .
.
Тут 1013 і 408 – тиск насиченої пари чистих бензолу і толуолу за 90 оС,
мм рт. ст.
Приклад ІІІ. 4. Обчислити рівноважні склади фаз і побудувати діаграми рівноваги в координатах t – x, у і у* – х для бензольно-толуольної суміші за атмосферного тиску, вважаючи, що суміш характеризується законом Рауля.
Розв’язування. Для обчислення рівноважних складів фаз використовуємо рівняння:
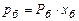 ;
;
 .
.
За законом Дальтона:
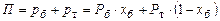 ,
,
звідки

За формулою (І.1а):
 ,
,
де х і у* – мольні частки бензолу в рідині і в рівноважній з нею парі.
Результати розрахунку наведено в табл. ІІІ.1.
Таблиця ІІІ.1
| t, оС | Рб, мм рт. ст. | Рт, мм рт. ст. | П, мм рт. ст. | 
| 
|
| 300,0 | |||||
| 333,0 | 
| 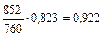
| |||
| 379,5 | 
| 
| |||
| 432,0 | 
| 
| |||
| 492,5 | 
| 
| |||
| 559,0 | 
| 
| |||
| 625,5 | 
| 
| |||
| 704,5 | 
| 
| |||
| 760,0 |
Отримані дані нанесені у вигляді кривих в координатах t – х, y (рис. ІІІ.6) і в координатах y*– х (рис. ІІІ.7).
 | |||
 | |||
| Рис. ІІІ.6 (до прикладів ІІІ.4 і ІІІ.5) | Рис. ІІІ.7 (до прикладу ІІІ.4) |
Приклад ІІІ. 5. За діаграмою t – x, у (рис. ІІІ.6) визначити склад рівноважної пари і температуру кипіння для рідини, що містить 55 % (мол.) бензолу і 45 % (мол.) толуолу.
Розв’язування. Провівши на рис. ІІІ. 6 лінію ABCD, знаходять, що:
а) температура кипіння дорівнює ~ 91 °С
б) склад рівноважної пари:
бензол – 75 % (мол.);
толуол – 25 % (мол.).
Приклад ІІІ. 6. 2500 кг забрудненого скипидару переганяють в потоці насиченої водяної пари за атмосферного тиску (760 мм рт.cт.). Початкова суміш містить 88 % (мас.) скипидару, 12 % (мас.) води і надходить в апарат за 30 оС. Зовнішнього підігрівання немає.
Для перегонки застосовують насичену пару з тиском (в паропроводі) Рабс = 0,15 МПа. Ступінь насичення водяної пари скипидаром j = 0,7.
Визначити: а) витрату пари на перегонку; б) масовий і мольний склад пари, що відганяється; в) парціальний тиск скипидару і води в суміші пари. Втрати тепла у довкілля прийняти у розмірі 10 % від корисно затрачуваного тепла. Розрахункові константи для скипидару: молярна маса – 136 кг/кмоль; питома теплоємність рідкого скипидару – 1,76×103 Дж/(кг×К); питома теплота випаровування –
310×103 Дж/кг.
Розв’язування. Визначаємо за рис. 4Д температуру перегонки і тиск насиченої пари скипидару. Температура перегонки 96 °С; Рск = 115 мм рт. ст.
Кількість водяної пари, що виходить разом з парою скипидару, знаходимо за формулою (ІІІ. 3)
 кг.
кг.
Масова частка в парі:
скипидару:
 ;
;
води:
 .
.
Мольна частка:
 ;
;
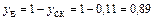 .
.
Парціальний тиск в суміші пари за загального тиску П = 760 мм рт. ст.:


Витрата тепла:
а) на підігрівання початкової суміші від 30 °С до температури перегонки
96 °С.
Скипидар:
 .
.
Вода:
 .
.

б) на випаровування скипидару, що переганяється
 .
.
в) на компенсацію втрат тепла у довкілля

Загальна затрата тепла:
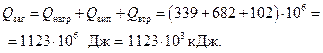
Визначаємо витрату пари. Абсолютному тиску насиченої пари в трубопроводі (1,5 ат) відповідає температура 110,7 оС (табл. 2Д Додатка); виходить зі скипидаром, що переганяється, 2330 кг пари за температури перегонки 96 °С. Отже, ця пара виходить та охолоджується від 110,7 до 96 °С, причому виділяється тепло:

де  – питома теплоємність водяної пари, Дж/(кг×К) – табл. 4Д Додатка.
– питома теплоємність водяної пари, Дж/(кг×К) – табл. 4Д Додатка.
Решта тепла:

повинно бути підведено під час конденсації деякої додаткової кількості пари і охолоджування конденсату, який одержано до температури перегонки.
Витрата гріючої пари, що конденсується:
 кг,
кг,
де  – питома ентальпія насиченої водяної пари за 1,5 кгс/см2;
– питома ентальпія насиченої водяної пари за 1,5 кгс/см2;  – питома ентальпія води за 96 оС.
– питома ентальпія води за 96 оС.
Загальна витрата пари:
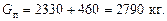
Приклад ІІІ.7. У простому перегонному кубі відбувається розгін суміші, що містить 60 % (мас.) етилового спирту і 40 % (мас.) води. Після відгону в кубовому залишку міститься 5 % (мас.) спирту. Визначити склад дистиляту, його масу та масу кубового залишку. Дані про рівноважні склади наведено в табл. ІІІ.2, в якій  – позначає масову частку етилового спирту в рідині,
– позначає масову частку етилового спирту в рідині,  – масову частку етилового спирту в рівноважній парі.
– масову частку етилового спирту в рівноважній парі.
Таблиця ІІІ.2

| 
| 
| 
|
| 0,025 | 0,225 | 0,200 | 5,00 |
| 0,05 | 0,360 | 0,310 | 3,22 |
| 0,10 | 0,516 | 0,416 | 2,40 |
| 0,15 | 0,600 | 0,450 | 2,22 |
| 0,20 | 0,655 | 0,455 | 2,20 |
| 0,25 | 0,690 | 0,440 | 2,27 |
| 0,30 | 0,710 | 0,410 | 2,44 |
| 0,35 | 0,728 | 0,378 | 2,64 |
| 0,4 | 0,740 | 0,340 | 2,94 |
| 0,45 | 0,754 | 0,304 | 3,29 |
| 0,50 | 0,767 | 0,267 | 3,74 |
| 0,55 | 0,778 | 0,228 | 4,38 |
| 0,60 | 0,789 | 0,189 | 5,29 |
| 0,65 | 0,800 | 0,150 | 6,66 |
| 0,70 | 0,810 | 0,110 | 9,09 |
| 0,75 | 0,835 | 0,085 | 11,75 |
| 0,80 | 0,855 | 0,055 | 18,20 |
Розв’язування.Для розв’язання використовуємо рівняння (ІІІ.1):
 .
.
Аналітично виконати інтегрування неможливо, оскільки аналітична форма залежності  від
від  є невідомою; тому розв’язуємо інтеграл графічно. Для цього будуємо графік залежності
є невідомою; тому розв’язуємо інтеграл графічно. Для цього будуємо графік залежності  від
від  для спиртоводної суміші.
для спиртоводної суміші.
На рис. ІІІ. 8 за даними табл. ІІІ. 2 побудовано криву.
Прийнято масштаб:
На осі абсцис: 1 мм = 0,02.
На осі ординат: 1 мм = 0,2.
1 мм2 = 0,02×0,2 = 0,004.
Значення інтеграла в межах від  до
до 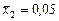 зображено заштрихованою площею. Ця площа дорівнює 403 мм2.
зображено заштрихованою площею. Ця площа дорівнює 403 мм2.
Отже,
 .
.
 Наближено значення інтеграла можна знайти за формулою трапецій.
Наближено значення інтеграла можна знайти за формулою трапецій.
Відповідно:
 ;
;  .
.
За умови, F = 1000 кг. Тоді маса кубового залишку:
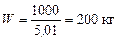 ,
,
тобто маса дистиляту:

Рис. ІІІ.8 (до прикладу ІІІ.7)
Кількість спирту в залишку після перегонки:

Кількість спирту, що перейшов в дистилят:

Масовий відсоток спирту в дистиляті:
 .
.
Приклад ІІІ.8. За умов попереднього прикладу знайти для процесу перегонки витрату гріючої пари (рабс ~ 2 кгс/см2). Суміш для перегонки подається в куб нагрітою до температури початку кипіння. Втрати тепла в довкілля прийняти у розмірі 10 % від кількості корисно затрачуваного тепла. За діаграмою t – х, у знайдено, що температура початку перегонки, коли кипляча суміш містить
60 % (мас.) спирту, дорівнює 81 °С, а температура кінця перегонки, коли кипляча суміш містить 5 % (мас.) спирту, – 94,9 °С. Вологість гріючої пари 5 %.
Розв’язування. Середня температура перегонки:
 оС.
оС.
Витрата тепла на нагрівання початкової суміші від 81 до 88 °С:

де  і
і  Дж/(кг×К) – питомі теплоємності спирту і води (рис. 2Д).
Дж/(кг×К) – питомі теплоємності спирту і води (рис. 2Д).
Витрататепла на випаровування за 88 °С:
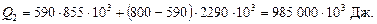
Тут  і
і  Дж/кг– питомі теплоти пароутворення спирту і води.
Дж/кг– питомі теплоти пароутворення спирту і води.
Витрата тепла на нагрівання залишку від 88 до 94,9 °С:

Загальна витрата тепла з урахуванням втрат:

Витрата гріючої пари:
 кг.
кг.
де 2208×103 Дж/кг – питома теплота конденсації водяної пари за рабс = 2 кгс/см2.
Приклад ІІІ.9. Під час розрахунку ректифікаційної колони з ковпачковими тарілками прийнято відстань між тарілками 300 мм. Через колону проходить
3200 м3/год пари. Густина пари 1,25 кг/м3 (витрата і густина пари за нормальних умов). Густина рідини 430 кг/м3. Визначити необхідний діаметр колони, якщо абсолютний тиск в ній 1,2 кгс/см2 і середня температура –40 °С.
Розв’язування. Для визначення діаметра колони необхідно знайти допустиму робочу швидкість пари в ній.
Густина пари за робочих умов:
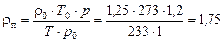 кг/м3.
кг/м3.
За рівнянням (ІІІ. 17а)
 м/с.
м/с.
Значення С = 0,0315 визначено за рис. ІІІ.2.
Об'ємна витрата пари в колоні за робочих умов.
 м3/с
м3/с
Необхідна площа поперечного перетину колони:
 м2.
м2.
Звідки діаметр колони

 м.
м.
За нормалями (Каталог-довідник “Колонні апарати”) приймаємо
D = 1200 мм.
Приклад ІІІ. 10.Визначити кількість тарілок у ректифікаційній колоні безперервної дії для розділення суміші “метиловий спирт – вода” під атмосферним тиском. Вміст метилового спирту в живленні колони 31,5 % (мол.). Дистилят отримують із вмістом спирту 97,5 % (мол.), в кубовому залишку допускається вміст спирту 1,1 % (мол). Коефіцієнт надлишку флегми 1,77. Кількість тарілок є еквівалентною одному ступеню зміни концентрації, що дорівнює 1,7. Колона обігрівається глухою парою.
Розв’язування. За даними табл. 4Д Додатка для суміші “метиловий спирт – вода” за рабс = 760 мм рт. ст. будуємо криву рівноваги в координатах у* – х
(рис. ІІІ.9).
Визначаємо мінімальне флегмове число за формулою (ІІІ.10)
 ,
,
де значення  = 0,675 знайдено за рівноважною кривою (рис. ІІІ.9).
= 0,675 знайдено за рівноважною кривою (рис. ІІІ.9).
Реальне (робоче) флегмове число:
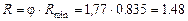 .
.
Рівняння робочої лінії верхньої частини колони:
 ,
,
або
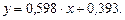
Відкладемо на осі ординат 0,393 і нанесемо робочу лінію АВ для верхньої частини колони. Через точки А і С проводимо робочу лінію для нижньої частини колони.
Виконуючи на діаграмі побудову ламаної лінії (починаючи від точки В), знаходимо необхідну кількість ступенів зміни концентрації: у верхній частині колони вона становить 7, у нижній – 4; разом – 11.

Рис. ІІІ. 9 (до прикладу ІІІ. 10)
Кількість реальних тарілок: у верхній частині колони 1,7 × 7 » 12; в нижній 1,7 × 4 » 7, разом – 19 тарілок.
Приклад ІІІ. 11. Побудувати криву рівноваги для суміші чотирихлористий вуглець ССl4 – двохлориста сірка SCl2 за тиску 760 мм рт. ст.
Розв’язування. За відсутності експериментальних даних криву рівноваги будуємо, виходячи з допущення, що суміш підпорядковується закону Рауля.
Тиск насиченої пари ССl4 залежно від температури наведено в табл. ІІІ.3:
Таблиця ІІІ.3
| t, °С | р, мм рт. ст. | t, °С | р, мм рт. ст. |
Для SCl2 є дві точки: температура кипіння за тиску 760 мм рт. ст., що дорівнює за 59 °С, і температура кипіння за 400 мм рт. ст., що дорівнює 41 °С.
Для знаходження тиску насиченої пари SCl2 за інших температур скористаємося правилом лінійності.
Обчислимо постійну К для SCl2 і води, узятої як стандартна рідина:
 ,
,
де 83 °С – температура кипіння води за 400 мм рт. ст. (табл. 1Д Додатка).
Температури кипіння SCl2 за різних тисків можна визначити з рівняння:

де t – температура кипіння SCl2 , °С; q – температура кипіння води за того самого тиску, °С.
У табл. ІІІ.4 наведено обчислені за останньою формулою значення t за різних тисків.
Таблиця ІІІ.4
| Р, мм рт. ст. | q, °С | t, оС |
| 100,0 | 59,0 | |
| 104,2 | 63,5 | |
| 108,7 | 68,2 | |
| 112,7 | 72,5 | |
| 116,3 | 76,3 | |
| 119,6 | 79,8 |

Рис. ІІІ.10 (до прикладу ІІІ. 11)
На рис. ІІІ.10 за даними табл. ІІІ.3 і ІІІ.4 нанесено тиски насичених парів SCl2 і ССl4 залежно від температури.
Маючи дані про тиск насиченої пари чистих компонентів за різних температур, можна побудувати діаграму рівноваги за законом Рауля. Методику побудови див. у прикладі ІІІ.4. На
рис. ІІІ.11 подано діаграму рівноваги в координатах у*–х.
Приклад ІІІ. 12. В періодично діючій тарілчастій ректифікаційній колоні розділяється під атмосферним тиском рідка суміш чотирихлористого вуглецю ССl4 і двохлористої сірки SCl2. Дистилят повинен містити 90 % (мол.), а кубовий залишок після ректифікації – 15 % (мол.) SCl2.
Визначити необхідну кількість тарілок, якщо на один ступінь зміни концентрації припадає 1,7 тарілки. Визначити також відношення мінімального флегмового числа в кінці і на початку перегонки.
Розв’язування. Скористаємося даними про рівновагу суміші чотирихлористий вуглець – двохлориста сірка, отриманими в попередньому прикладі.
Згідно з формулою (ІІІ. 10), мінімальне флегмове число Rmin для кінцевого моменту перегонки, коли кубова рідина містить 15 % SCl2 (найскладніші умови для розділення):
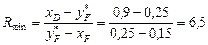 .
.
Тут 0,25 – молярна частка SCl2 в парі, що є рівноважною з кубовим залишком, який містить 15 % SCl2 – визначається за діаграмою рівноваги.
Для дійсного процесу приймаємо флегмове число на 20 % більше за Rmin.
 .
.
Рівняння робочої лінії (ІІІ. 6) для кінцевого моменту перегонки:

або
 .
.
Будуємо робочу лінію і визначаємо графічно кількість ступенів зміни концентрації. Згідно з рис. ІІІ.11, флегмовому числу R=7,8 відповідають 11 ступенів.

Рис. ІІІ. 11 (до прикладів ІІІ. 11 та ІІІ. 12)
Кількість реальних тарілок для ректифікації:
 .
.
Для початкового моменту перегонки, коли xF = 0,5, мінімальне флегмове число:
 ,
,
де  знайдено за діаграмою рівноваги (рис. ІІІ.11).
знайдено за діаграмою рівноваги (рис. ІІІ.11).
Відношення мінімального флегмового числа в кінці та на початку перегонки:
 .
.
Приклад ІІІ.13. Побудувати діаграму І – х в області насичення для суміші СН4 – N2 під рабс = 10 кгс/см2.
Розв’язування.Методику побудови і застосування І – х діаграми див. [6].
Для визначення рівноважних складів системи СН4 – N2 скористаємося експериментальними даними.
За діаграмою стану І – lg р для N2 і СН4 визначаємо ентальпії чистих компонентів на 1 кмоль пари і рідини в межах температур існування системи СН4 – N2 під 10 кгс/см2 (табл. ІІІ.5).
Будуємо сітку діаграми: на осі абсцис відкладаємо вміст N2, на осі ординат – ентальпію в кДж/кмоль (рис. ІІІ.12).
Далі наносимо ентальпії чистих газоподібних N2 і СН4 (табл. ІІІ.5) на осі ординат для температур 170; 160 і 150 К.
З’єднуючи ці точки прямими, отримуємо відповідні ізотерми. Допускаємо, що тепло змішування дорівнює нулю.
Таблиця ІІІ.5
| Т,К | Пара р | Рідина | ||

| 
| 
| 
| |
| кДж/кмоль | кДж/кмоль | кДж/кмоль | кДж/кмоль | |
| 11 100 | ||||
| 10 700 | — | |||
| 10 270 | — | |||
| — | — | |||
| — | — | |||
| — | — | |||
| — | — | |||
| — | — | |||
| — | — | |||
| — | ||||
| — | ||||
| — | — | |||
| — | — | — |
Нижче за температури 150 К газоподібного метану під 10 кгс/см2 не існує. Проте ми екстраполюємо ентальпію СН4 і нижче за цю температуру, вважаючи, що ∆І/∆Т в області екстраполяції має таке саме значення, що і вище 150 К. У результаті одержуємо ізотерми пари аж до 100 К, тобто до температури конденсації чистого азоту під 10 кгс/см2. На рис. ІІІ.12 показано декілька ізотерм пари, побудованих так, починаючи ізотермою 145 К.
Потім, користуючись рівноважними даними для системи СН4 – N2, визначаємо температури початку конденсації різних парових сумішей і наносимо відповідні точки на І – х діаграму. З’єднуючи знайдені точки, одержуємо лінію конденсації.

Рис. ІІІ.12 (до прикладу ІІІ.13)
Ізотерми рідини будуються за таким самим принципом, що і для газу. Побудова ускладнюється тим, що частина температур рівноваги лежить вище за критичну температуру азоту (126 К), внаслідок чого ентальпію рідкого азоту за цих температур зняти не можливо. Тому побудову виконують так: обчислюють середню теплоємність рідкого азоту в інтервалі, наприклад, 110–120 К і вважають, що і надалі за температур вище від критичної, теплоємність азоту в суміші залишається сталою. Частина побудованих таким чином ізотерм рідини на рис. ІІІ.12 показана пунктиром (в області насичення).
Прийняте припущення не може привести до великих помилок, оскільки для ізотерм високих температур (понад 125 К) ці ізотерми перетинаються криву кипіння за великого вмісту метану, ентальпії якого зняті без жодних припущень. Тому відхилення, зумовлене неточністю у визначенні ентальпії азоту, впливає незначно унаслідок малої його частки. Для ізотерм низьких температур (нижче 125 К) ентальпії рідкого азоту зняті без припущень.
За даними фазової рівноваги системи СН4 – N2 наносять на діаграму точки початку кипіння для рідких сумішей різного складу і після з'єднання цих точок отримують лінію кипіння І – х діаграми. В області насичення проводять сполучні ізотерми (сполучають склади рідини на кривій кипіння з рівноважними складами пари на лінії конденсації). На цьому закінчується побудова І – х діаграми.
Приклад ІІІ.14. В ректифікаційну колону безперервної дії подається суміш, що складається з 30 % (мол.) СН4 і 70 % (мол.) N2. Суміш надходить 1000 м3/год в газоподібному стані під рабс = 10 кгс/см2 і за температури насичення. Тут і надалі в цьому прикладі всі об'ємні витрати (в м3/год) вказані за нормальних умов.
Внаслідок розділення в колоні отримано газоподібні продукти: фракція метану з вмістом 3 % N2 і фракція азоту з змістом 5 % СН4.
Необхідно, користуючись І – х діаграмою, визначити:
а) кількість отримуваних фракцій;
б) мінімальне флегмове число  ;
;
в) кількість ступенів зміни концентрації за коефіцієнта надлишку флегми 1,25;
г) кількість тепла, що передається в дефлегматорі колони;
д) кількість тепла, що передається в кубі (у разі винесення з куба колони метанової фракції в рідкому стані).
Розв’язування. Використовуємо діаграму рівноваги системи СН4 – N2 під 10 кгс/см2 в координатах І – х, побудовану в попередньому прикладі ІІІ. 13.
1. Для визначення кількості отримуваної фракції будуємо на діаграмі вгорі (рис. ІІІ.13) пряму лінію ІІІ – І – ІІ; Точка І характеризує початкову суміш (70 % N2), точка ІІ — азотну фракцію (95 % N2) і точка ІІІ – метанову фракцію (3 % N2). Кількість отримуваної метанової фракції на 1 кмоль вихідної суміші, як випливає з рівняння матеріального балансу: 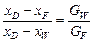 , дорівнює співвідношенню відрізків
, дорівнює співвідношенню відрізків  .
.
Кількість метанової фракції:
 .
.
Кількість азотної фракції:
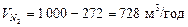 .
.
2. Визначаємо  . Точка М відповідає стану початкової суміші, що надходить на розділення. Вона повинна знаходитися на головній прямій, що з’єднує полюси зміцнювальної та вичерпної частини колони. Для визначення найнижчого положення полюса колони зміцнення
. Точка М відповідає стану початкової суміші, що надходить на розділення. Вона повинна знаходитися на головній прямій, що з’єднує полюси зміцнювальної та вичерпної частини колони. Для визначення найнижчого положення полюса колони зміцнення  , що відповідає
, що відповідає  , необхідно сумістити головну пряму з ізотермою, що проходить через точку М (лінія МО). Продовжуючи цю лінію до перетину з вертикалями, проведеними відповідно до значень концентрацій одержуваних фракцій, знайдемо полюси
, необхідно сумістити головну пряму з ізотермою, що проходить через точку М (лінія МО). Продовжуючи цю лінію до перетину з вертикалями, проведеними відповідно до значень концентрацій одержуваних фракцій, знайдемо полюси  і
і  , які відповідають
, які відповідають  .
.
Відношення відрізків:
 .
.
В нашому випадку:

За умовою, реальне флегмове число:
 .
.
Визначимо положення дійсного полюса  , що відповідає флегмовому числу
, що відповідає флегмовому числу  . Для цього із співвідношення:
. Для цього із співвідношення:

знаходимо величину відрізка О'К':
 ,
,
а потім абсцису точки О':
 .
.
Провівши пряму через точки М і О' до перетину її з вертикалями, абсциси яких  і
і  , отримаємо головну пряму для R = 0,647. Точки перетину головної прямої з вертикалями – дійсні полюси
, отримаємо головну пряму для R = 0,647. Точки перетину головної прямої з вертикалями – дійсні полюси  і
і  .
.
3. Потім графічно визначаємо кількість ступенів зміни концентрації. Для цього знаходимо склад рідини, рівноважний з парою, що містить 95 % N2 (точка N). Це буде точка 1, з’єднана з точкою N ізотермою. Далі проводимо промінь 1 –  . Перетин цього променя з кривою пари дає точку 2.З точки 2повторюємо побудову. Отримавши точку 5 на кривій рідині зліва від головної прямої, подальшу побудову виконуємо за допомогою нижнього полюса
. Перетин цього променя з кривою пари дає точку 2.З точки 2повторюємо побудову. Отримавши точку 5 на кривій рідині зліва від головної прямої, подальшу побудову виконуємо за допомогою нижнього полюса  . Кількість таких переходів дає кількість ступенів зміни концентрації. У результаті одержуємо: в зміцнювальній частині (вище живлення) два ступені (дещо більше); у вичерпній частині (нижче живлення) чотири ступеня (дещо менше).
. Кількість таких переходів дає кількість ступенів зміни концентрації. У результаті одержуємо: в зміцнювальній частині (вище живлення) два ступені (дещо більше); у вичерпній частині (нижче живлення) чотири ступеня (дещо менше).
4. Кількість тепла, що відводиться в дефлегматорі, визначається різницею ентальпій в точках  і N, тобто
і N, тобто
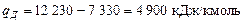 .
.
Оскільки під час розділення виходить 728 м3/год азотної фракції, то загальна кількість тепла, що передається в дефлегматорі:
 .
.

Рис. ІІІ.13 (до прикладу ІІІ.14)
5. Кількість тепла, що передається в кубі колони,  під час відведення фракції метану в газоподібному стані, визначається різницею ентальпій в точках Р і
під час відведення фракції метану в газоподібному стані, визначається різницею ентальпій в точках Р і  . Під час відведення метанової фракції в рідкому стані відсутня витрата тепла на випаровування фракції; в цьому випадку тепло
. Під час відведення метанової фракції в рідкому стані відсутня витрата тепла на випаровування фракції; в цьому випадку тепло  визначається різницею ентальпій в точках L і
визначається різницею ентальпій в точках L і  , що становить 5 150 кДж на 1 кмоль метанової фракції.
, що становить 5 150 кДж на 1 кмоль метанової фракції.
Загальна кількість тепла, що передається в кубі колони:
 .
.
Приклад ІІІ.15. Визначити висоту і діаметр верхньої укріплювальної частини насадкової ректифікаційної колони для розділення суміші метиловий спирт – вода за атмосферного тиску. В колону надходить 1500 кг/год початкової суміші, що містить 40 % спирту і 60 % води. Концентрація дистиляту 97,5 % спирту. В кубовому залишку міститься 2 % спирту (відсотки мольні), флегмове число R = 1,48. Як насадка застосовані кільця 25 × 25 × 3 мм. Колона працює в режимі емульгування. Обігрівання здійснюється глухою парою.
Розв’язування. Під час роботи насадкової ректифікаційної колони в режимі емульгування швидкість пари в ній знаходимо з рівняння (ІІ.15). А = – 0,125.
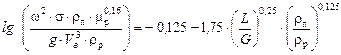 .
.
Тут: s = 204 м2/м3 (табл. 5Д Додатка);
Vв = 0,74 м3/м3 (табл. 5Д Додатка);
Середній склад пари:
 (мол.) спирту,
(мол.) спирту,
rр» 840 кг/м3;
mр» 0,5×10 -3 Па×с;
 .
.
Середній склад пари:
 (мол.) спирту.
(мол.) спирту.
Тут  (мол.) – вміст спирту в парі, що надходить у верхню частину колони (рис. ІІІ.9; у прикладі ІІІ.10 робоча лінія верхньої частини колони займає таке саме положення, як і в цьому прикладі). Середня температура у верхній частині колони ~ 72°С. Маємо:
(мол.) – вміст спирту в парі, що надходить у верхню частину колони (рис. ІІІ.9; у прикладі ІІІ.10 робоча лінія верхньої частини колони займає таке саме положення, як і в цьому прикладі). Середня температура у верхній частині колони ~ 72°С. Маємо:

 .
.
Відношення масових витрат рідини і пари дорівнює (за наближених значень Мп і Мр):
 .
.
Підставляючи ці значення в формулу (ІІ. 15), отримуємо

 ,
,
звідки
 .
.
Еквівалентну висоту насадки 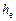 розраховуємо:
розраховуємо:

Згідно з рис. ІІІ.9, кількість ступенів зміни концентрації в межах від х = 0,975 до х = 0,4 становить 6,4 (у разі точнішої побудови в більшому масштабі кількість ступеней зміни концентрації отримуємо дещо більше 7).
Відповідно, необхідна висота насадки:

 м.
м.
Для визначення діаметра колони знайдемо заздалегідь витрату дистиляту. Мольна витрата живлення:
 кмоль/год.
кмоль/год.
З рівнянь матеріального балансу колони:
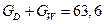

знаходимо витрату дистиляту 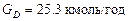 .
.
Об'ємна витрата пари у верхній частині колони:
 м3/с.
м3/с.
Необхідний діаметр колони
 м.
м.
Приклад ІІІ.16. В ректифікаційній колоні безперервної дії розділяється під атмосферним тиском суміш етиловий спирт – вода, що містить 25 % (мол.) етилового спирту. Необхідна концентрація дистиляту 80 % (мол.), вміст спирту в кубовому залишку, що припускається, не вищий від 0,1 % (мол.). У куб колони надходить гостра пара. Визначити робоче флегмове число і відносні мольні витрати живлення, гострої пари і кубового залишку, що надходить на 1 кмоль дистиляту. Нанести робочі лінії на діаграму у – х.
Розв’язування. На рис. ІІІ.14 подано схему матеріальних потоків (відносних мольних витрат) в ректифікаційній колоні, в куб якої надходить гостра пара. За рівнянням матеріального балансу колони:
 ;
;
 ;
;
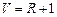 .
.
За  отримуємо:
отримуємо:
 ,
,  .
.
Рівняння робочих ліній:
верхньої частини колони
 ;
;

| 
|
| Рис. ІІІ.14 (до прикладу ІІІ.16) | Рис. ІІІ.15 (до прикладу ІІІ.16) |
нижньої частини колони
 .
.
У цих рівняннях
 ;
;
де  ,
,  ,
, 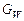 ,
, 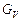 – мольні витрати живлення, дистиляту, кубового залишку, пари, що надходить, кмоль/с.
– мольні витрати живлення, дистиляту, кубового залишку, пари, що надходить, кмоль/с.
Робоча лінія верхньої частини колони така сама, як і під час обігрівання колони глухою парою (див. рівняння (ІІІ.6)); вона перетинає діагональ діаграми у – х за х = хD і вісь ординат за 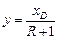 .
.
Робоча лінія нижньої частини колони перетинає вісь абсцис за х = xW. Обидві робочі лінії перетинаються при х = хF.
Крива рівноваги, побудована за даними [4], має западину (рис. ІІІ.15). Для визначення Rminз точкиА проводимо дотичну АВ до кривої рівноваги. Дотична АВ відтинає на осі ординат відрізок, що дорівнює 37,5. Звідси:
 та
та 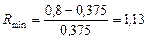 .
.
Робоче флегмове число:
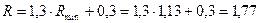 .
.
Відрізок, що відсікається робочою лінією верхньої частини осі ординат при R = 1,77:
 .
.
Наносимо робочі лінії на діаграму – рис. ІІІ. 15 (на рисунку точка xW на осі абсцис нанесена не в масштабі). Знаходимо відносні мольні витрати:
 ;
;
