 |
|
ОСНОВНІ ЗАЛЕЖНОСТІ І РОЗРАХУНКОВІ ФОРМУЛИ ДО РОЗДІЛУ ІІ
У стані рівноваги за сталих температури і загального тиску залежність між парціальним тиском газу 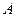 (або його концентрацією) і складом рідкої фази виражається законом Генрі:
(або його концентрацією) і складом рідкої фази виражається законом Генрі:
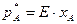 , (ІІ.1)
, (ІІ.1)
або розчинність газу (компоненту 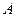 , що поглинається) в рідині за заданої температури є пропорційною до його парціального тиску над рідиною
, що поглинається) в рідині за заданої температури є пропорційною до його парціального тиску над рідиною
 , (ІІ.2)
, (ІІ.2)
де  – парціальний тиск поглинутого газу, який знаходиться в рівновазі з розчином та має концентрацію в ньому
– парціальний тиск поглинутого газу, який знаходиться в рівновазі з розчином та має концентрацію в ньому  (в мольних частках);
(в мольних частках);  – концентрація газу в розчині (в мольних частках), що є рівноважним з газовою фазою, в якій парціальний тиск поглинутого компоненту дорівнює
– концентрація газу в розчині (в мольних частках), що є рівноважним з газовою фазою, в якій парціальний тиск поглинутого компоненту дорівнює  ;
;  – коефіцієнт пропорційності, який називають коефіцієнтом, або константою Генрі.
– коефіцієнт пропорційності, який називають коефіцієнтом, або константою Генрі.
Рівняння залежності  від температури:
від температури:
 , (ІІ.3)
, (ІІ.3)
де  – диференційна теплота розчинення газу;
– диференційна теплота розчинення газу;  – газова стала;
– газова стала;  – стала, що залежить від природи газу та поглинача.
– стала, що залежить від природи газу та поглинача.
Якщо G – витрата інертного газу, кмоль/с; Yп, Yк – початкова і кінцева концентрації абсорбтива в газовій суміші, кмоль/кмоль інертного газу; L – витрата абсорбенту, кмоль/с; Xп, Xк – початкова і кінцева концентрації абсорбтива в абсорбенті, кмоль/кмоль абсорбенту. Тоді рівняння матеріального балансу матиме вигляд
 . (ІІ.4)
. (ІІ.4)
Загальна витрата абсорбенту
 , (ІІ.5)
, (ІІ.5)
а його питома витрата
 . (ІІ.6)
. (ІІ.6)
Значення lmin можна визначити згідно з рівнянням (2.6), змінюючи Xк на 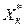 :
:
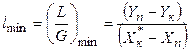 . (ІІ.7)
. (ІІ.7)
Кількість тепла, що виділяється під час абсорбції, становить
 , (ІІ.8)
, (ІІ.8)
де q – диференційна теплота розчинення (у дж/кг), тобто кількість тепла, що виділяється при поглинанні 1 кг компонента в розчині цієї концентрації; М – кількість поглинутого компонента, кг/с.
Якщо абсорбція ведеться без відведення тепла, можна вважати, що усе тепло, яке виділяється, йде на нагрівання рідини:
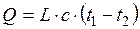 . (ІІ.9)
. (ІІ.9)
Висоту Н абсорбера розраховують за загальним рівнянням масоперенесення. Наприклад, якщо рушійна сила виражена в концентраціях газової фази, то
 , (ІІ.10)
, (ІІ.10)
де М – кількість газу, що поглинається; Ку – коефіцієнт масоперенесення; а – питома поверхня контакту фаз; S – площа перетину колони; ΔYсер – середня рушійна сила процесу.
Значення гідравлічного опору Δрпл розраховують за рівнянням:
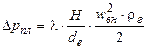 , (ІІ.11)
, (ІІ.11)
де Н – висота поверхні, якою стікає плівка, м; de – еквівалентний діаметр каналу, по якому рухається газ, м; wвн=w+wр.ср – відносна швидкість газу (при протитечії), м/с; wр.ср – середня швидкість руху плівки рідини, м/с; ρг – густина газу, кг/м3; λ — коефіцієнт опору тертю.
Коефіцієнт опору λ залежить від величини критерію Рейнольдса для газу Reг і безрозмірного комплексу величин  , де μр — в'язкість рідини і σ – її поверхневий натяг. Величину λ розраховують за рівняннями:
, де μр — в'язкість рідини і σ – її поверхневий натяг. Величину λ розраховують за рівняннями:
У разі Reг<Reг.кр:  (ІІ.12)
(ІІ.12)
У разі Reг>Reг.кр:  , (ІІ.13)
, (ІІ.13)
де  – критерій Рейнольдса для газу; Rег.кр – критичне значення критерію Рейнольдса з урахуванням впливу на режими руху газового потоку швидкості руху і фізичних властивостей рідкої плівки.
– критерій Рейнольдса для газу; Rег.кр – критичне значення критерію Рейнольдса з урахуванням впливу на режими руху газового потоку швидкості руху і фізичних властивостей рідкої плівки.
Значення Rег. кр визначається за залежністю:
 . (ІІ.14)
. (ІІ.14)
Швидкість газу wз, що відповідає початку захлинання, можна знайти за рівнянням:
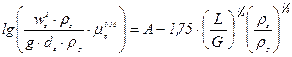 , (ІІ.15)
, (ІІ.15)
де ρр – густина рідини, кг/м3; μр – в’язкість рідини, Па·с; L′ і G′ — витрати рідини і газу, кг/сек.
Рівняння (ІІ.15) за структурою є загальним для плівкових і насадкових абсорберів і відрізняється тільки величиною А. У цьому разі:
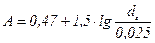 . (ІІ.16)
. (ІІ.16)
Висота труб Н в трубчастому абсорбері дорівнює
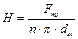 , (ІІ.17)
, (ІІ.17)
де Fтр — внутрішня поверхня всіх труб, м2; dвн — внутрішній діаметр труби, м.
Нехтуючи товщиною плівки, що стікає, можна прийняти, що Fтр=F – поверхні контакту фаз. Тоді
F=n·π·dвн·H. (ІІ.18)
Підставляючи замість F її вираження з рівняння масоперенесення, одержують
 . (ІІ.19)
. (ІІ.19)
Під час розрахунку коефіцієнта масоперенесення Ку (абоКх) коефіцієнт масовіддачі у газовій фазі βг можна визначити за рівнянням:
 , (ІІ.20)
, (ІІ.20)
де λ — коефіцієнт опору тертя.
Відповідно висота одиниці перенесення для газової фази:
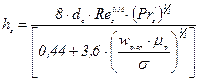 . (ІІ.20а)
. (ІІ.20а)
У рівняннях (ІІ.20) і (ІІ.20а):  – дифузійний критерій Нуссельта (Dг — коефіцієнт молекулярної дифузії у газовій фазі, м2/с);
– дифузійний критерій Нуссельта (Dг — коефіцієнт молекулярної дифузії у газовій фазі, м2/с);  – дифузійний критерій Прандтля.
– дифузійний критерій Прандтля.
Коефіцієнт масовіддачі в рідкій фазі βр можна розрахувати за рівнянням:
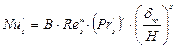 , (ІІ.21)
, (ІІ.21)
де  – дифузійний критерій Нуссельта для рідкої плівки; de=4δ – еквівалентний діаметр рідкої плівки;
– дифузійний критерій Нуссельта для рідкої плівки; de=4δ – еквівалентний діаметр рідкої плівки; 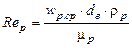 – критерій Рейнольдса для рідкої плівки;
– критерій Рейнольдса для рідкої плівки;  – дифузійний критерій Прандтля для рідини;
– дифузійний критерій Прандтля для рідини;
Dp – коефіцієнт молекулярної дифузії в рідкій фазі; δпр – приведена товщина плівки.
Для розрахунку гідравлічного опору насадкового апарата, попередньо визначається опір сухої насадки (н/м2)
 , (ІІ.22)
, (ІІ.22)
де Н — висота насадки, м; de еквівалентний діаметр насадки (ε — вільний об’єм насадки, м3/м3, а — питома поверхня насадки, м2/м3), м; w=w0/ε — дійсна швидкість газу в шарі насадки (wо — фіктивна швидкість газу, тобто швидкість газу, віднесена до всього перетину колони), м/с; λ — коефіцієнт опору, який враховує сумарні втрати тиску на тертя і місцеві опори.
Значення коефіцієнта опору λ для різних насадок визначається за емпіричними рівняннями. Так, для безладно засипаних кільцевих насадок знаходять:
у разі ламінарного режиму руху газу (Rег < 40): 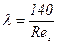 ; (ІІ.23)
; (ІІ.23)
під час турбулентного режиму руху газу (Rег > 40):  , (ІІ.24)
, (ІІ.24)
де 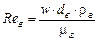 – критерій Рейнольдса для газу (ρг і μг — густина і в'язкість газу).
– критерій Рейнольдса для газу (ρг і μг — густина і в'язкість газу).
Для наближеного розрахунку величини Δрзр під час роботи колони в режимах нижче від точки інверсії можна використовувати емпіричне рівняння:
 , (ІІ. 25)
, (ІІ. 25)
де U – густина зрошення, м3/(м2×с); b – дослідний коефіцієнт, значення якого наводяться в спеціальній літературі.
В абсорберах, що працюють у режимах нижче від точки інверсії, визначають коефіцієнт змочування насадки:
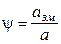 .
.
Коефіцієнт змочування насадки можна знайти за рівнянням
 . (ІІ.26)
. (ІІ.26)
У цьому рівнянні показник ступеня 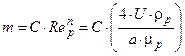 , де ρр і μр – густина і в'язкість рідини. Значення сталих А, С і п наводяться в літературі (наприклад, для кілець розмірами 15—35 мм: А = 1,02, С = 0,16, п = 0,4).
, де ρр і μр – густина і в'язкість рідини. Значення сталих А, С і п наводяться в літературі (наприклад, для кілець розмірами 15—35 мм: А = 1,02, С = 0,16, п = 0,4).
Робочу висоту абсорбера (висоту шару насадки) oдержують за допомогою рівняння
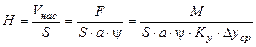 . (ІІ.27)
. (ІІ.27)
Під час розрахунку коефіцієнта масоперенесення Ку або Кx коефіцієнт масовіддачі βг у газовій фазі для невпорядковано завантажених насадок можна визначити за рівнянням
 . (ІІ.28)
. (ІІ.28)
Відповідно висота одиниці перенесення для газової фази
 . (ІІ.29)
. (ІІ.29)
Для регулярних насадок
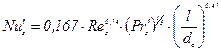 (ІІ.30)
(ІІ.30)
або
 , (ІІ.30а)
, (ІІ.30а)
де l – висота елемента насадки, м.
У рівняннях (ІІ.28) – (ІІ.30) у критеріях  і
і  за визначальний геометричний розмір прийнятий еквівалентний діаметр насадки de = 4ε/a.
за визначальний геометричний розмір прийнятий еквівалентний діаметр насадки de = 4ε/a.
Для кільцевої насадки коефіцієнт масовіддачі в рідкій фазі, віднесений до одиниці повної геометричної поверхні насадки, можна визначити за рівнянням
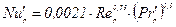 (ІІ.31)
(ІІ.31)
у якому критерій  розрахований за приведеною товщиною плівки.
розрахований за приведеною товщиною плівки.
Відповідно
 (ІІ.31а)
(ІІ.31а)
Значення гідравлічного опору Δрт барботажних тарілок розраховують як суму трьох часткових опорів:
Δрт = Δрс.т + Δрσ + Δрг-р, (ІІ.32)
де Δрс.т – опір сухої тарілки; Δрσ – опір, зумовлений силами поверхневого натягу рідини; Δрг-р — опір газорідинного шару на тарілці.
Значення Δрс.т визначають за рівнянням
 , (ІІ.33)
, (ІІ.33)
в якому 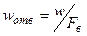 – швидкість газу в отворах тарілки.
– швидкість газу в отворах тарілки.
Втрати тиску Δрσ на подолання сил поверхневого натягу рідини σ на вході в шар рідини на тарілці:
 . (ІІ.34)
. (ІІ.34)
Гідравлічний опір газорідинного шару на тарілці Δрг-р приймають таким, що дорівнює статичному тиску шару:
Δрг-р = h0 ∙ ρp ∙ g = hг-р ∙ ρг-р ∙ g , (ІІ.35)
де h0 і hг-р – висота рідини і газорідинного шару на тарілці; ρр і ρг-р – густина рідини і газорідинної суміші на тарілці.
Для провальних, сітчастих і клапанних тарілок величину hг-р можна розрахувати за рівнянням:
 , (ІІ.36)
, (ІІ.36)
де 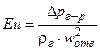 – критерій Ейлера;
– критерій Ейлера; 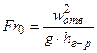 – критерій Фруда.
– критерій Фруда.
Для сітчастих тарілок величину винесення рідини (в кг/кг газу) можна знайти за рівнянням
 (ІІ.37)
(ІІ.37)
де σ – поверхневий натяг рідини, Мн/м.
Кількість одиниць перенесення на тарілку (nг або np) в тарілчастих абсорберах виражається в такий спосіб:
для газової фази
 ; (ІІ.38)
; (ІІ.38)
для рідкої фази
 . (ІІ.39)
. (ІІ.39)
Коефіцієнти масовіддачі βг,SТ і βр,SТ , віднесені до одиниці робочої площі SТ тарілки, зв’язані з поверхневими коефіцієнтами масовіддачі βг i βp співвідношеннями:
для газової фази
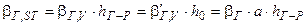 ; (ІІ.40)
; (ІІ.40)
для рідкої фази
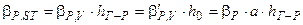 , (ІІ.41)
, (ІІ.41)
де β’г,V і β’р,V — коефіцієнти масовіддачі в газовій і рідкій фазах, віднесені до об’єму рідини на тарілці.
Для ковпачкових тарілок кількість одиниць перенесення в газовій фазі nг можна визначити за рівнянням:
 , (ІІ.42)
, (ІІ.42)
де 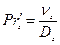 – дифузійний критерій Прандтля для газу; νг – кінематична в'язкість газу, м2/с; Dг – коефіцієнт молекулярної дифузії в газі, м2/с; hпер – висота переливної перегородки, м; q — витрата рідини, віднесена до периметра зливальної перегородки, м3/(м∙ с).
– дифузійний критерій Прандтля для газу; νг – кінематична в'язкість газу, м2/с; Dг – коефіцієнт молекулярної дифузії в газі, м2/с; hпер – висота переливної перегородки, м; q — витрата рідини, віднесена до периметра зливальної перегородки, м3/(м∙ с).
Відповідне рівняння для розрахунку кількості одиниць перенесення в рідкій фазі np має вигляд:
 . (ІІ.43)
. (ІІ.43)
Тут Dp – коефіцієнт дифузії в рідкій фазі, м2/с; τp – середня тривалість контакту фаз (с), яку знаходять за рівнянням:
 , (ІІ.44)
, (ІІ.44)
де lт – довжина шляху рідини, тобто відстань між зливальними перегородками, м; qcp – лінійна густина зрошування, віднесена до середньої ширини тарілки, м3/(м∙ с).
У разі застосування сітчастих (переливних) і провальних тарілок маємо:
для газової фази
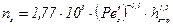 ; (ІІ.45)
; (ІІ.45)
для рідкої фази
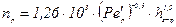 , (ІІ.46)
, (ІІ.46)
де  – дифузійний критерій Пекле для газової фази;
– дифузійний критерій Пекле для газової фази;  – дифузійний критерій Пекле для рідкої фази; hг-р – висота газорідинної суміші на тарілці, м.
– дифузійний критерій Пекле для рідкої фази; hг-р – висота газорідинної суміші на тарілці, м.
Висота тарілчастого Н абсорбера (в м)
Н = nд∙Нт + hв = nд ∙ (hг-р + Нсп)+hв, (ІІ.47)
де Нсп – висота сепараційного простору, м; hв – відстань від верхньої тарілки до кришки абсорбера (м), яке приймається на підставі конструктивних міркувань.
ПРИКЛАДИ
Приклад ІІ.1.Аміак поглинається водою із повітря з початковим вмістом NH3 5% (об’ємних), кінцевий вміст NH3 в повітрі 0,27 % (об’ємних). Кількість повітря, що надходить, 10000 м3/год (за нормальних умов). Загальний тиск повітря 760 мм.рт.ст. Вміст NH3 у воді, що надходить на абсорбцію, 0,2% (масових), питома витрата поглинача l = 1,18 кг/кг. Визначити кількість поглинутого аміаку, кінцеву концентрацію його у воді і побудувати робочу лінію цього процесу абсорбції.
Розв’язування. Кількість повітря становить (за нормальних умов):

або
 ,
,
де 1,29 – густина повітря за нормальних умов, кг/м3.
Відносні масові склади газової фази визначаємо за формулою:
 ,
,
замінивши в ній величини тиску на пропорціональні їм об’ємні вмісти:
на вході
 ;
;
на виході
 ю
ю
Кількість поглинутого аміаку становить:
 .
.
Визначаємо витрату води:
 .
.
Концентрація аміаку у воді, що надходить на абсорбцію, становить (у відносних масових одиницях):
 .
.
Кінцеву концентрацію аміаку у воді, що поглинає, визначаємо за рівнянням:
 .
.
Рівняння робочої лінії:
 .
.
Для побудови робочої лінії на  – діаграмі проводимо пряму лінію через точку А (
– діаграмі проводимо пряму лінію через точку А ( 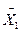 = 0,0268,
= 0,0268,  = 0,0309) і точку В (
= 0,0309) і точку В (  = 0,002,
= 0,002, 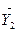 = 0,0016) (див. рис. ІІ.1).
= 0,0016) (див. рис. ІІ.1).
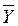


Рис. ІІ.1. Робоча і рівноважна лінія процесу абсорбції (до прикладів ІІ.1 і ІІ.2)
Приклад ІІ.2. Побудувати лінію рівноваги процесу поглинання аміаку в умовах попередньої задачі. Якщо температура води, що надходить, t2 = 20 ºС, а коефіцієнт пропорційності ψ виражений формулою 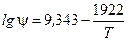 , де ψ – в мм.рт.ст, Т – температура розчину, ˚К.
, де ψ – в мм.рт.ст, Т – температура розчину, ˚К.
Диференційна теплота розчинення NH3 у воді Ф = 2070·103 Дж/кг.
Розв’язування. Приймаючи теплоємність води с = 4190 Дж/(кг·град), знаходимо температуру рідини:
 ,
,
де 0,002 – вміст NH3 у воді, що надходить на абсорбцію ( 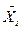 ) (див. задачу ІІ.1).
) (див. задачу ІІ.1).
Задаючись декількома значеннями  , знаходимо температуру t і розраховуємо відповідні величини ψ. Потім знаходимо значення р* і визначаємо
, знаходимо температуру t і розраховуємо відповідні величини ψ. Потім знаходимо значення р* і визначаємо  * за залежністю
* за залежністю
 ,
,
де 17 і 29 – молекулярні маси NH3 і повітря.
Результати розрахунку зведені в табл. ІІ.1.
Таблиця ІІ.1
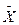
| 0,002 | 0,005 | 0,01 | 0,015 | 0,02 | 0,025 | 0,03 | 0,035 |
t, ˚С
ψ, мм. рт. ст.
p*, мм. рт. ст.
 * *
| 1,2 0,0009 | 21,5 3,3 0,0025 | 7,4 0,0057 | 26,4 12,8 0,0097 | 28,9 18,9 0,0147 | 31,4 26,6 0,0212 | 33,9 0,0284 | 35,3 0,037 |
Приклад ІІ.3. Визначити мінімальну питому витрату поглинача під час абсорбції аміаку водою із умови задачі ІІ.1.
Розв’язування.На  – діаграмі (див. рис. ІІ.1) будуємо точку В з координатами (
– діаграмі (див. рис. ІІ.1) будуємо точку В з координатами (  = 0,002,
= 0,002, 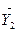 = 0,0016) і точку А` на лінії рівноваги з координатою
= 0,0016) і точку А` на лінії рівноваги з координатою 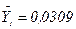 . Абсциса точки А` буде
. Абсциса точки А` буде  .
.
Мінімальна питома витрата поглинача становить:
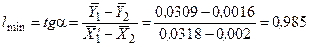 .
.
Приклад ІІ.4.Визначити швидкість газу, що відповідає початку підвисання рідини в колоні з насадкою з правильно вкладених кілець розміром 50х50х5 мм. Витрата газу G = 12300 кг/год, витрата рідини L = 14500 кг/год. Температура газу 25° С.
Розв’язування.Для правильно укладених кілець вказаного розміру знаходимо за табл. 2.1 а = 110 м2/м3, ε = 0,735. Еквівалентний діаметр насадки визначаємо за формулою
 .
.
Визначаємо критерій Архімеда:
 ,
,
де ρг – густина газу (повітря) за 25 ˚С (1,16 кг/м3); ρр – густина рідини (води) за 25˚С (1000 кг/м3); μг – в’язкість газу (повітря) за 25˚С (0,185∙10-4 Н∙с/м2);
Знаходимо значення Reг’ за залежністю  , замінюючи в ній відношення
, замінюючи в ній відношення  на відношення
на відношення  :
:
 .
.
Фіктивну швидкість газу w0’, що відповідає початку підвисання рідини, обчислюємо за залежністю
 .
.
Приклад ІІ.5.Визначити опір шару насадки, яка впорядковано укладена з кілець Рашига розміром 50х50х5 мм. Висота насадки Н=11,5 м, густина зрошування U=7,2 м3/м2∙год. Масова швидкість газу Wг=1,7 кг/м2∙с, температура газу 25˚С.
Розв’язування.Знаходимо критерій Рейнольдса для газу за формулою
 ,
,
де а – питома поверхня кілець насадки (110 м2/м3, табл. ІІ.1); μг – в’язкість газу (повітря) за 25 ˚С (0,185·10-4 н·с/м2).
Коефіцієнт опору визначаємо за формулою
 .
.
Опір сухої насадки знаходимо за формулою:
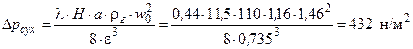 ,
,
де ρг – густина газу (повітря) за 25˚С (1,16 кг/м3); ε – вільний об’єм насадки (0,735, табл. 2.1); w0 – фіктивна швидкість газу.

Опір зрошувальної насадки розраховуємо за формулою:
 ,
,
де k – дослідний коефіцієнт (для впорядковано укладених кільцевих насадок k = 0,04).
Приклад ІІ.6.Визначити розміри і опір ковпачкової тарілки за таких умов: діаметр колони D = 1 м, швидкість газу у вільному перетині w = 1,1 м/с, густина газу ρг = 0,65 кг/м3, густина рідини (вода) ρр = 1000 кг/м3, об’ємна витрата рідини Vр = 7,5 м3/год.
Розв’язування.Вибір кількості ковпачків. Площа перерізу колони становить
 .
.
Приймаючи живий перетин φ=0,1, знаходимо загальну площу перерізу патрубків:
 .
.
Вибираємо круглі ковпачки. За стандартних патрубків внутрішнім діаметром dп=62 мм (рис. 2.26) площа перетину одного патрубка становитиме:
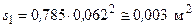 .
.
Кількість патрубків і ковпачків:
 .
.
Розташування ковпачків приймаємо пк=27.
Визначення розмірів ковпачка. Площа між верхнім краєм газового патрубка і ковпачком s2 дорівнює:
 ,
,
де h – відстань по вертикалі від верхнього обрізу патрубка до ковпачка
Із умови s1 =s2 знаходимо
 .
.
Площа кільцевого простору між газовим патрубком і ковпачком s3 становить:
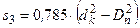 ,
,
де dк – внутрішній діаметр ковпачка; Dп – зовнішній діаметр патрубка.
Із умови s1 =s3 находимо (за Dп=70 мм):
 .
.
Вибираємо ковпачки з внутрішнім діаметром 92 мм і зовнішнім діаметром Dк = 100 мм. Прорізи – прямокутні, шириною b = 8 мм, висотою l = 15 мм. (рис. ІІ.2). Площа перетину одного прорізу:
 .
.
Із умови s1 = sк, де sк – площа перетину прорізів одного ковпачка, знаходимо кількість прорізів в ковпачку:
 .
.

Рис. ІІ.2. Визначення геометричних розмірів
ковпачка (до прикладу ІІ.6)
Загальна ширина прорізів в одному ковпачку становить 25·8 = 200 мм, периметр ковпачка дорівнює 3,14·100 = 314 мм. Отже, відстань між прорізями становить
 ,
,
що можна вважати достатнім (якщо за розрахунком ця відстань є дуже малою, то необхідно збільшити висоту прорізів).
Визначення швидкості газу в прорізах. Фактичний живий перетин в прорізах ковпачків на одній тарілці становить:
 ,
,
звідси
 .
.
Швидкість газу в прорізах визначаємо за формулою
 .
.
Знаходимо швидкість, яка відповідає повному відкриттю прорізів, за ζ = 5 і а = 1
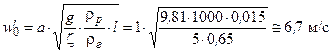 .
.
Отже, прийнятий живий перетин достатньо забезпечує повне відкриття прорізів.
Визначення опору тарілки. Опір сухої тарілки за ζ = 5 знаходимо за формулою:
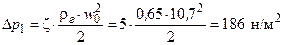
Приймаємо відстань від верхнього краю прорізів до зливного порогу е=20 мм і периметр (ширину) зливної перегородки П = 0,6 м. Висоту рівня рідини над зливним порогом за k = 0,5 визначаємо за формулою
 .
.
Опір стовпа рідини:
 .
.
Еквівалентний діаметр прорізу (за повного його відкриття) становить:
 .
.
Опір, зумовлений силами поверхневого натягу, визначаємо, приймаючи для води σ = 73·10-3 н/м:
 .
.
Загальний опір тарілки становить
 .
.
Приклад ІІ.7.Визначити витрату сірчаної кислоти для сушіння повітря за таких даних. Продуктивність скрубера 500 м3/год (в перерахунку на сухе повітря за нормальних умов). Початковий вміст вологи у повітрі 0,016 кг/(кг сухого повітря), кінцевий вміст 0,0006 кг/(кг сухого повітря). Початковий вміст води в кислоті 0,6 кг/(кг моногідрату), кінцевий вміст 1,4 кг/(кг моногідрату). Сушіння повітря здійснюється за атмосферного тиску.
Розв’язування. Масова витрата повітря, %
 ,
,
де 1,293 кг/м3 – густина повітря за нормальних умов.
Витрата сірчаної кислоти (моногідрату):
 .
.
Приклад ІІ.8.Скрубер для поглинання пари ацетону з повітря зрошується водою в кількості 3000 кг/год. Середня температура в скрубері 20 ˚С. Через скрубер пропускається під атмосферним тиском суміш повітря з парою ацетону, яка містить 6% (об.) ацетону. Чистого повітря в цій суміші міститься 1400 м3/год (в перерахунку на нормальні умови). В скрубері вловлюється 98 % ацетону. Рівняння лінії рівноваги  . Знайти діаметр і висоту скрубера, заповненого керамічними кільцями розміром 25х25х3 мм. Швидкість газу прийняти на 25 % меншою від швидкості захлинання. Коефіцієнт масоперенесення:
. Знайти діаметр і висоту скрубера, заповненого керамічними кільцями розміром 25х25х3 мм. Швидкість газу прийняти на 25 % меншою від швидкості захлинання. Коефіцієнт масоперенесення:
 . Коефіцієнт змочуваності насадки прийняти таким, що дорівнює одиниці.
. Коефіцієнт змочуваності насадки прийняти таким, що дорівнює одиниці.
Розв’язування. Кількість ацетону, що поглинається:
 ,
,
де сп= 0,98 – ступінь поглинання.
Початкова концентрація ацетону у воді, що подається на верх скрубера,
Хв= 0.
Кінцева концентрація ацетону у воді, що витікає знизу із скрубера:
 .
.
Початкова концентрація ацетону в повітрі внизу на вході в скрубер:
 .
.
Кінцева концентрація ацетону в повітрі, що виходить із скрубера:
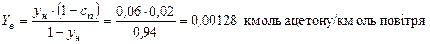 .
.
Розраховані точки є координатами робочої лінії. Якщо рівноважна лінія описується рівнянням  , то рушійну силу можна розрахувати аналітично:
, то рушійну силу можна розрахувати аналітично:
Знаходимо рушійну силу абсорбції внизу скрубера:
 .
.
Значення  знаходимо за рівнянням рівноважної лінії для Хн, що відповідає низу скрубера
знаходимо за рівнянням рівноважної лінії для Хн, що відповідає низу скрубера
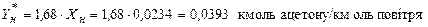 .
.
Рушійна сила вгорі скрубера:
 .
.
Середня рушійна сила:
 .
.
Необхідну поверхню масоперенесення знаходимо за формулою
 .
.
Об’єм шару керамічних кілець, який є необхідним для створення знайденої поверхні, за ψ = 1:
 ,
,
де σ = 204 м2/м3 – питома поверхня насадки (табл. 2.1)
Визначаємо переріз скрубера.
Для цього визначимо фіктивну швидкість газу в точці інверсії, нехтуючи невеликим вмістом ацетону в рідині і газі за формулою:
 ,
,
де g – прискорення вільного падіння, м/с2; VВ = 0,74 (табл. 2.1) – вільний об’єм насадки, м3/м3; ρг= 1,2 кг/м3– густина газу; ρр=1000 кг/м3– густина рідини; μр = 1 мПа∙с – динамічний коефіцієнт в’язкості рідини; L=3000/3600 – масова витрата рідини, кг/с.
 – масова витрата газу, кг/с; А = 0,022 – для насадки з кілець.
– масова витрата газу, кг/с; А = 0,022 – для насадки з кілець.
Підставляємо ці значення у формулу:
 ,
,
або
 ,
,
звідси w0 = 1,56 м/с.
За умовою приймаємо робочу фіктивну швидкість газу w на 25% менше:
 .
.
Площа поперечного перетину скрубера:
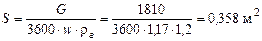
Звідси діаметр скрубера:
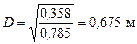 .
.
Необхідна висота насадки:
 .
.
Приклад ІІ.9.У скрубері аміак поглинається водою з газу під атмосферним тиском. Початковий вміст аміаку в газі 0,03 кмоль / кмоль інертного газу. Ступінь вилучення дорівнює 90 %. Вода, що виходить із скрубера, містить аміаку 0,02 кмоль / кмоль води. Введенням теплоти в скрубері підтримується постійна температура.
Дані про рівноважні концентрації аміаку в рідині і газі за температури поглинання наведені в табл. ІІ.2.
Таблиця ІІ.2
| Х, кмоль аміаку кмоль води | 0,005 | 0,010 | 0,0125 | 0,015 | 0,020 | 0,023 | |
| Y*, кмоль аміаку кмоль інертного газу | 0,0045 | 0,0102 | 0,0138 | 0,0183 | 0,0273 | 0,0327 |
Визначити необхідну кількість одиниць перенесення п0у графічною побудовою.
Розв’язування.За даними табл. ІІ.2 на рис. ІІ.3 побудовано рівноважну лінію АВ. На цьому ж графіку нанесено робочу лінію CD. Вона проходить через точку С з координатами ХВ = 0; YВ = 0,03 ∙ (1 – 0,9) = 0,003 (верх скрубера) і точку D з координатами ХН = 0,02; YН = 0,03 (низ скрубера).
Кількість одиниць перенесення п0у знаходимо так. Відрізки ординат між робочою і рівноважною лініями розділені навпіл; через середини їх проведено допоміжну пунктирну лінію. Потім, починаючи від точки С, побудова виконана так, що для кожного ступеня аb = bс. Кожен з отриманих ступенів є одиницею перенесення, тобто для кожного ступеня відповідає така ділянка апарата, на якому зміна робочої концентрації (Y1 – Y2) дорівнює середній рушійній силі на цій ділянці (Y – Y*)cр.
Разом отримано 5,82 ступенів (останній неповний ступінь дорівнює відношенню відрізків Dd/ef = 0,82)
п0у = 5,82.

Рис. ІІ.3. Визначення кількості одиниць перенесення
графічною побудовою (до прикладу ІІ.9)
Згідно з графіком, на нижній ділянці кривої рівноваги, де її нахил є меншим від нахилу робочої лінії, одиниця перенесення є меншою від ступеня зміни концентрації; на верхній ділянці рівноважної лінії, де її нахил є більшим від нахилу робочої лінії, спостерігається обернена картина.
КОНТРОЛЬНІ ЗАДАЧІ
ІІ.1. Визначити коефіцієнт масоперенесення у зрошуваному водою абсорбері, у якому βу = 2,76∙10-3 кмоль/(м2∙год∙кПа), а βх = 1,17∙10-4 м/с. Тиск в апараті рабс=1,07 кгс/см2. Рівняння лінії рівноваги у мольних частках: у* = 102 ∙ х.
ІІ.2. Визначити середню рушійну силу і загальну кількість одиниць перенесення п0у під час поглинання з газу пари бензолу маслом. Початкова концентрація бензолу в газі 4% (об.); вловлюється 80 % бензолу. Концентрація бензолу в маслі, що виходить зі скрубера, 0,02 кмоль бензолу/(кмоль чистого масла). Масло, що надходить в скрубер, бензолу не містить. Рівняння рівноважної лінії у відносних мольних концентраціях: Y* = 0,126∙Х. Рушійну силу подати в одиницях концентрації Y (кмоль бензолу / кмоль інертного газу).
ІІ.3. У скрубері поглинається водою діоксид сірки з інертного газу (азоту) під атмосферним тиском (760 мм рт. ст.). Початковий вміст діоксиду сірки в газі 5% (об.). Температура води 20 °С, її витрата на 20 % більша від теоретично мінімальної. Вилучається з газу 90% SO2. Визначити: 1) витрату води на поглинання 1000 кг/год сірчистого газу; 2) середню рушійну силу процесу;
3) загальну кількість одиниць перенесення п0у. Лінію рівноваги можна прийняти за пряму; координати двох її точок: 1) парціальний тиск SO2 у газовій фазі р =
= 39 мм рт. ст.,  = 0,007 кг SO2/кг води; 2) р = 26 мм рт. ст.,
= 0,007 кг SO2/кг води; 2) р = 26 мм рт. ст.,  = 0,005 кг SO2/кг води.
= 0,005 кг SO2/кг води.
ІІ.4. У насадковому абсорбері відбувається поглинання парів метилового спирту водою з газу під атмосферним тиском за середньої температури 27 °С. Вміст метилового спирту в газі, що надходить у скрубер, 100 г на 1 м3 інертного газу (враховуючи об’єм газу за робочих умов). На виході зі скрубера вода має концентрацію 67% від максимально можливої, тобто від рівноважної з вхідним газом. Рівняння розчинності метилового спирту у воді у відносних мольних концентраціях: 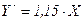 . Вилучається водою 98% від вихідної кількості спирту. Коефіцієнт масоперенесення: Кх = 0,5 кмоль спирту /(м2∙год∙(кмоль спирту /кмоль води)). Витрата інертного газу 1200 м3/год (за робочих умов). Абсорбер заповнений насадкою з керамічних кілець з питомою поверхнею 190 м2/м3. Коефіцієнт змочування насадки ψ = 0,87. Фіктивна швидкість газу в абсорбері w = = 0,4 м/с. Визначити витрату води і необхідну висоту шару насадки.
. Вилучається водою 98% від вихідної кількості спирту. Коефіцієнт масоперенесення: Кх = 0,5 кмоль спирту /(м2∙год∙(кмоль спирту /кмоль води)). Витрата інертного газу 1200 м3/год (за робочих умов). Абсорбер заповнений насадкою з керамічних кілець з питомою поверхнею 190 м2/м3. Коефіцієнт змочування насадки ψ = 0,87. Фіктивна швидкість газу в абсорбері w = = 0,4 м/с. Визначити витрату води і необхідну висоту шару насадки.
ІІ.5. У скрубер діаметром 0,5 м надходить 550 м3/год (за 760 мм рт. ст. і
20 °С) повітря, що містить 2,8% (об.) аміаку, який поглинається водою під атмосферним тиском. Ступінь вилучення аміаку 0,95. Витрата води є на 40% більшою від теоретично мінімальної. Визначити: 1) витрату води; 2) загальну кількість одиниць перенесення п0у; 3) висоту шару насадки з керамічних кілець 50х50х5 мм. Коефіцієнт масоперенесення: Ку = 0,001 кмоль аміаку / (м2∙с∙(кмоль аміаку/кмоль повітря)). Дані про рівноважні концентрації рідини і газу взяти з табл. 2.3. Коефіцієнт змочуваності насадки ψ = 0,9.
ІІ.6. Повітря з домішками аміаку пропускається крізь зрошуваний водою скрубер, заповнений насадкою з кілець з питомою поверхнею 89,5 м2/м3. Вільний об’єм насадки 0,79 м2/м3. Температура абсорбції 28 °С, абсолютний тиск 1 кгс/см2. Середній вміст аміаку в газовій суміші 5,8 % (об.). Масова швидкість газу, віднесена до повного перетину скрубера, 1,1 кг/(м2∙с). Визначити коефіцієнт масовіддачі для газу, приймаючи, що скрубер працює у плівковому режимі.
ІІ.7. Розрахувати коефіцієнт масовіддачі від рідкої фази в насадковому абсорбері, у якому відбувається поглинання діоксиду вуглецю водою за температури 20 °С. Густина зрошування 60 м3/(м2∙год). Насадка – керамічні кільця 35´35´4 мм навалом. Коефіцієнт змочуваності насадки ψ = 0,86.
ІІ.8. Визначити коефіцієнт масовіддачі для газу в скрубері під час поглинання пари бензолу з коксового газу за такими даними: насадка хордова з рейок 12,5 х 100 мм із відстанню між рейками b = 25 мм (для такої насадки de =
= 2b = 0,05 м); швидкість газу, враховуючи повний перетин скрубера, 0,95 м/с; густина газу 0,5 кг/м3; динамічний коефіцієнт в’язкості газу 0,013 мПа∙с; коефіцієнт дифузії бензолу в газі 16∙10-6 м2/с. Режим прийняти плівковим.
ІІ.9. Визначити діаметр і висоту тарілчастого абсорбера для поглинання водою аміаку з повітряно-аміачної суміші за атмосферного тиску і температури
20 °С. Початковий вміст аміаку в газовій суміші 7% (об.). Ступінь вилучення 90%. Витрата інертного газу (повітря) 10000 м3/год (за робочих умов). Лінію рівноваги вважати прямою, її рівняння у відносних масових концентраціях:  . Швидкість газу в абсорбері (фіктивна) 0,8 м/с. Відстань між тарілками 0,6 м. Середній ККД тарілок 0,62. Коефіцієнт надлишку поглинача φ =
. Швидкість газу в абсорбері (фіктивна) 0,8 м/с. Відстань між тарілками 0,6 м. Середній ККД тарілок 0,62. Коефіцієнт надлишку поглинача φ =
= 1,3.
| |
РОЗДІЛ ІІI
ПЕРЕГОНКА ТА РЕКТИФІКАЦІЯ
3.1. Загальні відомості
Одним з найпоширеніших методів розділення рідких однорідних сумішей, що складаються з двох або більшої кількості летких компонентів, є перегонка (дистиляція і ректифікація).
Перегонка – це процес, що передбачає часткове випаровування суміші, що розділяється, і подальшу конденсацію пари, що утворюється. Може здійснюватися одноразово або багато разів. У результаті конденсації одержують рідину, склад якої відрізняється від складу початкової суміші.
Якщо би початкова суміш складалася з леткого або нелеткого компонентів, то її можна було б розділити на компоненти шляхом випарювання. Перегонкою розділяють суміші, всі компоненти яких леткі, тобто мають значний, хоча і різний тиск пари. Розділення перегонкою засновано на різній леткості компонентів суміші за однакової температури. Тому при перегонці всі компоненти суміші переходять в пароподібний стан в кількостях, пропорційних їх фугітивності (леткості).
У спрощеному випадку початкова суміш є бінарною, тобто складається тільки з двох компонентів. Отримана під час перегонки пара містить відносно більшу кількість легколеткого (ЛЛК) або низькокиплячого (НКК) компоненту, ніж початкова суміш. Отже, під час перегонки рідка фаза збіднюється, а парова фаза збагачується ЛЛК. Рідина, що не випарувалася, має склад, багатший на важколеткий (ВЛК), або висококиплячий(ВКК) компоненти.
Ця рідина називається залишком, а рідина, отримана в результаті конденсації пари – дистилятом, або ректифікатом.
Ступінь збагачення парової фази ЛЛК за інших рівних умов залежить від виду перегонки. Існують два принципово відмінні види перегонки: 1) проста перегонка (дистиляція) і 2) ректифікація.
Проста перегонка є процесом одноразового часткового випаровування рідкої суміші і конденсації пари, що утворюється. Проста перегонка застосовується тільки для розділення сумішей, леткість компонентів якої істотно відрізняється, тобто відношення леткості (відносна леткість) компонентів значна. Ії використовують лише для попереднього грубого розділення рідких сумішей, а також для очищення складних сумішей від небажаних домішок, смол і т.п. Відомі декілька різновидів простої перегонки, що розглядатимуться нижче.
Повніше розділення рідких сумішей на компоненти досягається шляхом ректифікації.
Ректифікація –процес розділення гомогенних сумішей летких рідин двостороннім масо- і теплообміном між нерівноважними рідкою і паровою фазами, що мають різну температуру і рухаються назустріч один одному. Розділення здійснюється в колонних апаратах при багатократному або безперервному контакті фаз. При кожному контакті з рідини випаровується переважно ЛЛК, яким збагачується пара, а з парової фази конденсується переважно ВЛК, що переходить в рідину. Обмін компонентами між фазами дає змогу отримати пару, яка є майже чистим ЛЛК. Ця пара, що виходить з верхньої частини колони, після конденсації в окремому апараті розділяється на дистилят, або ректифікат (верхній продукт) і флегму – рідину, що повертається для зрошування колони і взаємодії з парою, яка підіймається по колоні. Знизу колони відділяється рідина, що є майже чистим ВЛК, – залишок (нижній продукт). Частину залишку випаровують в нижній частині колони для отримання висхідного потоку пари.
Ректифікація відома з початку XIX століття як один з найважливіших технологічних процесів переважно спиртової і нафтової промисловості. Сьогодні ректифікацію все ширше застосовують у різноманітних областях хімічної технології, де виділення компонентів у чистому вигляді має вельми важливе значення (у виробництвах органічного синтезу, ізотопів, полімерів, напівпровідників та інших речовин високої чистоти).
Процеси перегонки здійснюються періодично або безперервно. Нижче розглянуті характеристики двофазних систем “рідина – пара”, необхідні для аналізу і розрахунку процесів перегонки.
3.2. Характеристики двофазних систем “рідина – пара”
Фазова рівновага бінарних сумішей. Якщо система складається з двох компонентів (К = 2) і між ними не відбувається хімічної взаємодії, то за наявності рідкої і парової фаз кількість фаз Ф = 2. За правилом фаз кількість ступенів вільності такої системи становить
С = К +2 – Ф = 2 + 2 – 2=2.
Отже, з трьох незалежних параметрів, які повністю визначають стан системи, – температура t, тиск р і концентрація однієі з фаз с – можна довільно вибрати будь-яких два; при цьому визначиться значення третього параметра, яке вже не може бути довільним.
У зв’язку з цим для фізико-хімічної характеристики бінарних систем “рідина – пара” зручно користуватися так званими фазовими діаграмами. Якщо позначити через х склад рідкої фази, а через у – склад парової фази, то, приймаючи t = const, можна побудувати графік залежності тиску пари від складу рідини (діаграма р – х).’
Приймаючи сталим тиск над сумішшю (р = const), зображають на площині залежність температур кипіння рідини і концентрації пари від складів рідкої і парової фаз (діаграма t – х – у). Так самоза р = const і t = const знаходятьзалежність між рівноважними складами фаз, яка зображається діаграмою рівноваги (діаграма у – х).
Вид цієї залежності визначається взаємною розчинністю компонентів рідкої суміші та іншими їхніми властивостями, що розглядатимуться нижче.
Класифікація бінарних сумішей.Залежно від взаємної розчинності компонентів розрізняють суміші рідин: 1) з необмеженою взаємною розчинністю; 2) взаємно нерозчинних; 3) обмежено розчинних одна в одній. Суміші з необмеженою взаємною розчинністю компонентів своєю чергою поділяються на ідеальні і реальні (неідеальні) суміші.
Суміші рідин з необмеженою взаємною розчинністю
Ідеальні суміші. Ідеальні розчини відповідають закону Рауля. Згідно з законом Рауля, парціальний тиск кожного компонента, наприклад, низькокиплячого компонента А в парі рА, є пропорційним мольній частці хА цього компонента в рідині. При цьому коефіцієнт пропорційності дорівнює тиску насиченої пари РА цього компонента за певної температури.
У разі змішування компонентів ідеального розчину тепловий ефект є відсутнім і об’єм суміші практично не змінюється.
У загальному вигляді закон Рауля формулюється так: леткість fi будь-якого компонента ідеального розчину дорівнює леткості fio чистого компонента, помноженій на його мольну частку:
 , (3.1)
, (3.1)
причому 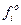 за заданих температури і загального тиску є величиною сталою, а відношення
за заданих температури і загального тиску є величиною сталою, а відношення  , тобто дорівнює активності розчину.
, тобто дорівнює активності розчину.
Для бінарної суміші, що складається з компонентів А і В, за законом Рауля
 ,
,
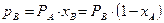 ,
,
де хВ – мольна частка компонента В, тиск насиченої пари якого над чистою рідиною за цієї температури дорівнює РВ.
Водночас, згідно з законом Дальтона, загальний тиск пари над розчином Р дорівнює сумі парціальних тисків його компонентів
 . (3.2)
. (3.2)
З рівнянь, що виражають закони Рауля і Дальтона, видно, що за сталої температури парціальні тиски компонентів, а також загальний тиск пари над сумішшю знаходяться в лінійній залежності від мольної частки хА низькокиплячого компонента.
На рис. 3.1 за t = const прямі ОВ і СА зображають зміни парціальних тисків компонентів (рА і рВ), а пряма АВ – зміну загального тиску над розчином. Вертикальні відрізки СВ і ОА виражають тиск насиченої пари чистих компонентів (РА і РВ).
Температура кипіння суміші заданого складу (хА) є функцією тиску пари. Для того, щоб її визначити, будують за значеннями тисків насиченої пари чистих компонентів (з довідників) ізотерми АВ,  ,
,  і т. д., виражаючи загальний тиск пари за температур
і т. д., виражаючи загальний тиск пари за температур  ,
,  ,
, 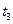 і т.д. Лінії парціальних тисків рА і рВ одержують, сполучаючи прямими крапки А,
і т.д. Лінії парціальних тисків рА і рВ одержують, сполучаючи прямими крапки А,  ,
,  і т.д. з точкою С і точки В,
і т.д. з точкою С і точки В,  ,
,  і т.д. –з точкою О.
і т.д. –з точкою О.

Рис. 3.1. Ізотерми парціальних тисків компонентів і загального тиску
для ідеальних розчинів (діаграма р – х)
Далі проводять горизонтальну пряму MN відповідно до зовнішнього тиску. З точки на осі абсцис, які відповідають хА, відновлюють вертикаль до перетину з прямою MN в точці D, через яку проходить ізотерма t = const. За цієї температури загальний тиск пари суміші дорівнює зовнішньому тиску, і, отже, суміш складу хА кипить за температури t. За аналогією можна визначити, що температура кипіння суміші складу х/А дорівнює  суміші складу х//А – t2 і т.д.
суміші складу х//А – t2 і т.д.
Парціальний тиск рА низькокиплячого компонента над сумішшю за температури кипіння t зображається вертикальним відрізком, отриманим в результаті проведення вертикалі з точки, що відповідає суміші складу хА, до перетину з прямою парціальних тиску в точці Е.
Водночас відповідно до закону Дальтона (за умови застосовності до пари кожного з компонентів рівняння Менделєєва–Клапейрона), парціальний тиск рА заданого компонента А пропорційний до його мольної частки уА в парі:
 ,
,
де Р – загальний тиск пари над сумішшю.
Враховуючи, що за законом Рауля рА = Ра×xА, знайдемо вираз для складу пари у*А, що є рівноважною з рідиною заданого складу хА, тобто знайдемо залежність між складами рівноважних фаз:
 . (3.3)
. (3.3)
Для побудови залежності температур кипіння і конденсації від складу рідини або пари, тобто діаграми t – х – у (рис. 3.2), відкладають на осі ординат за сталого зовнішнього тиску, температури кипіння t1, t2, t3, що відповідаютьскладам рідких сумішей х1, х2, х3, відкладенимна осі абсцис. Через отримані точки, що відповідають температурам кипіння чистих компонентів tA і tВ, відкладених на крайніх ординатах діаграми, проводять лінію кипіння АА1А2А3В. Потім на осі абсцис відкладають визначені за законом Рауля рівноважні склади пари  і проводять з відповідних їм точок прямі до перетину з ізотермами, що відповідають температурам t1, t2, t3. З’єднавши точки перетину В1, B2, B3, з точками А і В плавною кривою, одержують лінію конденсації А В1 В2 В3 В.
і проводять з відповідних їм точок прямі до перетину з ізотермами, що відповідають температурам t1, t2, t3. З’єднавши точки перетину В1, B2, B3, з точками А і В плавною кривою, одержують лінію конденсації А В1 В2 В3 В.

Рис. 3.2. Залежність температур кипіння і конденсації
від складу фаз (діаграма t – х – у)
У разі користуванні діаграмою на осі абсцис відкладають склад рідкої суміші і проводять з відповідної крапки вертикаль до перетину з лінією кипіння. Далі з точки перетину проводять горизонталь праворуч до перетину з лінією конденсації. Абсциса точки перетину вказує склад рівноважної пари.
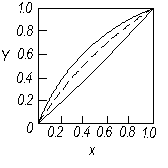
На фазову діаграму у – х (рис. 3.3) наносять лінію рівноваги, що виражає залежність між рівноважними складами (за низькокиплячим компонентом) рідкої (  ) і парової
) і парової  фаз. Процеси перегонки здійснюють зазвичай при сталому зовнішньому тиску. Тому діаграму будують за Р = const, тобтодля змінних температур кипіння, що змінюються залежно від зміни складу рідкої суміші.
фаз. Процеси перегонки здійснюють зазвичай при сталому зовнішньому тиску. Тому діаграму будують за Р = const, тобтодля змінних температур кипіння, що змінюються залежно від зміни складу рідкої суміші.
З рідиною, що є чистим НК, знаходиться в рівновазі пара, в якій міститься 100 % того самого компонента. Відповідно, крайні точки кривої рівноваги розташовані у протилежних кутках квадрата (рис. 3.3). Опуклість кривої рівноваги щодо діагоналі квадрата загалом залежить від відношення теплот випаровування компонентів суміші rA/rB. За rA/rB <1 із збільшенням тиску крива рівноваги стає менш опуклою, тобто, наближається до діагоналі квадрата (пунктир на рис. 3.3).
Для ідеальних розчинів рівняння лінії рівноваги 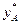 =f(х) можна вивести аналітично на основі законів Рауля і Дальтона. Підставивляючи значення Р з рівняння (3.2) в рівняння рівноваги (3.3) і розділивши чисельник і знаменник на
=f(х) можна вивести аналітично на основі законів Рауля і Дальтона. Підставивляючи значення Р з рівняння (3.2) в рівняння рівноваги (3.3) і розділивши чисельник і знаменник на  , отримаємо
, отримаємо
 , (3.4)
, (3.4)
де a = Ра/Рв – відносна леткість компонентів суміші, дорівнює відношенню тисків пари чистих компонентів за умов однакового зовнішнього тиску.
Отже, знаючи a, тобто тиск насиченої пари чистих компонентів, можна розрахувати і побудувати криву рівноваги для ідеальних сумішей.
 <
<