 |
|
Изопараметрические процессы
ТЕСТОВЫЕ ЗАДАНИЯ
ПО МОЛЕКУЛЯРНОЙ ФИЗИКЕ
Дисциплина Молекулярная физика
Специальности 5В060400 – Физика, 5В072300 – Техническая физика,
5В073200 – Стандартизация, метрология и сертификация
Курс 1, семестр 2
Составитель Корзун И. Н., доцент, канд. физ.-мат. наук
Факультет физико-технический
Кафедра теплофизики и технической физики
Модуль 1 А
Равновесные макропараметры
Уравнение состояния идеального газа
Изопараметрические процессы
1.(а, l). Отметьте правильное определение идеального газа.
Идеальным газом называется ...
1.1. газ, молекулы которого рассматриваются как не взаимодействующие друг с другом материальные точки;
1.2. газ, молекулы которого рассматриваются как абсолютно твёрдые сферы, не взаимодействующие друг с другом;
1.3. газ, молекулы которого рассматриваются как материальные точки, сила отталкивания между которыми обратно пропорциональна расстоянию между ними;
1.4. газ, молекулы которого рассматриваются как материальные точки, сила притяжения между которыми обратно пропорциональна расстоянию между ними;
1.5. газ, молекулы которого рассматриваются как абсолютно твёрдые сферы, сила притяжения между которыми пропорциональна расстоянию между ними;
1.6. модель, в которой не учитыватся собственные размеры молекул и потенциальная энергия межмолекулярного взаимодействия;
1.7. модель, в которой не учитыватся собственные размеры молекул и силымежмолекулярного взаимодействия;
1.8. газ, молекулы которого рассматриваются как абсолютно твёрдые сферы, сила отталкивания между которыми обратно пропорциональна расстоянию между ними.
2.(а, к). Укажите правильную формулу для основного уравнения молекулярно-кинетической теории газов (n - число частиц в единице объёма газа).
2.1.  ; 2.2.
; 2.2.  ; 2.3.
; 2.3.  ;
;
2.4.  ; 2.5.
; 2.5.  ; 2.6.
; 2.6. 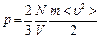 ;
;
2.7.  ; 2.8.
; 2.8.  .
.
3. (а,к). Укажите правильную формулу для основного уравнения молекулярно-кинетической теории газов (<Eк> - средняя кинетическая энергия теплового движения одной молекулы газа).
3.1.  ; 3.2.
; 3.2.  ; 3.3.
; 3.3. 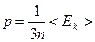 ; 3.4.
; 3.4.  ; 3.5.
; 3.5.  ; 3.6.
; 3.6.  ; 3.7.
; 3.7.  ; 3.8.
; 3.8.  .
.
4. (d, m). Как изменится давление идеального газа при увеличении средней квадратичной скорости его молекул в 1,5 раза, если числовая плотность молекул остается неизменной?
4.1. Увеличится в 1,5 раза; 4.2.увеличится в 2,25 раза; 4.3. не изменится;
4.4. уменьшится в 1,5 раза; 4.5. уменьшится в 2,25 раза. 4.6. возрастёт в 2,25 раза; 4.7. станет больше в 2,25 раза; 4.8. для разных газов могутбыть разные ответы.
5. (d, m). Как изменится давление идеального газа при увеличении числовой плотности молекул в три раза, если средняя квадратичная скорость молекул остаётся неизменной?
5.1. Уменьшится в три раза; 5.2. не изменится; 5.3. увеличится в два раза;
5.4. увеличится в три раза; 5.5. уменьшится в два раза. 5.6. возрастёт в три раза; 5.7. станет больше в 3 раза; 5.8. для разных газов могутбыть разные ответы.
6.(d, m). Укажите правильную формулу для средней квадратичной скорости молекул  , полученную из основного уравнения молекулярно-кинетической теории (r = nm - плотность газа).
, полученную из основного уравнения молекулярно-кинетической теории (r = nm - плотность газа).
6.1. 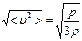 ; 6.2.
; 6.2.  ; 6.3.
; 6.3.  ; 6.4.
; 6.4.  ;
;
6.5.  ; 6.6.
; 6.6.  ; 6.7.
; 6.7.  ; 6.8.
; 6.8.  .
.
7.(d, m). Средняя квадратичная скорость молекул некоторого газа  = 450 м/с. Давление газа p = 50 кПа. Найти плотность
= 450 м/с. Давление газа p = 50 кПа. Найти плотность  газа при этих условиях.
газа при этих условиях.
7.1. 1,24 кг/м3; 7.2. 0,24 кг/м3; 7.3. 0,74 кг/м3; 7.4. 1,74 кг/м3;
7.5. 0,074 кг/м3; 7.6.0,74∙103 г/м3; 7.7.0,74∙10 -3 г/см3; 7.8. 1,74 г/м3 .
8. (а, к). Укажите правильную формулировку понятия температуры.
8.1. Температура - степень нагретости тела;
8.2. температура - физическая величина, пропорциональная энергии тела;
8.3. температура - физическая величина, пропорциональная средней кинетической энергии поступательного движения хаотически движущихся молекул;
8.4. температура - физическая величина, пропорциональная полной кинетической энергии хаотически движущихся молекул;
8.5. температура - физическая величина, пропорциональная потенциальной энергии межмолекулярного взаимодействия.
8.6. температура - физическая величина, пропорциональная потенциальной энергии молекул в поле внешних сил;
8.7. температура – физическое свойство, которым обладает система, состоящая из большого числа частиц;
8.8. температура – статистическая величина, характеризующая систему, состоящую из большого числа частиц.
9.(а, п). Укажите правильное определениеединицы измерения температуры в единицах СИ.
9.1. Один кельвин есть одна сотая температурного интервала между температурами кипения воды и таяния льда при нормальном атмосферном давлении;
9.2. один кельвин есть температурный интервал, соответствующий одной сотой части поднятия ртути между температурами кипения воды и таяния льда при нормальном атмосферном давлении;
9.3. один кельвин есть 1/273,15 часть температурного интервала от абсолютного нуля до температуры тройной точки воды;
9.4. один кельвин есть 1/273,16 часть температурного интервала от абсолютного нуля до температуры таяния льда при нормальном атмосферном давлении;
9.5. один кельвин есть 1/273,16 часть температурного интервала от абсолютного нуля до температуры тройной точки воды.
9.6. в СИ шкала температур устанавливается по одной реперной точке – температуре тройной точки воды;
9.7. абсолютный нуль температур – не реперная точка, а температура, на 273,16 К ниже температуры тройной точки воды;
9.8. один кельвин есть 1/273,16 часть температурного интервала от абсолютного нуля до температуры кипения воды при нормальном атмосферном давлении.
10. (b,l). Укажите правильную формулу.
10.1. 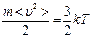 ; 10.2.
; 10.2.  ; 10.3.
; 10.3.  ; 10.4.
; 10.4.  ; 10.5.
; 10.5.  ~ Eкин + Eпот. 10.6.
~ Eкин + Eпот. 10.6.  ; 10.7.
; 10.7.  ; 10.8.
; 10.8. 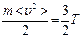 .
.
11. (b,n). В каких единицах измеряется постоянная Больцмана k в СИ?
11.1. Дж/(моль×К); 11.2. Дж/моль; 11.3. Дж/К; 11.4. Дж×моль;
11.5. Дж×К.11.6. Н∙м/К; 11.7.кг∙м2/(с2∙К); 11.8. Дж×моль.
12.(b,n). В каких единицах измеряется универсальная газовая постоянная R в СИ?
12.1. Дж×К; 12.2. Дж/(моль×К); 12.3.Дж/К; 12.4.Дж/моль;
12.5. Дж×моль/К; 12.6. Н∙м/(моль×К); 12.7. кг∙м2/(с2∙К∙моль); 12..8. Дж×моль∙К.
13. (b,n). Укажите правильное значение постоянной Авогадро NA..
13.1. NA = 6,02×1023 моль-1; 13.2. NA = 6,02×10-23 моль-1; 13.3. NA = 1023 моль-1;
13.4. NA = 10-23 моль-1; 13.5. NA = 6,02×1015 моль-1; 13.6. NA = 10 -15 моль-1;
13.7. NA = 6,02×1026 кмоль-1; 13.8. NA = 6,02×1023 1/моль
14. (d,m). Во сколько раз различаются среднеквадратичные скорости молекул идеального газа при температурах, отличающихся в два раза?
14.1. В два раза; 14.2. одинаковы; 14.3.в 1,41 раза; 14.4. в 4 раза; 14.5. в 3 раза;14.6. в  раз; 14.7. при более высокой температуре среднеквадратичная скорость молекл будет в
раз; 14.7. при более высокой температуре среднеквадратичная скорость молекл будет в  раз больше; 14.8. для разных газов могут быть разные ответы.
раз больше; 14.8. для разных газов могут быть разные ответы.
15. (d,m). Определить среднюю кинетическую энергию теплового движения молекулы идеального газа при нормальных условиях (постоянная Больцмана k = 1,38×10-23 Дж/К).
15.1. 62×10-21 Дж; 15.2. 3,5×10-21 Дж; 15.3. 12,4×10-21 Дж; 15.4. 5,65×10-21 Дж;
15.5. 18,6×10-21 Дж. 15.6. 5,65×10-21 Н∙м; 15.7. 5,65×10-21 кг∙м2 /с2; 15.8. 5,65×1021 Дж.
16. (d,m). Во сколько раз различаются скорости двух молекул различных идеальных газов, если масса их молекул различается в 4 раза, а температура газов одинакова?
16.1. В два раза; 16.2. в 16 раз; 16.3. в 8 раз; 16.4. в 4 раза; 16.5. одинаковы.
16.6. более тяжёлый газ имеет скорость в два раза меньше; 16.7. более лёгкий газ имеет скорость в два раза большен; 16.8 . для разных газов могут быть разные ответы.
17. (d,m). Какая температура соответствует средней квадратичной скорости молекул кислорода  = 400 м/с?
= 400 м/с?
17.1. 411 К; 17.2. 104 К; 17.3. 309 К; 17.4. 515 К;
17.5. 205 К; 17.6. - 680С; 17.7. (205-273) 0С; 17.8. 478 К.
18. (a,l). Укажите правильную формулу для внутренней энергии U одного моля идеального газа.
18.1.  ; 18.2.
; 18.2.  ; 18.3.
; 18.3.  ; 18.4.
; 18.4.  ; 18.5.
; 18.5.  .
.
18.6.  ; 18.7.
; 18.7.  ; 18.8.
; 18.8.  .
.
19. (a,l). Укажите правильную формулу для внутренней энергии U произвольной массы идеального газа (m - масса газа, M - его молярная масса).
19.1. 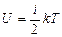 ; 19.2.
; 19.2.  ; 19.3.
; 19.3.  ; 19.4.
; 19.4.  ; 19.5.
; 19.5.  . 19.6.
. 19.6.  ; 19.7.
; 19.7. 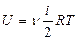 ; 19.8.
; 19.8.  .
.

20. (a,k). Укажите правильную формулу для уравнения состояния одного моля идеального газа (m - масса газа, M - его молярная масса).
20.1. 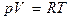 ; 20.2.
; 20.2.  ; 20.3.
; 20.3. 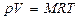 ; 20.4.
; 20.4. 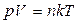 ;
;
20.5. 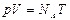 . 20.6.
. 20.6.  ; 20.7.
; 20.7.  20.8.
20.8.  .
.
21. (a,k). Укажите правильную формулу для уравнения состояния идеального газа (m - масса газа, M - его молярная масса).
21.1.  ; 21.2.
; 21.2. 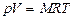 ; 21.3.
; 21.3.  ;
;  21.4.
21.4.  ;
;
21.5.  .21.6.
.21.6.  ; 21.7.
; 21.7.  ; 21.8.
; 21.8. 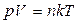 .
.
22. (b, l). Укажите правильную формулу.
22.1.  ; 22.2.
; 22.2.  ; 22.3.
; 22.3.  ; 22.4.
; 22.4.  ;
;
22.5.  .22.6.
.22.6.  ; 22.7.
; 22.7. 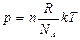 ; 22.8.
; 22.8.  .
.
23. (d,m). Сколько молекул N газа находится в сосуде объемом V при давлении p и температуре T?
23.1.  ; 23.2.
; 23.2.  ; 23.3.
; 23.3.  ; 23.4.
; 23.4.  ;
;
23.5.  ; 23.6.
; 23.6.  ; 23.7.
; 23.7.  23.8.
23.8.  .
.
24. (d, m). Какова температура 8 г кислорода, занимающего объем 2,1 л при давлении 200 кПа? 
24.1. 302 К; 24.2. -710 С; 24.3. 710 С; 24.4. 400 К; 24.5. 344 К.
24.6. 202 K; 24.7. (-71+273) 0С; 24.8. 1200 С.
25. (d, m). Сколько молекул воздуха содержится в комнате размерами 6´3´3 м3 при нормальных условиях? Постоянная Больцмана k = 1,38×10-23 Дж/K.
25.1. N = 1,4×10-27; 25.2. N = 7×1015; 25.3. N = 7×10-15; 25.4. N = 1,4×1015; 25.5. N = 1,4×1027; 25.6. N = 14×1026; 25.7. N = 0,14×1028; 25.8. N = 7×1015.
26. (d, m). Какой объем занимают 8 г кислорода при температуре 170С и давлении 200 кПа?
26.1. 30 л; 26.2. 0,3 л; 26.3. 3 л; 26.4. 6 л; 26.5. 60 л.
26.6. 3∙10-3 м3; 26.7. 3∙103 см3; 26.8. 13 л.
27. (d, m). Найти массу m азота, занимающего объем 25 л при температуре 270 С и давлении 100 кПа.
27.1. 28 кг; 27.2.28×10-3 кг; 27.3. 14 кг; 27.4. 14×10-3 кг;
27.5. 56×10-3 кг.27.6.0,028 кг; 27.7. 28 г; 27.8. 1,4 кг.
28. (d, m). Какова масса воздуха, содержащегося в комнате размерами 3´3´6 м3 при нормальных условиях? Молярная масса воздуха М = 29×10-3 кг/моль.
28.1. 6,9 кг; 28.2. 0,69 кг; 28.3. 690 кг; 28.4.69 кг; 28.5. 0,069 кг.
28.6. 0,69∙10-2 кг; 28.7. 69∙103 г; 28.8. 690 г.
29. (b, l). Укажите правильную формулу для плотности r идеального газа (М - молярная масса газа,  - масса молекулы).
- масса молекулы).
29.1.  ; 29.2.
; 29.2.  ; 29.3.
; 29.3. 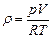 ; 29.4.
; 29.4. 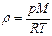 ; 29.5.
; 29.5.  .
.
29.6. 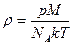 ; 29.7.
; 29.7.  ; 29.8.
; 29.8. 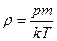 .
.
30. (d, m). При температуре t = 500С давление насыщенного водяного пара p = 12,3 кПа. Найти плотность r водяного пара.
30.1. 82 кг/м3; 30.2. 0,82 кг/м3; 30.3. 0,082 кг/м3; 30.4. 8,2 кг/м3; 30.5. 0,0082 кг/м3. 30.6. 8,2∙10-5 г/см3; 30.7. 0,082 г/л; 30.8. 82 г/л.
31. (d, m). Найти внутреннюю энергию U двухатомного газа, находящегося в сосуде объемом V = 2 л под давлением Р = 150 кПа.
31.1. 750 Дж; 31.2. 75 Дж; 31.3. 7,5 Дж; 31.4. 7500 Дж; 31.5. 300 Дж, 31.6. 750 Н∙м; 31.7. 0,75 кДж; 31.8. 75 Н∙м.
32. (d, m). Найти внутреннюю энергию массы m = 1 г воздуха при температуре t = 170 С. Молярная масса воздуха М = 29×10-3 кг/моль.
32.1. 208 кДж; 32.2. 208 Дж; 32.3. 20 Дж; 32.4. 20 кДж; 32.5. 2,08 Дж.
32.6. 0,208 кДж; 32.7. 208 Н∙м; 32.8. 20 Н∙м.
33. (d, m). Найти энергию вращательного движения молекул, содержащихся в массе m = 1 кг азота при температуре t = 70 С.
33.1. 80 Дж; 33.2. 8 Дж; 33.3. 8 кДж; 33.4. 80 кДж; 33.5. 800 Дж.
33.6. 8∙104 Дж; 33.7.80∙103 Н∙м; 33.8. 80 Н∙м.
34. (a, k). Укажите правильную формулу для изохорного процесса.
34.1.  ; 34.2.
; 34.2. 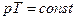 ; 34.3.
; 34.3.  ; 34.4.
; 34.4.  ; 34.5.
; 34.5.  ; 34.6.
; 34.6.  ; 34.7.
; 34.7.  ; 34.8.
; 34.8. 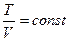 .
.
35. (a, k). Укажите правильную формулу для изобарного процесса.
35.1.  ; 35.2.
; 35.2.  ; 35.3.
; 35.3.  ; 35.4.
; 35.4.  ; 35.5.
; 35.5.  ; 35.6.
; 35.6.  ; 35.7.
; 35.7.  ; 35.8.
; 35.8.  .
.
36. (a, k). Укажите правильную формулу для изотермического процесса.
36.1.  ; 36.2.
; 36.2.  ; 36.3.
; 36.3.  ; 36.4.
; 36.4.  ; 36.5.
; 36.5.  ; 36.6.
; 36.6.  ; 36.7.
; 36.7.  ; 36.8.
; 36.8.  .
.
37. (d, m). Отметьте вариант ответа, в котором правильно указаны все изопараметрические процессы.


 p 2 3 37.1. 1 - изобара, 2 - изохора, 3 - изотерма;
p 2 3 37.1. 1 - изобара, 2 - изохора, 3 - изотерма;
37.2. 1 - изобара, 2 - изотерма, 3 - изохора;
37.3. 1 - изохора, 2 - изотерма, 3 - изобара;
 1 37.4. 1 - изохора, 2 - изобара, 3 - изотерма;
1 37.4. 1 - изохора, 2 - изобара, 3 - изотерма;
37.5. 1 - изотерма, 2 - изобара, 3 – изохора;
 V 37.6. 3 - изохора, 2 - изотерма, 1 – изобара;
V 37.6. 3 - изохора, 2 - изотерма, 1 – изобара;
37.7.2 - изотерма, 3 – изохора, 1 – изобара;
37.8. 3 - изотерма; 2 - изохора, 1 – изобара.
38. (d, m). Отметьте вариант ответа, в котором правильно указаны все изопараметрические процессы.


 p 2 3 38.1. 1 - изотерма, 2 - изохора, 3 - изобара;
p 2 3 38.1. 1 - изотерма, 2 - изохора, 3 - изобара;
38.2. 1 - изобара, 2 - изохора, 3 - изотерма;
 1 38.3. 1 - изотерма, 2 - изобара, 3 - изохора ;
1 38.3. 1 - изотерма, 2 - изобара, 3 - изохора ;
38.4. 1 - изохора, 2 - изотерма, 3 - изобара;
 T 38.5. 1 - изобара, 2 - изотерма, 3 - изохора.
T 38.5. 1 - изобара, 2 - изотерма, 3 - изохора.
38.6. 3 – изохора, 2 - изотерма, 1 – изобара;
38.7. 2 - изотерма, 3 – изохора, 1 – изобара;
38.8. 3 – изобара, 2 - изохора, 1 – изотерма.
39. (d, m). Отметьте вариант ответа, в котором правильно указаны все изопараметрические процессы.


 V 2 3 39.1. 1 - изохора, 2 - изобара, 3 - изотерма;
V 2 3 39.1. 1 - изохора, 2 - изобара, 3 - изотерма;
39.2. 1 - изохора, 2 - изотерма, 3 - изобара;
 1 39.3. 1 - изобара, 2 - изотерма, 3 - изохора ;
1 39.3. 1 - изобара, 2 - изотерма, 3 - изохора ;
39.4. 1 - изобара, 2 - изохора, 3 - изотерма;
 T 39.5. 1 - изотерма, 2 - изохора, 3 - изобара.
T 39.5. 1 - изотерма, 2 - изохора, 3 - изобара.
39.6. 3 - изобара , 2 - изотерма, 1 – изохора;
39.7. 2 – изотерма, 3 - изобара, 1 – изохора;
39.8. 3 – изотерма, 1 - изохора, 2 – изобара.
40. (d, m). Как изменится температура идеального газа при переходе из состояния 1 в состояние 2?
 p 40.1. уменьшится; 40.2. не изменится;
p 40.1. уменьшится; 40.2. не изменится;
 1 2 40.3. увеличится; 40.4. нужно знать массу газа;
1 2 40.3. увеличится; 40.4. нужно знать массу газа;
40.5. для разных газов могут быть разные ответы;
 V 40.6. возрастёт, 40.7. станет больше, 40.8. станет меньше.
V 40.6. возрастёт, 40.7. станет больше, 40.8. станет меньше.
41. (d, m). Как изменится температура идеального газа при переходе из состояния 1 в состояние 2?

 p 1 41.1. уменьшится; 41.2. не изменится;
p 1 41.1. уменьшится; 41.2. не изменится;
41.3. увеличится; 41.4. нужно знать массу газа;
2 41.5. для разных газов могут быть разные ответы;
 V 41.6. станет меньше, 41.7.
V 41.6. станет меньше, 41.7.  , 41.8. станет больше.
, 41.8. станет больше.
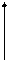 42. (d, m). Как изменится давление идеального газа при переходе из состояния 1 в состояние 2?
42. (d, m). Как изменится давление идеального газа при переходе из состояния 1 в состояние 2?
V 42.1. увеличится; 42.2. уменьшится;
1 2 T 42.3. не изменится; 42.4. нужно знать массу газа;

 |
42.5. для разных газов могут быть разные ответы;
42.6. возрастёт, 42.7. станет больше, 42.8. станет меньше.
43. (d, m). Как изменится давление идеального газа при переходе из состояния 1 в состояние 2?
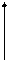
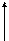 V 2 43.1. увеличится; 43.2. уменьшится;
V 2 43.1. увеличится; 43.2. уменьшится;
43.3. не изменится; 43.4. нужно знать массу газа;
1 43.5. для разных газов могут быть разные ответы.
 T 43.6.станет меньше; 43.7.
T 43.6.станет меньше; 43.7.  ; 43.8. возрастёт.
; 43.8. возрастёт.
44. (d, m). Как изменится объем идеального газа при переходе из состояния 1 в состояние 2?
 p 44.1. уменьшится; 44.2. увеличится;
p 44.1. уменьшится; 44.2. увеличится;
1 2 44.3. не изменится; 44.4. нужно знать массу газа;
 44.5. для разных газов могут быть разные ответы;
44.5. для разных газов могут быть разные ответы;
44.6. возрастёт; 44.7. станет больше; 44.8. станет меньше.
 T
T
45. (d, m). Как изменится объем идеального газа при переходе из состояния 1 в состояние 2?

 p 2 45.1. не изменится; 45.2. увеличится;
p 2 45.1. не изменится; 45.2. увеличится;
45.3. уменьшится; 45.4. нужно знать массу газа;
1 45.5. для разных газов могут быть разные ответы;
 T 45.6. станет меньше; 45.7.
T 45.6. станет меньше; 45.7.  ; 45.8. возрастёт.
; 45.8. возрастёт.
46. (d, m). При нагревании идеальный газ переведен из состояния 1 в состояние 2. Как изменился при этом объем газа? Масса газа постоянна.

 p 2 46.1. не изменился; 46.2. увеличился;
p 2 46.1. не изменился; 46.2. увеличился;
46.3. уменьшился; 46.4. нужно знать массу газа;
1 46.5. для разных газов могут быть разные ответы;
 T 46.6. стал меньше; 46.7.
T 46.6. стал меньше; 46.7.  ; 46.8. стал больше.
; 46.8. стал больше.
47. (d, m).При нагревании идеального газа был получен график зависимости его давления от температуры. Масса газа постоянна. При этом объем газа...
 p 47.1. увеличится; 47.2. уменьшится
p 47.1. увеличится; 47.2. уменьшится


 p2 2 47.3. не изменится; 47.4. нужно знать массу газа;
p2 2 47.3. не изменится; 47.4. нужно знать массу газа;
 47.5. для разных газов могут быть разные ответы;
47.5. для разных газов могут быть разные ответы;

 p1 1 47.6. остался таким же, 47.7.
p1 1 47.6. остался таким же, 47.7.  ; 47.8. стал больше.
; 47.8. стал больше.

T1 T2 T
 48. (d, m). При нагревании идеальный газ переведен из состояния 1 в сoстояние 2. Как изменилось при этом его давление? Масса газа постоянна.
48. (d, m). При нагревании идеальный газ переведен из состояния 1 в сoстояние 2. Как изменилось при этом его давление? Масса газа постоянна.
 V 48.1. не изменилось; 48.2. увеличилось;
V 48.1. не изменилось; 48.2. увеличилось;
2 48.3. уменьшилось; 48.4. нужно знать массу газа;
1 48.5.для разных газов могут быть разные ответы.
 T 48.6. возросло; 48.7. стало больше; 48.8. стало меньше.
T 48.6. возросло; 48.7. стало больше; 48.8. стало меньше.
49. (d, m). Состояние идеального газа изменилось в соответствии с графиком, изображенным на рисунке. В состоянии 1 температура газа была Т0. Определить температуру газа в состоянии 3.
 p 49.1. Т0; 49.2. 2Т0; 49.3. 3Т0;
p 49.1. Т0; 49.2. 2Т0; 49.3. 3Т0;

 2p 3 49.4. 4Т0; 49.5. 5Т0 ; 49.6.Т3=4Т0;
2p 3 49.4. 4Т0; 49.5. 5Т0 ; 49.6.Т3=4Т0;



 p 1 2 49.7. Т0=0,25 Т3 ; 49.8. Т3=0,5 Т0.
p 1 2 49.7. Т0=0,25 Т3 ; 49.8. Т3=0,5 Т0.

V 2V V
50. (d, m). На диаграмме (PV) точками 1 и 2 изображены два состояния одной и той же массы идеального газа. Каково соотношение между температурами Т1 и Т2?
 p 50.1. Т1 > T2; 50.2. Т1 = T2;
p 50.1. Т1 > T2; 50.2. Т1 = T2;

 1 50.3. Т1 < T2; 50.4. нужно знать массу газа;
1 50.3. Т1 < T2; 50.4. нужно знать массу газа;

 2 50.5. для разных газов могут быть разные ответы;
2 50.5. для разных газов могут быть разные ответы;
50.6.температура не изменилась;
 V 50.7.температура осталась неизменной;
V 50.7.температура осталась неизменной;
50.8. температура увеличилась.
51. (d, m). На диаграмме (pТ) точками aи b изображены два состoяния одной и той же массы газа. Укажите правильное соотношение между объемами и плотностями газа в этих двух состояниях при перходе из состояния a в состояние b.
 p 51.1. Va > Vb, ra > rb ; 51.2. Va < Vb, ra < rb;
p 51.1. Va > Vb, ra > rb ; 51.2. Va < Vb, ra < rb;
b · 51.3. Va < Vb, ra > rb ; 51.4. Va > Vb, ra < rb ;
51.5. необходимо знать массу газа;
a · 51.6. Vb< Va, rb>< ra; 51.7. объём газа увеличился,
 T 51.7. объём газа уменьшился, плотность увеличилась;
T 51.7. объём газа уменьшился, плотность увеличилась;
51.8. объём и плотность газа не изменились.
52. (d, m). На диаграмме (VT) приведен график, описывающий два процесса в идеальном газе при переходе 1 - 2 - 3. Эти процессы ...
 V 52.1. изобарического охлаждения и изотермического сжатия;
V 52.1. изобарического охлаждения и изотермического сжатия;
 3 52.2. изобарического нагревания и изотермического расширения;
3 52.2. изобарического нагревания и изотермического расширения;
52.3. изобарического охлаждения и изотермического расширения;
 2 52.4. изобарического нагревания и изотермического сжатия;
2 52.4. изобарического нагревания и изотермического сжатия;
1 52.5. изотермического нагревания и изохорического расширения.
 T 52.6.1-2:
T 52.6.1-2:  2-3:
2-3:  ;
;
52.7. 1-2: изобара, 2-3: изотерма;
52.8. 1-2:  2-3:
2-3:  .
.
53. (a, l). Внутренняя энергия газа складывается из Ек - суммарной кинетической энергии теплового движения молекул и Еп - потенциальной энергии их взаимодействия. При каком соотношении между Ек и Еп состояние газа может быть описано уравнением Клапейрона - Менделеева?
53.1. Ек >> Еп; 53.2. Ек << Еп; 53.3. Ек = Еп; 53.4. Ек и Еп больше нуля;
53.5. Ек и Еп не связаны никакими соотношениями; 53.6.Еп << Ек ;
53.7. суммарная кинетическая энергия теплового движения молекул много больше потенциальной энергии их взаимодействия;
53.8. суммарная кинетическая энергия теплового движения молекул много меньше потенциальной энергии их взаимодействия
54. (b, n). Укажите правильное значение универсальной газовой постоянной R.
54.1. 8,31×103 Дж/(моль×К); 54.2. 8,31×10-3 Дж/(моль×К); 54.3. 0,831 Дж/(моль×К);
54.4. 83,1 Дж/(моль×К); 54.5. 8,31 Дж/(моль×К); 54.6. 8,31 Н∙м/(моль×К); 54.7. 8,31×103 Дж/(кмоль×К); 54.8. 8,31 Дж/(кмоль×К).
55. (d, m). В баллоне объемом V находится газ массой m1 при температуре T1. Некоторое количество газа выпустили из баллона, после чего оставшаяся масса оказалась равной m2, а температура Т2. Какую массу газа D m = m1 - m2 выпустили из баллона?
55.1.  ; 55.2.
; 55.2.  ; 55.3.
; 55.3.  ;
;
55.4. 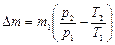 ; 55.5.
; 55.5.  ; 55.6.
; 55.6.  ; 55.7.
; 55.7.  ; 55.8.
; 55.8.  .
.
Модуль 2. А