 |
|
Некоторые аминокислоты и биогенные амины, образующиеся из них
В.А. СМИРНОВ, Ю.Н. КЛИМОЧКИН
Аминокислоты
и полипептиды
Учебное пособие
Часть I
Самара
Самарский государственный технический университет
 ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«Самарский государственный технический университет»
____________________________________________________________
В.А. СМИРНОВ, Ю.Н. КЛИМОЧКИН
Аминокислоты
и полипептиды
Утверждено Редакционно-издательским советом университета
в качестве учебного пособия
Самара
Самарский государственный технический университет
УДК 571.1. + 577.1
С 50
Р е ц е н з е н т канд. мед. наук С. А. Т у м а к о в
Смирнов В.А.
С 50Аминокислоты и полипептиды: учеб. пособ. Ч. I./ В.А. Смирнов,
Ю.Н. Климочкин. – Самара. Самар. гос. техн. ун-т., 2007. – 110 с.: ил.
ISBN 978-5-7964-1057-4
Рассмотрены классификация, номенклатура, строение, физико-химические свойства, методы качественного и количественного анализа аминокислот и полипептидов. Приведены методики качественного и количественного титриметрического и спектрального анализа аминокислот и белков.
Предназначено для студентов, обучающихся по специальностям 020101, 260202, 260204, 260401, 240901.
УДК 571.1. + 577.1
С 50
ISBN 978-5-7964-1057-4 © Смирнов В.А., Климочкин Ю.Н., 2007
© Самарский государственный
технический университет, 2007
ВВЕДЕНИЕ
Дисциплина «Биохимия» входит в цикл общепрофессиональных дисциплин для студентов химико-технологического факультета, обучающихся по специальности «Химия» по направлению «Фармацевтическая химия», и факультета пищевых производств Самарского государственного технического университета.
За последние 20-25 лет, благодаря успехам молекулярной биологии и широкому внедрению разнообразных современных методов исследования (спектральных, хроматографических и др.), значительно возрос уровень биохимических исследований как в теоретическом, так и в методическом отношении. Исследования проводятся на различных уровнях организации организмов: молекулярном, субклеточном, клеточном, межклеточном, тканевом, органном. В отличие от традиционно изучаемой медиками и биологами дисциплины «Общая биохимия» настоящее учебное пособие по биохимии ставит своей задачей ознакомить студентов с основами и современными аспектами химии живой материи на уровне клетки и не включает в себя биохимию органов и систем организмов.
Основное внимание уделено физико-химическим свойствам и методам анализа веществ биологического происхождения. Это обусловлено спецификой деятельности специалистов в области фармацевтической химии и переработки пищевых продуктов.
В ассортимент современных лекарственных средств входит значительная группа препаратов биологического происхождения: антибиотики, ферментные препараты, гормоны и др. Эффективная разработка и совершенствование лекарственных средств немыслимы без понимания биохимических процессов в организмах.
Все пищевые предприятия перерабатывают сырье биологического происхождения, поэтому курс биохимии является теоретической базой любой пищевой технологии.
Целями настоящего учебного пособия являются следующие:
1) ознакомить студентов с биологически активными молекулами природного происхождения, такими, как аминокислоты, белки, ферменты, углеводы, липиды, витамины, гормоны и др., и основными путями обмена веществ на уровне клетки;
2) обучить их основным приемам и навыкам, необходимым для профессионального овладения процессами переработки сырья биологического происхождения, методами оценки его качества и качества препаратов биологического происхождения.
1. ВНЕАУДИТОРНАЯ ПОДГОТОВКА
1.1. АМИНОКИСЛОТЫ
1.1.1. СТРОЕНИЕ, КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА
Аминокислоты – это органические кислоты, содержащие одну или несколько аминогрупп. В зависимости от природы кислотной функции аминокислоты подразделяют на аминокарбоновые, например H2NCH2COOH, аминосульфоновые, например H2N(CH2)2SO2OH, аминофосфоновые и т.д. В живых организмах встречаются, главным образом, аминокарбоновые кислоты (в дальнейшем просто аминокислоты), хотя и редко, но встречаются и аминосульфоновые кислоты, например Н2NCH2CH2SO2OH (таурин – конечный продукт метаболизма цистеина).
Классифицируют аминокислоты по разным признакам: по химическому строению, по участию в синтезе белка in vivo, по кислотно-основным свойствам, по потребности организмов в данной аминокислоте.
По химическому строению аминокарбоновые аминокислоты делятся на аминокислоты ароматического ряда и аминокислоты алифатического ряда. Аминокислоты ароматического ряда составляют лишь весьма небольшой круг веществ, встречающихся в организмах, например пара-аминобензойная кислота (фактор роста микроорганизмов). Основная масса аминокислот, выделенных из разных организмов, относится к классу алифатических аминокислот, т.е. таких аминокислот, в которых амино– и карбоксильная группы связаны с алифатическим атомом углерода.
Алифатические аминокислоты делятся в зависимости от относительного положения амино– и карбоксильной групп на α-, β-, γ-аминокислоты и т.д., например:
Н2N-CH2-COOH Н2N-CH2-CH2-COOH Н2N-CH2-CH2-CH2-COOH
α-Аминоуксусная β-Аминопропионовая γ-Аминомасляная
кислота (глицин) кислота (β-аланин) кислота (ГАМК)
Основная масса природных аминокислот представлена α-изомерами, а β– и γ-аминокислоты в живых системах представлены единичными случаями. Здесь можно упомянуть нейромедиатор ЦНС млекопитающих γ-аминомасляную кислоту (ГАМК) и β-аланин, являющийся фрагментом кофермента А. α-Аминокислоты чрезвычайно широко распространены в живых организмах любого типа: в растениях, в микроорганизмах, в животных, в морских организмах. Они найдены также в некоторых метеоритах, при этом это такие же аминокислоты, какие входят в состав белков земных организмов.
Все α-аминокислоты, кроме глицина, имеют асимметрический (хиральный) α-углеродный атом и существуют в виде двух энантиомеров (L– и D-аминокислот):
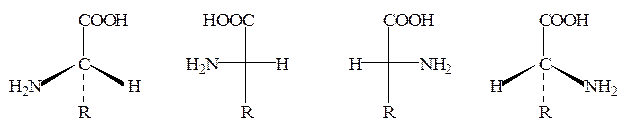 |
L-аминокислота Проекции Фишера D-аминокислота
(S-конфигурация) (R-конфигурация)
Необходимо отметить, что в случае аминокислот символы L и D приняты для обозначения конфигурации α-углеродного атома, а не знака оптического вращения (для указания последнего используются символы + и −). Например, L-цистеин в нейтральном водном растворе является левовращающим (−), напротив, L-аланин – правовращающим (+), хотя также принадлежит к L-ряду. На знак оптического вращения оказывает влияние среда, в которой проводится определение. Так, L-серин в нейтральной среде является лево-, а в кислой – правовращающим.
 Абсолютные конфигурации устанавливаются с помощью правила последовательности Куна, Ингольда, Прелога*. Для определения конфигурации асимметрического центра Сabdf сначала определяют старшинство групп abdf. Чем больше атомный номер первого атома группы, тем она старше; если они одинаковы, сравнивают атомные номера вторых атомов группы и т.д. Так, в случае α-аминокислот последовательность, соответствующая уменьшению старшинства групп, такова: H2N, COOH, R, H.
Абсолютные конфигурации устанавливаются с помощью правила последовательности Куна, Ингольда, Прелога*. Для определения конфигурации асимметрического центра Сabdf сначала определяют старшинство групп abdf. Чем больше атомный номер первого атома группы, тем она старше; если они одинаковы, сравнивают атомные номера вторых атомов группы и т.д. Так, в случае α-аминокислот последовательность, соответствующая уменьшению старшинства групп, такова: H2N, COOH, R, H.
 Далее нужно смотреть на тетраэдр со стороны, противоположной младшей группе, и если при этом обход оставшихся трех заместителей от старшего к среднему и затем к младшему соответствует движению по часовой стрелке, конфигурация описывается как R (rectus – правая), а если против часовой, то как S (sinister – левая). На вышеприведенных рисунках символ обозначает, что заместитель расположен над плоскостью, --- – за плоскостью, а — – в плоскости бумаги. S-Конфигурация при α-углеродном атоме имеет место у всех α-аминокислот L-ряда, соответственно R-конфигурация присуща D-α аминокислотам.
Далее нужно смотреть на тетраэдр со стороны, противоположной младшей группе, и если при этом обход оставшихся трех заместителей от старшего к среднему и затем к младшему соответствует движению по часовой стрелке, конфигурация описывается как R (rectus – правая), а если против часовой, то как S (sinister – левая). На вышеприведенных рисунках символ обозначает, что заместитель расположен над плоскостью, --- – за плоскостью, а — – в плоскости бумаги. S-Конфигурация при α-углеродном атоме имеет место у всех α-аминокислот L-ряда, соответственно R-конфигурация присуща D-α аминокислотам.
Все протеиногенные аминокислоты (определение термина см. далее) относятся к L-ряду. Однако за последнее время появилось много данных о наличии D-аминокислот как в свободном состоянии, так и в составе пептидов, главным образом среди продуктов метаболизма микроорганизмов. Остатки D-аминокислот входят в состав многих антибиотиков, например, полимиксин D содержит фрагмент D-серина, грамицидин А – D-лейцина, актиномицин С – D-валина.
Некоторые природные α-аминокислоты (изолейцин, треонин) имеют два асимметрических атома углерода и соответственно существуют в виде двух пар диастереомеров. Эти аминокислоты, встречающиеся в природных белках, относят к нормальному ряду, а соответсвующие им стереоизомеры, полученные синтетическим путем, обозначают как алло-аминокислоты:
 |
L-треонин D-треонин L-алло-треонин D-алло-треонин
2-(S), 3-(R) 2-(R), 3-(S) 2-(S), 3-(S) 2-(R), 3-(R)
 |
Симметричная аминокислота цистин может существовать в трех формах: L-, D- и внутренне компенсированной оптически неактивной – мезо-форме. Природный L-цистин образуется в организме при окислении цистеина, что играет большую роль в формировании нативной структуры белка при его посттрансляционном созревании:

L-цистин D-цистин
мезо-цистин
По участию в синтезе белка in vivo аминокислоты делятся на протеиногенные и непротеиногенные. Протеиногенными называют аминокислоты, которые включаются в состав белков в ходе биосинтеза в рибосомах под генетическим контролем информационной РНК. Их ровно 20, и все они относятся к L-ряду (табл.1.1). В то же время из природных белков выделено к настоящему времени около 30 аминокислот, например L-оксипролин, L-цистин, L-β-оксиглутаминовая кислота и др.:
 |
L-Оксипролин L-β-оксиглутаминовая кислота
4(R)-гидрокси-2(S)-пролин 3(R)-гидрокси-2(S)-глутаминовая кислота
Этот факт объясняется тем, что линейная немодифицированная полипептидная цепь превращается в полноценный функциональный белок в результате многостадийного процесса (созревание), который начинается сразу же после начала трансляции. В процессе созревания белка осуществляются различные ферментативные реакции, такие, как окисление, фосфорилирование, N-гликозилирование, взаимодействие с белками связывания (шапероны – белки, направляющие процесс свертывания цепи). В результате процесса созревания образуются характерные для данного белка вторичная и третичная структуры.
 Например, предшественник коллагена – линейный проколлаген – прежде чем превратиться в коллаген, вступает в ряд ферментативных реакций. Он подвергается окислению, которое заключается в гидроксилировании остатков пролина и лизина, а также в образовании дисульфидных мостиков между остатками цистеина. Эти процессы обеспечивают правильное скручивание полипептидных цепей в тройную спираль коллагена.
Например, предшественник коллагена – линейный проколлаген – прежде чем превратиться в коллаген, вступает в ряд ферментативных реакций. Он подвергается окислению, которое заключается в гидроксилировании остатков пролина и лизина, а также в образовании дисульфидных мостиков между остатками цистеина. Эти процессы обеспечивают правильное скручивание полипептидных цепей в тройную спираль коллагена.
Таблица 1.1
– Протеиногенные аминокислоты
| № п/п | R | Название | Сокращенные обозначения |
| H | Глицин | Gly, (G) | |
| CH3 | Аланин | Ala, (A) | |
| HOCH2 | Серин | Ser, (S) | |
| HSCH2 | Цистеин | Cys, (C) | |
| HOOCCH2 | Аспарагиновая кислота | Asp, (D) | |
| H2NOCCH2 | Аспарагин | Asn, (N) | |

| Фенилаланин** | Phe, (F) | |

| Тирозин | Tyr, (Y) | |
| Триптофан ** | Trp, (W) | |

| Гистидин | His, (H) | |
| (CH3)2CH | Валин ** | Val, (V) | |
| CH3HOCH | Треонин ** | Thr, (T) | |
| CH3SCH2CH2 | Метионин ** | Met, (M) | |
| HOOCCH2CH2 | Глутаминовая кислота | Glu, (E) | |
| H2NOCCH2CH2 | Глутамин | Gln, (Q) | |
| (CH3)2CHCH2 | Лейцин ** | Leu, (L) | |
| CH3CH2(CH3)CH | Изолейцин ** | Ile, (I) | |
| (H2N)HN=CNH(CH2)2CH2 | Аргинин | Arg, (R) | |
| H2N(CH2)3CH2 | Лизин ** | Lys, (K) | |
| 20* | 
| Пролин | Pro, (P) |
* Приведена формула пролина; ** Незаменимые аминокислоты.
Коферментом, участвующим в процессе окисления остатков L-пролина в проколлагене, является аскорбиновая кислота, дефицит которой вызывает торможение процесса образования коллагена из проколлагена (заболевание – цинга, рис.1.1).

Р и с.1.1. Гидроксилирование остатка пролина в проколлагене:
1 – фермент – проколлагенпролин-4-диоксигеназа-[аскорбат];
2 – остаток L-пролина; 3 – остаток -4-гидрокси-L-пролина (оксипролина);
4 – аскорбиновая кислота; 5 – дегидроаскорбиновая кислота
Кроме протеиногенных и образующихся из них аминокислот, входящих в состав белка, но не являющихся протеиногенными, в организмах обнаружено большое количество непротеиногенных аминокислот, которые не входят в состав белков. Только в растениях и микроорганизмах обнаружено более 200 аминокислот алифатического ряда. Приведем лишь несколько примеров, иллюстрирующих большое разнообразие непротеиногенных аминокислот (рис.1.2). Среди них обнаружены соединения и с различными циклами, в том числе гетероциклами, и с непредельными связями, и с такими элементами, как хлор, бром, йод, селен, и аналоги протеиногенных аминокислот с D-конфигурацией. Что касается D-энантиомеров протеиногенных аминокислот, таких, как D-аланин, D-валин, D-цистеин, D-фенилаланин, D-глутамин и другие, то такие аминокислоты часто входят в состав полипептидных антибиотиков, продуцируемых микроорганизмами, и являются компонентами клеточных стенок многих бактерий.
По кислотно-основным свойствамаминокислоты делятся на кислые, нейтральные и основные. Нейтральные аминокислоты содержат в своей структуре одинаковое количество основных и кислотных групп. В структуре кислых аминокислот количество кислотных групп превышает количество основных, а структуре основных наоборот – количество основных групп превышает количество кислотных. Из протеиногенных аминокислот кислым характером обладают аспарагиновая и глутаминовая кислоты, основным – гистидин, аргинин и лизин, а остальные 15 аминокислот имеет кислотно-основные свойства близкие к нейтральным. Количественной интегральной мерой кислотно-основных свойств является величина pI – изоэлектрическая точка (о pI см. табл. 1.3 в п. 1.1.3).
 1-Аминоциклопропанкарбоновая кислота
1-Аминоциклопропанкарбоновая кислота
(биогенный источник этилена в растениях)
 Селеноцистеин (активный центр
Селеноцистеин (активный центр
глутатионпероксидазы)
 |
Иботеновая кислота (яд мухомора)
 |
γ-Метилен-L-глутаминовая
кислота (арахис, тюльпаны)
 |
Витамин U (капуста)
 |
Тироксин (гормон щитовидной
железы)
Р и с.1.2. Некоторые непротеиногенные аминокислоты
По потребности организма человека в аминокислотах их делят на заменимые и незаменимые. 8 из 20 протеиногенных аминокислот не синтезируются в организме человека и должны поступать вместе с пищей. Эти аминокислоты называют незаменимыми (отмечены ** в табл. 1.1).
Номенклатура природных аминокислот характеризуется широким распространением тривиальных названий. По мере открытия аминокислот, выделяемых из продуктов гидролиза различных белков, они получали название в зависимости от своих характерных свойств или происхождения белка. Например, аспарагин (от греч. аsparagos – спаржа), глицин (гликокол, от греч. glucos – сладкий). Названия, составленные по систематической номенклатуре, малоупотребительны из-за своей громоздкости. Например, триптофан по систематической номенклатуре называется α-амино-β-индолилпропионовая кислота. Но даже более короткие тривиальные названия являются слишком длинными при обозначении аминокислотной последовательности полипептидов. В связи с этим приняты международные сокращенные трехбуквенные обозначения аминокислот, а в 1968 г. комиссией IUPAC-IUB рекомендовано при написании аминокислотных последовательностей белков использовать однобуквенные обозначения аминокислот (см. табл.1.1).
1.1.2. Биологические функции аминокислот
В живых организмах аминокислоты выполняют ряд функций, важнейшими из которых являются следующие:
- структурные элементы белков;
- структурные элементы других природных соединений;
- исходные соединения для образования в организмах биогенных аминов и родственных соединений;
- нейромедиаторы и медиаторы;
- метаболиты.
Структурные элементы белков. В состав белков входят 20 протеиногенных аминокислот (см. табл. 1.1), последовательность которых кодируется генетическим кодом и которые постоянно обнаруживаются в белках. Некоторые из них подвергаются посттрансляционной модификации, т.е. могут быть фосфорилированы, ацилированы, гидроксилированы (см. рис. 1.1) и др.
Структурные элементы других природных соединений.Изучение биосинтеза пенициллина с использованием меченых атомов показало, что в образовании молекулы этого антибиотика принимают участие аминокислоты цистеин и валин (рис. 1.3).
 |
Цистеин
Р и с.1.3. Биосинтез пенициллина
Аминокислоты и их производные входят в состав различных азотистых соединений, коферментов, антибиотиков, пептидов и др. Например, фрагмент аминокислоты β-аланина (β-Ala) входит в структуру кофермента А (КоА), а глутаминовой кислоты – в структуру тетрагидрофолевой кислоты (кофермент THF):

β-Ala
Кофермент А (КоА)
Glu
Тетрагидрофолевая кислота (кофермент THF)
В живых организмах различных типов, и в особенности в животных, широко представлены пептиды. Среди них обнаружены соединения с разнообразными биологическими функциями (см. гл. 2 «Полипептиды»). Все пептиды, так же, как и белки, образуются из аминокислот, но в отличие от последних могут включать в себя не только протеиногенные аминокислоты, но и непротеиногенные, связанные друг с другом не только пептидными связями, но, например, сложноэфирными и др. В качестве примера приведем формулу простого линейного трипептида – глутатиона. Он присутствует во всех живых организмах и находится обычно в межклеточном пространстве в достаточно высокой концентрации:
 |
γ-L-Глутамил-L-цистеинил-глицин – глутатион (G-SH)
Так как он был выделен почти 80 лет назад, его физиологические функции изучены достаточно хорошо: он защищает тиольные группы белков, инактивирует радикальные частицы, разрушает перекисные соединения, выполняет роль кофермента метилглиоксилазы.
Исходные соединения для образования в организмах биогенных аминов и родственных соединений.Биогенные амины образуются в организме главным образом из протеиногенных аминокислот.В табл. 1.2 приведены некоторые протеиногенные аминокислоты и биогенные амины, образующиеся из них в результате реакции декарбоксилирования, а также последующих трансформаций:
 |
Таблица 1.2
Некоторые аминокислоты и биогенные амины, образующиеся из них
| Аминокислоты и образующиеся из них биогенные амины | Формула биогенного амина | Функции биогенных аминов в организме |
| Серин ¯ Коламин ¯ Холин ¯ Ацетилхолин | HOCH2CH2NH2 HOCH2CH2N(CH3)3ОН CH3COOCH2CH2N(CH3)3ОН | Входит в состав кефалина Входит в состав лецитина Медиатор, нейромедиатор |
| Цистеин ¯ Цистеамин | HSCH2CH2NH2 | Структурный элемент КоА и пантетеина |
| Аспарагиновая кислота ¯ β-Аланин | H2NCH2CH2COOH | Структурный элемент КоА |
| Триптофан ¯ 5-Окситриптофан ¯ Серотонин |

| Медиатор, нейромедиатор |
| Гистидин ¯ Гистамин | 
| Медиатор |
| Тирозин ¯ 3,4-Диоксифенил аланин (ДОФА) ¯ Дофамин ¯ Норадреналин ¯ Адреналин |

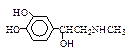
| Нейромедиатор Медиатор, нейромедиатор гормон Медиатор, нейромедиатор гормон |
| Треонин ¯ Аминопропанол | CH3CHOHCH2NH2 | Составная часть витамина В12 |
| Глутаминовая кислота ¯ (ГАМК) | H2NCH2CH2CH2COOH | Нейромедиатор |
| Аргинин ¯ Агматин ¯ Путресцин ¯ Спермидин ¯ Спермин | 



| Компонент рибосом Компонент рибосом, трупный яд Компонент рибосом Компонент рибосом |
| Лизин ¯ Кадаверин | H2NCH2CH2CH2CH2CH2NH2 | Компонент рибосом, трупный яд |
Нейромедиаторы и медиаторы. Термином медиатор обозначают вещества, передающие нервное возбуждение через синаптическую щель от одной клетки периферической нервной системы к соседней.Нейромедиаторы–это вещества, воздействующие на постсинаптическую мембрану синапса центральной нервной системы и вызывающие ее деполяризацию (передача нервного импульса) или, напротив, гиперполяризацию (торможение передачи нервного импульса). К нейромедиаторам относятся некоторые аминокислоты, а также пептиды, белки и биогенные амины (см. табл. 1.2).
В связи с этим в клетках головного мозга идет активный метаболизм аминокислот. В головном мозге концентрация аминокислот, в особенности выполняющих функции нейромедиаторов, в 7-8 раз выше, чем в плазме крови. Наиболее высоким является уровень глутаминовой и аспарагиновой аминокислот (5-10 ммоль и 2-3 ммоль соответственно).
К аминокислотам, выполняющим функции нейромедиаторов, относятся глицин, аспарагиновая кислота, глутаминовая кислота, ГАМК и ДОФА.
Метаболиты. Углеродные скелеты 20 протеиногенных аминокислот превращаются в процессе метаболизма в семь различных продуктов деградации.
1. Пировиноградная кислота – глицин, аланин, серин, цистеин, треонин,
(пируват) триптофан, метионин.
2. Щавелевоуксусная кислота – аспарагин, аспарагиновая кислота.
(оксалоацетат)
3. Фумаровая кислота – фенилаланина, тирозин.
(фумарат)
4. Сукцинил-КоА – изолейцин, Валин.
5. 2-Оксоглутаровая кислота – глутаминовая кислота, глутамин,
(2-оксоглутарат) гистидин, аргинин, пролин.
6. Ацетил-КоА – лейцин, лизин; изолейцин.
7. Ацетоуксусная кислота – лейцин, лизин, фенилаланин, тирозин,
(ацетоацетат) триптофан.
Пять метаболитов (пируват, оксалоацетат, фумарат, сукцинил-КоА, 2-оксоглутарат) являются предшественниками в процессе синтеза глюкозы (глюконеогенез). Аминокислоты, деградация которых дает один из пяти указанных выше метаболитов, называются глюкогенными аминокислотами. За исключением лейцина и лизина все остальные 18 протеиногенных аминокислот являются глюкогенными.
Ацетил-КоА и ацетоацетат не могут включаться в глюконеогенез. Они используются организмами для синтеза жирных кислот, изопреноидов и кетоновых тел (ацетон, ацетоуксусная кислота, 3-гидроксимасляная кислота). Аминокислоты, которые образуют ацетил-КоА или ацетоацетат, называют кетогенными аминокислотами. Фактически только кетогенными являются лейцин и лизин, а такие аминокислоты, как изолейцин, фенилаланин, тирозин и триптофан, могут быть и глюкогенами и кетогенами.
1.1.3. Физико-химические свойства аминокислот
В кристаллическом состоянии аминокислоты находятся в виде биполярных ионов (цвиттерионов). Вследствие этого они имеют высокие температуры плавления и большинство из них растворимы в воде лучше, чем в спирте (табл.1.3).
В водном растворе аминокислоты также присутствуют, главным образом, в виде цвиттерионов, которые находятся в равновесии с неионизированной формой, например, для глицина соотношение равновесных концентраций неионизированной и цвиттерионной форм равно 1:260000:

Неионизированная форма Цвиттерионная форма
Дикарбоновые аминокислоты и диаминокарбоновые кислоты существуют в водных растворах в виде смесей неионизированных и различно заряженных форм. Например, аспарагиновая кислота существует в виде следующих форм с соотношением концентраций:

1 600 1 28 000
В случае лизина устанавливается следующее равновесие:
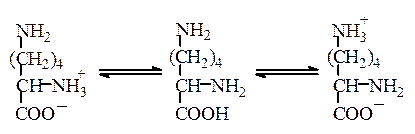 16
16
320 000 1 1 800 000
Аминокислоты гораздо лучше растворимы в водных растворах кислот и щелочей, чем в воде, что обусловлено их амфотерностью.
В кислой среде аминокислота ведет себя как основание с константой диссоциации сопряженной кислоты Ka (α-NH2) и заряжается положительно, а в щелочной – как кислота с константой диссоциации Ka (α-COOH) и заряжается отрицательно:

Поскольку в аминокислотах содержатся как минимум две ионогенные группы, суммарный заряд молекул зависит от pH среды. Проиллюстрируем зависимость заряда аминокислоты от рН на примере гистидина, содержащего три ионогенные группы. На рис. 1.4 приведена кривая титрования гистидина сильной кислотой и щелочью, на которой отмечаются три точки перегиба, соответствующие трем ионизирующимся группировкам (COOH, NH2, имидазольное кольцо).





Р и с.1.4. Кривая титрования гистидина сильной кислотой и щелочью
Таблица 1.3