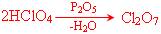|
|
Метод електронного балансу урівнювання окисно-відновних реакцій
Записують рівняння реакції у молекулярній формі:
КМnO4 + KNO2 + H2SO4 =
Перманганат калію містить Манган у вищому ступені окиснення, тому може бути тільки окисником. Нітрит калію містить N+3, це проміжний ступінь окиснення і в даному випадку, якщоMn+7 – окисник, то N+3 може бути тільки відновником. Відновлення Mn+7 у кислому середовищі може проходити до Mn+2, а окиснення NO2- до NO3-. Отже, запишемо продукти реакції:
KMn+7O4 + KN+3O2 + H2SO4 Mn+2SO4 +KN+5O3 + K2SO4 + H2O.
Позначимо ступені окиснення речовин, в яких вони змінюються. Далі визначаємо кількість електронів, які віддає відновник і приєднує окисник – складаємо електронний баланс:
Окисник: Mn+7 +5  = Mn+2 5 2; відновлення.
= Mn+2 5 2; відновлення.
Відновник: N+3 -2  = N+5 2 5; окиснення.
= N+5 2 5; окиснення.
Коефіцієнти у рівнянні біля окисника 2, біля відновника – 5:
2KMnO4 + 5KNO2 + 3H2SO4 = K2SO4 + 2MnSO4 + 5KNO3 + 3H2O
Спочатку знаходять коефіцієнти біля всіх катіонів (крім Н+), потім аніонів. Потім підраховують число атомів Н, а перевіряють правильність за числом атомів Оксигену.
Основні класи неорганічних сполук. Оксиди. Назви, класифікація, добування, властивості.
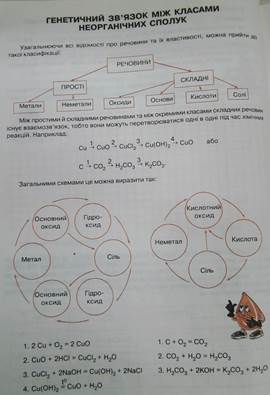

Оксиди - бінарні (подвійні) сполуки Кисню з іншими елементами, в яких Кисень проявляє ступінь окислення -2.
Класифікація оксидів за кислотно-основними властивостями
Утворюють солі
Основні
K2O, MgO, CuO
Амфотерні
Al2O3, ZnO, PbO
Кислотні
CO2, P2O5, Mn2O7
Не утворюють солей
CO, N2O, NO
Зверніть увагу!
* Утворення основних оксидів характерне для лужних металів, Mg і лужноземельних металів, а також для d-елементів у ступенях окислення +1 і +2 (за виключенням Zn).
* Утворення амфотерних оксидів - для Zn, Sn, Pb, Be, Al, а також для d-елементів у ступенях окислення +3 і +4.
* Утворення кислотних оксидів - для неметалів і d-елементів у ступенях окислення +5 і вище.
Отримання оксидів
1. Безпосередня взаємодія простих речовин з молекулярним киснем:
2Zn + O2 = 2ZnO;
Fe + O2 = Fe2O3;
P + O2 = P2O5.
2. Термічна дисоціація гідроксидів:
2Fe(OH)3 = Fe2O3 + 3H2O;
H2SiO3 = SiO2 + H2O;
Cu(OH)2 = CuO + H2O.
3. Термічна дисоціація солей:
Cu(NO3)2 = CuO + 2NO2 + 1/2O2;
(CuOH)2CO3 = 2CuO + CO2 + H2O;
2Fe(NO3)3 = Fe2O3 + 3NO2 + 9/2O2.
Зверніть увагу!
* Нестабільні оксиди, такі як, наприклад, Ag2O, N2O5, Mn2O7 або Cl2O7 за даними методами не утворюються.
Оксид Срібла звичайно отримують за реакцією:
2ANO3 + 2NaOH = Ag2O + H2O + NaNO3;
Оксид Нітрогену отримують при дії P2O5 на концентровану азотну кислоту:
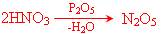
Оксид Мангану утворюється при дії концентрованої сірчаної кислоти на KMnO4:
2KMnO4 + 2H2SO4 = Mn2O7 + 2KHSO4 + H2O;
Оксид Хлору отримують при дії P2O5 на концентровану хлорну кислоту: