 |
|
Кислоти, основи, солі в світлі теорії електролітичної дисоціації. Протолітична теорія кислот і основ.
Розглянемо у світлі теорії електролітичної дисоціації властивості речовин, які у водних розчинах виявляють властивості електролітів.
Кислоти. Для кислот характерні наступні загальні властивості:
здатність взаємодіяти з основами з утворенням солей;
здатність взаємодіяти з деякими металами з виділенням водню;
здатність змінювати кольори індикаторів, зокрема, викликати червоне забарвлення лакмусу;
кислий смак.
При дисоціації будь-якої кислоти утворюються іони водню. Тому всі властивості, які є загальними для водних розчинів кислот, ми повинні пояснити присутністю гідратованих іонів водню. Це вони викликають червоний колір лакмусу, повідомляють кислот кислий смак і т.д. З усуненням іонів водню, наприклад при нейтралізації, зникають і кислотні властивості. Тому теорія електролітичної дисоціації визначає кислоти як електроліти, диссоциирующие в розчинах з утворенням іонів водню.
У сильних кислот, диссоциирующих без остачі, властивості кислот проявляються в більшій мірі, у слабких — меншою. Чим краще кислота дисоціює, тобто чим більше її константа дисоціації, тим вона сильніша.
Величини констант дисоціації кислот змінюються в дуже широких межах. Зокрема, константа дисоціації ціановодорода багато менше, ніж оцтової кислоти. І хоча обидві ці кислоти — слабкі, все ж оцтова кислота значно сильніше ціановодорода. Величини першої та другої констант дисоціації сірчаної кислоти показують, що стосовно першого ступеня дисоціації H 2 SO 4 — сильна кислота, а щодо другої — слабка. Кислоти, константи дисоціації яких лежать в інтервалі 10 -4 — 10 -2, іноді називають кислотами середньої сили. До них, зокрема, відносяться ортофосфорна і сірчиста кислоти (щодо дисоціації за першого ступеня).
Підстави. Водні розчини підстав володіють такими загальними властивостями:
здатністю взаємодіяти з кислотами з утворенням солей;
здатністю змінювати кольори індикаторів інакше, ніж їх змінюють кислоти (наприклад, вони викликають синє забарвлення лакмусу);
Своєрідним «мильною» смаком.
Оскільки спільним для всіх розчинів підстав є присутність у них гідроксид-іонів, то ясно, що носієм основних властивостей є гідроксид-іон. Тому з точки зору теорії електролітичної дисоціації підстави — це електроліти, диссоциирующие в розчинах з відщепленням гідроксид-іонів.
Сила підстав, як і сила кислот, залежить від величини константи дисоціації. Чим більше константа дисоціації даної підстави, тим воно сильніше.
Існують гідроксиди, здатні вступати у взаємодію і утворювати солі не тільки з кислотами, але і з основами. До таких гідроксиду належить гідроксид цинку. При взаємодії його, наприклад, з соляною кислотою виходить хлорид цинку:
Zn (OH) 2 + 2 НС l = ZnС l 2 + 2 Н 2 О
а при взаємодії з гідроксидом натрію — цінкат натрію:
Zn (OH) 2 + 2 NaOH = Na 2 ZnО 2 + 2 Н 2 О
Гідроксиди, які володіють цією властивістю, називаються амфотерними гідроксидами або амфотерними електролітами. До таких гідроксиду, крім гідроксиду цинку, відносяться гідроксиди алюмінію, хрому і деякі інші.
Явище амфотерности пояснюється тим, що в молекулах амфотерних електролітів міцність зв’язку між металом і киснем незначно відрізняється від міцності зв’язку між киснем і воднем. Дисоціація таких молекул можлива, отже, по місцях обох цих зв’язків. Якщо позначити амфотерний електроліт формулою ROH, то його дисоціацію можна виразити схемою
Н + + RO — ↔ ROH ↔ R + + OH -
Таким чином, у розчині амфотерного електроліту існує складна рівновага, в якому беруть участь продукти дисоціації як за типом кислоти, так і за типом підстави.
Явище амфотерности спостерігається також серед деяких органічних сполук. Важливу роль воно відіграє у біологічної хімії; наприклад, білки — амфотерні електроліти.
Солі. Солі можна визначити як електроліти, які при розчиненні у воді дисоціюють, отщепляя позитивні іони, відмінні від іонів водню, і негативні іони, відмінні від гідроксид-іонів. Таких іонів, які були б спільними для водних розчинів усіх солей, немає, тому солі і не володіють загальними властивостями. Як правило, солі добре дисоціюють, і тим краще, чим менше заряди іонів, які утворюють сіль.
При розчиненні кислих солей у розчині утворюються катіони металу, складні аніони кислотного залишку, а також іони, що є продуктами дисоціації цього складного кислотного залишку, у тому числі іони Н +. Наприклад, при розчиненні гідрокарбонату натрію дисоціація протікає відповідно до наступних рівнянь:
NaHCO 3 = Na + + HCO 3 -
HCO 3 — = Н + + CO 3 2 -
При дисоціації основних солей утворюються аніони кислоти і складні катіони, що складаються з металу і гидроксогрупп. Ці складні катіони також здатні до дисоціації. Тому в розчині основної солі присутні іони ОН -. Наприклад, при розчиненні хлориду гідроксомагнія дисоціації протікає відповідно до рівнянь:
MgOHCl = MgOH + + З l -
MgOH + = Mg 2 + + ОН -
Таким чином, теорія електролітичної дисоціації пояснює загальні властивості кислот присутністю в їх розчинах іонів водню, а загальні властивості підстав — присутністю в їх розчинах гідроксид-іонів. Це пояснення не є, однак, загальним. Відомі хімічні реакції, що протікають за участю кислот і підстав, до яких теорія електролітичної дисоціації непридатна: Зокрема, кислоти і підстави можуть реагувати один з одним, не будучи дисоційований на іони. Так, безводний хлороводень, що складається тільки з молекул, легко реагує з безводними підставами. Крім того, відомі речовини, які не мають у своєму складі гидроксогрупп, але проявляють властивості основ. Наприклад, аміак взаємодіє з кислотами і утворює солі (солі амонію), хоча в його складі немає груп ОН. Так, з хлороводородом він утворює типову сіль — хлорид амонію:
NH 3 + HC1 = NH 4 C1
Вивчення подібного роду реакцій, а також реакцій, що протікають у неводних середовищах, призвело до створення більш загальних уявлень про кислотах і підставах. До найважливіших з сучасних теорій кислот і підстав належить протонна теорія, висунута в 1923 р.
Згідно протонної теорії, кислотою є донор протона, тобто частка (молекула або іон), яка здатна віддавати іон водню — протон, а підставою — акцептор протона, тобто частка (молекула або іон), здатна приєднувати протон. Співвідношення між кислотою і підставою визначається схемою:
Підстава + Протон ↔ Кислота
Пов’язані цим співвідношенням підставу і кислота називаються сполученими. Наприклад, іон HSO 4 — є підставою, сполученим кислоті H 2 SO 4.
Реакцію між кислотою і підставою протонна теорія являє схемою:
(Кислота) 1 + (Підстава) 2 = (Кислота) 2 + (Підстава) 1
Наприклад, в реакції
HC1 + NH 3 = NH 3 + + З l -
іон З l — підстава, поєднане кислоті НС1, а іон NH 3 + — кислота, сполучена підставі NH 3.
Істотним у протонної теорії є те положення, що речовина проявляє себе як кислота або як підставу в залежності від того, з яким іншим речовиною воно вступає в реакцію. Найважливішим чинником при цьому є енергія зв’язку речовини з протоном. Так, у низці NH 3 — Н 2 О — HF ця енергія максимальна для NH 3 і мінімальна для HF. Тому в суміші з NH 3 вода функціонує як кислота, а в суміші з HF — як підстава:
NH 3 + Н 2 О = NH 4 + + ОН -
HF + Н 2 О = F — + Н 3 О +
Осно́вні оксиди
Основні оксиди — це оксиди, яким відповідають основи. Основними оксидами є, наприклад, Na2O, CaO, MgO, K2O. Декотрі оксиди легко взаємодіють з водою з утворенням відповідних основ:
CaO + H2O → Ca(OH)2
K2O + H2O → 2KOH.
Оксиди Fe2O3, CuO, Ag2O з водою не взаємодіють, однак вони нейтралізують кислоти і тому вважаються основними.
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
CuO + H2SO4 → CuSO4 + H2O
Характерною хімічною властивісттю основних оксидів є їхня взаємодія з кислотами, при цьому, як правило, утворюються сіль і вода
FeO + 2HCl → FeCl2 + H2O
При взаємодії з кислотними і амфотерними оксидами утворюють солі, а між собою не взаємодіють. Наприклад:
СаО + СО2 = СаСО3
Na2O + ZnO = Na2ZnO2
Основні оксиди утворюються тільки металами з низькою валентністю (не вище 3+ ). Більшість основних оксидів з водою безпосередньо не взаємодіють, за винятком оксидів лужних і лужноземельних металів, які реагують з водою. Усім основним оксидам відповідають основи, тобто гідроксиди, які проявляють властивості основ.
Кислотні оксиди
До кислотних оксидів відносять такі оксиди, які взаємодіють з основними та амфотерними оксидами, а також з їх гідроксидами з утворенням солей. Наприклад:
P2О5 + 3СаО → Са3(РО4)2
SO3 + ZnO → ZnSO4
CO2 + 2NaOH → Na2СО3 + Н2О
Кислотні оксиди називають звичайно ангідридами (зневодненими кислотами), вказуючи цим, що їх можна одержати з кислот, віднімаючи від них елементи води. Кислотні оксиди утворюються неметалами та деякими металами, які проявляють змінну валентність. Валентність металів у кислотних оксидах буває, від 4+ до 7+. Наприклад CrO3 — хроматний ангідрид (валентність хрому 6+ ), Mn2O7 — ангідрид марганцю (валентність марганцю 7+ ) і т. д.
Деякі кислотні оксиди взаємодіють з водою, утворюючи відповідні гідроксиди, тобто кислоти. Є кислотні оксиди, які не взаємодіють з водою. Наприклад, SiO2 практично не розчинний у воді, однак він нейтралізує основи, тому є кислотним оксидом
2NaOH + SiO2 →сплавлення Na2SiO3 + H2O
Гідроксиди, тобто кислоти, тих кислотних оксидів, що безпосередньо з водою не взаємодіють, одержують посереднім шляхом.
Амфотерні оксиди
Амфотерними називають такі оксиди, які взаємодіють як з кислотами, так і з основами, утворюючи сіль і воду. При взаємодії з кислотами вони поводять себе як основні оксиди, а при взаємодії з основами — як кислотні.
ZnO + H2SO4 → ZnSO4 + H2О
ZnO + 2NaOH → Na2ZnO2 + H2О
З водою амфотерні оксиди не взаємодіють. Амфотерні оксиди утворюються тільки металами з валентністю від 2+ до 4+. До амфотерних оксидів належать ZnO, SnO, PbO, Al2О3, SnO2, PbO2 і ін.
Отже, неметали утворюють тільки кислотні оксиди, а метали можуть утворювати основні, амфотерні і кислотні. Причому для металів із змінною валентністю існує така залежність: при низькому валентному стані металу (не вище 3+ ) він утворює основний оксид, при високому валентному стані (від 4+ до 7+ ) він утворює кислотний оксид, а при проміжному (звичайно від 2+ до 4+ ) він утворює амфотерний оксид. Основні, кислотні і амфотерні оксиди називають ще солетвірними, бо вони при взаємодії з кислотами або основами утворюють солі.
Перша допомога при отруєнні полягає у винесенні потерпілого на свіже повітря, проведенні штучного дихання.
Гідроліз солей — різновид реакцій гідролізу, обумовленого протіканням реакцій іонного обміну в розчинах (переважно, водних) розчинних солей-електролітів. Рушійною силою процесу є взаємодія іонів з водою, що приводить до утворення слабкого електроліту в іонному або (рідше) молекулярному вигляді («зв’язування іонів»).
ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ КИСЛОТ, СОЛЕЙ І ОСНОВ.
Бесіда.
Виходячи зі структурної формули натрій сульфату, визначте найбільш полярний зв'язок. На які іони буде дисоціювати натрій сульфат?
Розповідь учителя.
У натрій сульфаті найбільш полярним є зв'язок між Натрієм і Оксигеном, отже, у розчині саме він буде розриватися. Зв'язок між Сульфуром і Оксигеном є слабкополярним (різниця електронегативностей дуже мала), отже, при дисоціації вона розриватися не буде.
При дисоціації солей утворюються катіони металів і аніони кислотних залишків. Рівняння електролітичної дисоціації солей виглядає так:
Nа2SО4↔ 2Nа++S042-.
Бесіда.
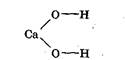
Виходячи зі структурної формули кальцій гідроксиду, визначте найбільш полярний зв'язок. На які іони буде дисоціювати кальцій гідроксид?
Розповідь учителя.
У кальцій гідроксиді найбільш полярним є зв'язок між Кальцієм та Оксигеном, отже, у розчині саме він буде розриватися. Зв'язок між Гідрогеном і Оксигеном є слабкополярним (різниця електронегативностей невелика), отже, при дисоціації він розриватися не буде.
При дисоціації основ утворюються катіони металів і гідроксид-аніони. Рівняння електролітичної дисоціації основ виглядає так:
Са(ОН)2↔ Са2++2OH-.
З точки зору теорії електролітичної дисоціації Арреніуса, основами називаються сполуки, при дисоціації яких утворюються гідроксид-іони.
Бесіда.
Р 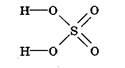 озглянувши структурну формулу сульфатної кислоти, визначте найбільш полярний зв'язок. На які іони буде дисоціювати сульфатна кислота?
озглянувши структурну формулу сульфатної кислоти, визначте найбільш полярний зв'язок. На які іони буде дисоціювати сульфатна кислота?
Розповідь учителя.
У сульфатній кислоті найбільш полярним є зв'язок між Гідрогеном і Оксигеном, отже, у розчині саме він буде розриватися. Зв'язок між Сульфуром та Оксигеном є слабкополярним (різниця електронегативностей дуже мала), отже, при дисоціації він розриватися не буде.
При дисоціації кислот утворюються катіони Гідрогену й аніони кислотних залишків. Рівняння електролітичної дисоціації сульфатної кислоти виглядає таким чином:
Н2SО4↔2Н++SO42-.
З точки зору теорії електролітичної дисоціації Арреніуса, кислотами називаються сполуки, при дисоціації яких утворюються іони Гідрогену.

Гідроліз солей.
Взаємодія солі з водою, яка призводить до утворення слабкого або погано розчинного електроліту, називається гідролізом солі. Причиною гідролізу солей є зміщення рівноваги дисоціації молекул води в бік утворення малодисоційованих сполук.
Реакції гідролізу звичайно відбуваються без зміни ступеня окиснення. Сумарний ефект гідролізу визначається природою наявних у розчині катіонів й аніонів. За невеликим винятком, майже всі солі є сильними електролітами. Це значить, що незалежно від того, взаємодією якої кислоти чи основи вони отримані, у воді солі дисоціюють практично повністю.
А. Гідроліз солей, утворених взаємодією сильних основ і слабких кислот.У солей, утворених сильними основами і слабкими кислотами, відбувається гідроліз по аніону, а розчиницих солей мають лужну реакцію (рН більше 7).
При розчиненні у воді солі ціанистоводневої кислоти і сильної основи, наприклад КСN, сіль дисоціює на іони:
КСN K+ + CN-.
Виникнення лужної реакції розчину стає зрозумілим із рівняння гідролізу в іонній формі. Його пишуть, враховуючи, що воду і ціанистоводневу кислоту, як слабкі електроліти, слід писати у вигляді молекул, а КСN і КОН – у вигляді іонів:
К+ + СN- + Н2О К+ + ОН- + НСN;
повне іонне рівняння, або кінцево:
СN- + Н2О НСN + ОН-;
скорочене іонне рівняння.
Подібно КСN, розчин СН3СООNа також має лужну реакцію, що видно з рівняння гідролізу:
СН3СОО- + НОН СН3СООН + ОН-.
Б. Гідроліз солей, утворених дією сильної кислоти і слабкої основи.У солей, утворених сильною кислотою і слабкою основою, відбувається гідроліз по катіону, а розчини таких солей мають кислу реакцію (рН менше 7).
У водних розчинах таких солей відбувається зв’язування ОН- -іонів води і накопичування Н+-іонів у розчині, наприклад:
CuCl2 Cu2+ + 2Cl-;
Cu2+ + 2Cl- + HOH CuOH+ + 2Cl- + H+;
Cu2+ + HOH CuOH+ + H+.
В. Гідроліз солей, утворених взаємодією слабкої основи і слабкої кислоти.Солі, утворені слабкою кислотою і слабкою основою, в розчинах не існують (гідролізують повністю).
У цьому випадку зв’язуються ОН- і Н+ - іони води
СН3СООNH4 СH3COO- + NH4+;
СН3СОО- + NH4 + + НОН СН3СООН + NH4OH.
У цьому випадку гідроліз відбувається повністю внаслідок того, що вже не один, а одразу два процеси зсувають рівновагу іонізації води. Переконатися в цьому можна по запахурозчину СН3СООNH4, який одночасно пахне оцтовою кислотою і аміаком.
Г. Солі, утворені взаємодією сильної основи і сильної кислоти.Якщо сполука при дисоціації в розчині утворює катіони й аніони сильних основ та кислот, гідроліз практично не відбувається, і рН середовища не змінюється.
У такому випадку можна сказати, що солі сильної основи і сильної кислоти гідролізу не піддаються, так як при розчиненні їх у воді не відбувається зв’язування ні Н+, ні ОН-, які виникають в результаті дисоціації води.
Отже, рН розчинів солей, утворених сильними основами і сильними кислотами, таке ж, як у чистої води (рН7).