 |
|
Реакції в розчинах електролітів. Напрям таких реакцій.
Згідно з положеннями теорії електролітичної дисоціації Арреніуса при розчиненні у воді електроліти дисоціюють на іони. Позитивно заряджені іони називають катіонами, до них належать іони металів, амонію і водню. Негативно заряджені іони називають аніонами; до них належать іони кислотних залишків і гідроксильні іони. Як і молекули розчинника, іони в розчині перебувають у стані невпорядкованого теплового руху.
Процес електролітичної дисоціації зображають, користуючись хімічними рівняннями. Наприклад, дисоціація HCl виразиться рівнянням:
HCl Н+ + Cl-.
Теорії Арреніуса протистояла хімічна або гідратна теорія розчинів Менделєєва, в основі якої лежало уявлення про взаємодію розчиненої речовини з розчинником. Російськийфізхімік І.О. Каблуков об’єднав фізичну і хімічну теорію розчинів і вперше висловив припущення про гідратацію іонів. Іони утворюють з водою (коли вода є розчинником) нестійкі сполуки –гідратовані іони. Отже, при розчиненні електролітів молекули розщеплюються на іони; іони взаємодіють з молекулами розчинника. При цьому обидва процеси – дисоціація і гідратація – відбуваються одночасно.
При дисоціації кислот утворюються іони гідроксонію:
HCl + H2O H3O+ + Cl-.
Гідроксоній
Ступенем дисоціації електроліту називається відношення числа його молекул, що продисоціювали на іони, до загального числа його молекул в розчині.
= Сдис/Сзаг,
де Сдис – число молів продисоційованого електроліту (моль/л);
Сзаг – загальна концентрація електроліту (моль/л).
З цього виразу видно, що 0< < 1. (може бути виражений в процентах). Величина ступеня дисоціації залежить від:
- хімічної природи речовини;
- концентрації розчину;
- природи розчинника.
За величиною ступеня дисоціації 0,01 – 0,1 н розчинів усі електроліти поділяють на сильні і слабкі. До сильних електролітів належать електроліти, які у водних розчинах дисоційованіпрактично повністю ( > 50 %). (Поняття ступеня дисоціації до них по суті і не може бути застосоване). Це більшість солей, HClO4, HBF4, HNO3, HCl, HBr та інші кислоти, гідроксиди лужних і лужноземельних металів. Слабкі електроліти дисоціюють частково ( < 3 %).. До них належать більшість органічних кислот, H2CO3, H2S, HCN, NH4OH та інші. Характерною особливістю слабких електролітів є встановлення хімічної рівноваги між іонами і молекулами розчиненої речовини:
СН3СООН СН3СОО- + Н+.
Для рівноваги, яка встановлюється в розчині слабкого електроліту між молекулами й іонами, можна записати вираз константи рівноваги. Дисоціації оцтової кислоти відбувається за рівнянням:
СН3СООН СН3СОО- + Н+.
Константа рівноваги має вигляд:
 .
.
Константа рівноваги, що відповідає дисоціації слабкого електроліту, називається константою дисоціації (див. табл. 5 Додатків). Вона залежить від природи електроліту, природи розчинника, температури розчину, але не залежить від концентрації електроліту.
Константа рівноваги характеризує здатність кислоти або основи розпадатися на іони: чим вище К, тим легше електроліт дисоціює.
Багатоосновні кислоти і багатокислотні основи дисоціюють ступінчасто. У розчинах цих кислот встановлюються складні рівноваги, в яких беруть участь іони різного заряду.
Н2СО3 Н+ + НСО3-, НСО3- Н+ + СО32-,
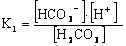 ,
, 
К1 . К2 =Кдис.,
де К1, К2 – ступінчасті константи дисоціації, а Кдис. – сумарна константа дисоціації.
 .
.
При ступінчастій дисоціації речовин наступний (другий) ступінь характеризується меншим розпадом, ніж попередній (перший), тобто К1 К2.
Між константою і ступенем дисоціації встановлено зв’язок, відомий як закон розведення Оствальда. Розглянемо дисоціацію слабкого електроліту СН3СООН:
СН3СООН СН3СОО- + Н+
Нехай, С – концентрація оцтової кислоти, моль/л,
- ступінь дисоціації оцтової кислоти.
[CH3COO-] = [H+] = Cмоль/л, оскільки = Сдис./Сзаг., концентрація недисоційованої оцтової кислоти буде дорівнювати С - С = С(1 - ) моль/л. Тоді для константи дисоціації оцтової кислоти отримаємо вираз:
 .
.
Це рівняння є математичним виразом закону розведення.
Якщо електроліт є дуже слабким, то 1, тоді lim(1-) = 1, а закон розведення записують так:

3 останього рівняння чітко випливає, що із зменшенням концентрації електроліту ступінь його дисоціації зростає.
Іонний добуток води–це добуток концентрації (активності) іонів Н+ та ОН-, який у будь-якому водному розчині є величина стала:
[H+] . [OH-] = Kw = 10-14.
Після логарифмування отримємо:
lg[H+] + lg[OH-] = lg10-14.
рН = - lg[H+] – водневий показник розчину.
рОН = - lg[ОH-] – гідроксильний показник розчину.
рН + рОН = 14.
У нейтральному середовищі концентрації іонів гідрогену і гідроксилу рівні, тому рН = рОН = 7, у кислому - рН<7, у лужному - рН>7.