 |
|
Сульфур. Знаходження в природі. Добування. Властивості сірки.
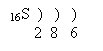
Електронна конфігурація 1s22s22p63s23p4
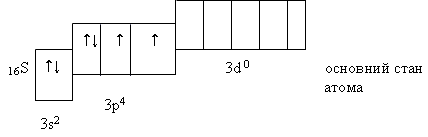
Розміщення електронів зовнішнього енергетичного рівня за енергетичними комірками:

|
Ізотопи:32S (95%), 33S, 34S, 36S
У природі Сульфур зустрічається у вигляді самородної сірки, піриту, сульфідів, сульфатів.
Поширення в природі. Сульфур широко розповсюджений у природі. Він становить 0,05 % маси земної кори. У вільному стані (самородна сірка) у великих кількостях трапляється в Італії (острів Сицілія) і США. У Росії родовища самородної сірки є в Куйбишевській області (Поволжя), в республіках Середньої Азії, в Криму та інших районах.
Сульфур часто трапляється у вигляді сполук з іншими елементами. Найважливішими його природними сполуками є сульфіди металів: FeS2 — залізний колчедан, або пірит; ZnS — цинкова обманка; PbS — свинцевий блиск; HgS — кіновар тощо, а також солі сульфатної кислоти (кристалогідрати): CaSO4 ∙ 2Н2О — гіпс, Na2SO4 ∙ 10H2O — глауберова сіль, MgSC4 ∙ 7Н2О — гірка сіль тощо.
Сульфур міститься в організмах тварин і рослин, оскільки входить до складу білкових молекул. Органічні сполуки сульфуру містяться в нафті.
Фізичні властивості. Сірка — тверда крихка речовина жовтого кольору. У воді практично нерозчинна, але добре розчиняється у сірковуглеці, аніліні, деяких інших розчинниках. Погано проводить теплоту й електричний струм. Сірка утворює кілька алотропічних модифікацій.
При 444,6°С сірка кипить, утворюючи пару темно-бурого кольору. Якщо її швидко охолодити, то утворюється тонкий порошок, що складається з найдрібніших кристаликів сірки і називається сірчаним цвітом.
Природна сірка складається з суміші чотирьох стійких ізотопів; 3216S, 3316S, 3416S, 3616S.
Хімічні властивості. Атом сульфуру, маючи незавершений зовнішній енергетичний рівень, може приєднувати два електрони і виявляти ступінь окиснення —2. Такий ступінь окиснення сульфур виявляє у сполуках з металами і воднем (наприклад, Na2S і H2S).При відщепленні або зміщенні електронів до атома більш електронегативного елемента ступінь окиснення сірки може бути +2, +4 і +6.
За звичайних умов молекула твердої сірки складається з 8 атомів Se, що замикаються в кільце (при цьому атоми сульфуру в кільці не лежать в одній площині). При нагріванні кільце S8 розривається. При високих температурах існують обривки ланцюгів: S2 (> 900°С), S ⇆ 2S (> 1500°С). У парі сірки існує рівновага між молекулами S8, S6, S4 і S2.
Будовою молекули сірки зумовлена різноманітність її фізичних станів. Так, утворення пластичної сірки пояснюється тим, що частина кілець-молекул розривається і ланцюжки, які виникли, сполучаються один з одним у довгі ланцюги. В результаті утворюється високомолекулярна сполука — полімер з каучукоподібною еластичністю (порівняйте з полімеризацією каучуку, див. § 16.9).
Сірка легко утворює сполуки з багатьма елементами. При згорянні її на повітрі або в кисні утворюється оксид сульфуpy(IV) SO2 і частково оксид сульфуру(VІ) SO3:
S + О2 = SO2 і 2S + ЗО2 = 2SO3.
Це найважливіші оксиди сульфуру.
При нагріванні сірка безпосередньо сполучається з воднем, галогенами (крім йоду), фосфором, вугіллям, а також з усіма металами, крім золота, платини й іридію. Наприклад:
S + Н2 = H2S; 3S + 2Р = P2S3; S + Сl2 = ЗСl2;
2S + С = CS2; S + Fe = FeS.
Як випливає з прикладів, у реакціях з металами і деякими неметалами сірка є окисником, а в реакціях з більш активними неметалами, такими, наприклад, як кисень, хлор, — відновником.
Застосування. Сірка широко застосовується у промисловості й сільському господарстві. Близько половини її видобутку використовується для добування сульфатної кислоти. Використовують сірку для вулканізації каучуку: каучук набуває підвищеної міцності й пружності. У вигляді сірчаного цвіту (тонкого порошку) сірка застосовується для боротьби з хворобами виноградників і бавовнику. Вона використовується для виготовлення пороху, сірників, світних сумішей.
У медицині виготовляють сірчані мазі для лікування шкірних хвороб.
Сірка
Хімічний елемент Сульфур утворює дві алотропні модифікації – ромбічнуі моноклінну сірку. Обидві складаються з молекул S8.

Рис.2.9.8.Кристалічні форми сірки: а – ромбічна; б – моноклінна.