 |
|
Сполуки Сульфуру з Оксигеном. Сульфур діоксин. Сульфітна кислота.
У сполуках з Оксигеном S, Se, Те проявляють ступінь окиснення +4 та +6, утворюючи діоксиди та пероксиди.
Наприклад: SO2, SeO2, ТеО2, SO3, SeO3, ТеО3.
У ряду SO2®SeO2®ТеО2 спостерігається послаблення кислотних властивостей. SO2- сульфур діоксид (сірчистий газ) – прозорий газ з задушливим запахом. У промисловості SO2 добувають прожарюванням на повітрі сульфідів металів. При розчиненні сірчистого газу у воді утворюється сульфітна (сірчиста) кислота:
SО2 + Н2О = Н2SО3.
У ряду SО2 → SeО2 → ТеО2 → PoO2 чітко спостерігається послаблення кислотних властивостей. SO2 і SeO2 розчиняються у воді, утворюючи сульфітну і селенітну кислоту, TeO2 - не розчиняється у воді, a PoO2 поводить себе як основний оксид.
SO2 і SeO2 взаємодіють з основними оксидами і гідроксидами, утворюючи солі - сульфіти і селеніти. SO2 проявляє властивості окисника і відновника:
2SO2 + О2 = 2SО3 - SO2 – відновник;
2H2S + SO2 = 2Н2О + S - SО2 – окисник.
У лабораторії SО2 можна отримати при дії концентрованої Н2SO4 на мідну стружку:
Cu + 2H2SO4 = CuSO4 + SО2 + 2Н2О.
Н2SО3 існує тільки в розбавлених розчинах. На повітрі Н2SО3 та при дії брому та калій перманганату окиснюється до Н2SО4.
2Н2SО3 + О2 = 2H2SO4
Сульфітна кислота проявляє окисно-відновну двоїстість:
Н2SО3 + Сl2 + Н2О = H2SO4 + 2НС1 – відновник;
Н2SО3 + 2H2S = 3S + 3H2O – окисник.
Н2SО3 утворює середні солі - сульфіти та кислі - гідросульфіти. Сульфіти активних металів при нагріванні розкладаються з утворенням сульфідів і сульфатів:
4Na2SO3 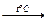 Na2S + 3Na2SO4.
Na2S + 3Na2SO4.
S, Se, Те з Оксигеном утворюють триоксиди, які при взаємодії з водою утворюють відповідні кислоти - H2SO4 - сульфатну, Н2SeО4 -селенатну та Н6ТеО6 - гексаоксотелуратну.
SО3 – сульфур триоксид (сірчаний ангідрид) - прозора рідина з tкип = 45оC. SО3 можна одержати окисненням SO2 за наявності каталізатора.
2SO2 + О2  2SО3
2SО3
Сульфатний ангідрид добре розчиняється в концентрованій сульфатній кислоті, утворюючи олеум. Вміст SО3 в олеумі складає 60%. Концентрована сульфатна кислота - важка масляниста прозора рідина, що активно поглинає вологу, обвуглює органічні речовини (клітковину, цукор).
У промисловості сульфатну кислоту одержують окисненням сульфур діоксиду до триоксиду (за наявності каталізатора) і подальшою взаємодією SО3 з водою:
2SO2 + О2 = 2SО3;
H2O + SО3 = Н2SО4.
Н2SО4(конц.) є сильним окисником. Вона взаємодіє з неметалами (С, S, Р, Si), окиснюючи їх до відповідних кислот:
С + 2H2SO4 = СО2 + 2SO2 + 2Н2О.
Активні метали відновлюють Сульфур в Н2SО4 (конц.) до вільної сірки або H2S.
4Zn + 5H2SO4конц. = 4ZnSO4 + H2S + 4H2O.
Менш активні метали (Cu, Ag, Hg) відновлюють Сульфур в сульфатній кислоті до S+4 (SO2):
Cu + 2H2SO4= CuSО4 + SO2+ 2Н2О.
H2SО4 (конц.) окиснює галогеноводневі кислоти і їх солі до вільних галогенів:
2НВr + H2SО4(конц.) = Вr2 + SO2 + 2Н2О;
8НІ + H2SO4(конц.) = 4I2 + H2S + 4Н2О.
Розбавлена H2SО4 не є окисником, і метали, що стоять у ряду напруг до Гідрогену, здатні взаємодіяти з нею із виділенням водню:
Fe + Н2SО4(розв.) = FeSO4+ Н2↑.
Н2SО4 - двоосновна кислота, здатна утворювати середні солі-сульфати та кислі - гідросульфати. Всі солі сульфатної кислоти добре розчинні у воді за винятком солей Ва, Са, Sr, Pb. Практичне значення має тіосульфатна кислота Н2S2О3 та її сіль Na2 S2О3 • 5Н2О - натрій тіосульфат. Кип'ятінням натрій сульфіту з сіркою можна отримати натрій тіосульфат:
Nа2SО3 + S = Na2S2O3.
Натрій тіосульфат при взаємодії з соляною кислотою утворює спочатку слабку тіосульфатну кислоту, яка розкладається з утворенням вільної сірки:
Na2S2О3 + 2НС1 = H2S2O3 + 2NaCl;
Н2S2О3 = Н2О + SO2 + S↓.
Сильні окисники окиснюють натрій тіосульфат до сульфатної кислоти або її солі:
Na2S2О3 + 4Cl2 + 5 Н2О = 2 H2SО4 + 2NaCl + 6HCl.
Менш сильні окисники окиснюють натрій тіосульфат до натрій тетратіонату:
I2 + 2 Na2SО3 = 2NaI + Na2S4О6.
Ця реакція застосовується в кількісному аналізі - методі йодометрії для кількісного визначення деяких окисників і відновників.
механічний тиск, і камінь розривається зсередини.
Високий вміст SO2 в повітрі безпосередньо впливає і на зростання захворюваності людей, і на зростання смертності. Встановлена пряма залежність між концентрацією SO2 в повітрі і частотою захворювання населення хронічним бронхітом, яка зростає при сумісній дії SO2 і пилу, а також оксидів Нітрогену.
Діоксид сульфуру токсичний не тільки для людини і тварин, а й для рослин, причому їх чутливість до шкідливої дії SO2 проявляється при менших концентраціях ніж у тварин. Поглинання SO2 рослинами призводить до порушення їх життєдіяльності, зокрема процесу фотосинтезу і деяких інших енергетичних процесів.
Так, при дії SO2 в різних концентраціях і з різною експозицією спостері-галися такі зміни:
· 0,3 години – зменшення фіксації вуглекислого газу;
· 24 години – зменшення відкриття продихів;
· 1350 годин – пошкодження листя.
Дослідження показали, що пошкодження рослин в більшому ступені залежить від концентрації ніж від експозиції. Короткочасний вплив високих концентрацій зустрічається невчасно. Головну небезпеку для рослинності становить хронічний вплив низьких концентрацій SO2, які розповсюджу-ються на дуже великих територіях. При поглинанні SO2 в клітинах утворю-ється сірчиста кислота, яка дисоціює на іони HSO3- і SO32-.
При високих концентраціях SO2, очевидно, перший з наслідків полягає в деградації хлорофілу та хлоропластів, різкому погіршенні обміну речовин й можливій швидкій загибелі рослин. Стійкість рослин до SO2 визначається двома факторами — активністю продиху листка та швидкості адсорбції SO2 на поверхні листка, а також спроможності переводити токсичний сульфіт в неактивний сульфат.