 |
|
Хірургічні інструменти

Хірургічні інструменти. Рис. 1. Скальпель черевцевий. Рис. 2. Скальпель гострокінцевий. Рис. 3. Ампутаційний ніж. Рис. 4. Резекционный ніж. Рис. 5. Ножиці прямі загострені. Рис. 6. Ножиці тупокінцеві. Рис. 7. Ножиці зігнуті. Рис. 8. Ножиці, вигнуті по площині. Рис. 9. Ножиці з вузьким лезом, вигнуті по площині. Рис. 10. Ножиці для розрізання перев'язувального матеріалу. Рис. 11. Ножиці з ґудзиком. Рис. 12. Пінцет хірургічний. Рис. 13. Пінцет лапчатая. Рис. 14. Пінцет анатомічний. Рис. 15. Затискач кровоспинний прямої з нарізкою. Рис. 16. Затискач кровоспинний вигнутий з нарізкою. Рис. 17. Затискач кровоспинний прямої з нарізкою і зубцями. Рис. 18. Затискач кровоспинний вигнутий з нарізкою і зубцями. Рис. 19. Затискач кровоспинний типу «Москіт» з прямими губками. Рис. 20. Затискач кровоспинний типу «Москіт» з вигнутими губками. Рис. 21. Щипці кровоспинні для розчавлювання тканин. Рис. 22. Зонд зобный. Рис. 23. Зонд гудзиковий з вушком. Рис. 24. Зонд гудзиковий двосторонній. Рис. 25. Зонд жолобуватий. Рис. 26. Гачки пластинчасті. Рис. 27. Гачок тупий, двозубою. Рис. 28. Гачок тупий четирехзубие. Рис. 29. Гачок гострий двозубою. Рис. 30. Гачок гострий четирехзубие. Рис. 31. Зажим для прикріплення операційного білизни. Рис. 32. Затискач з кремальерой для прикріплення операційного білизни. Рис. 33. Зажим для прикріплення серветок до очеревині. Рис. 34. Затискач з кремальерой для прикріплення серветок до очеревині. Рис. 35. Голки хірургічні шкірні. Рис. 36. Голки хірургічні крутовигнуті. Рис. 37. Голки хірургічні кишкові вигнуті. Рис. 38. Голки хірургічні кишкові прямі. Рис. 39. Голка лігатурна тупа права. Рис. 40. Голка лігатурна гостра права. Рис. 41. Голкотримач з вигнутою ручкою і кремальерой малий. Рис. 42. Голкотримач з вигнутою ручкою і кремальерой великий. Рис. 43. Голкотримач для глибоких порожнин. Рис. 44. Дужки металеві Мішеля. Рис. 45. Щипці для накладення і зняття дужок. Рис. 46. Автопинцет для накладання металевих дужок. Рис. 47. Коловорот з набором фрез. Рис. 48. Электротрепан. Рис. 49. Кусачки Єгорова - Фрейдина. Рис. 50. Кусачки з напівкруглими губками потужні. Рис. 51. Кусачки нейрохірургічні. Рис. 52. Кусачки Дальгрена. Рис. 53. Ранорасширитель універсальний з набором многозубчатых і плоских губок. Рис. 54. Пила дротяна ручка до неї. Рис. 55. Провідник для дротяних пил. Рис. 56. Затискач кровоспинний нейрохірургічний вигнутий. Рис. 57. Ножиці нейрохірургічні, вигнуті по ребру і по площині. Рис. 58. Пінцет нейрохірургічний вигнутий.

Хірургічний інструментарій. Рис. 59-97. Рис. 59. Пінцет окончатый для захоплювання пухлин мозку. Рис. 60. Шпатель нейрохірургічний. Рис. 61. Ложка гостра для видалення пухлин мозку. Рис. 62. Кюретка нейрохірургічна двостороння для видалення пухлин мозку. Рис. 63. Канюлі для проколу шлуночків головного мозку. Рис. 64. Щипці для накладення кліпсі магазином (оправа). Рис. 65. Трубки аспіраційні нейрохірургічні. Рис. 66. Набір інструментів для біполярної коагуляції. Рис. 67. Распатор реберний. Рис. 68. Ножиці реберні. Рис. 69. Стернотом. Рис. 70. Ранорасшпритель для грудної порожнини рейковий. Рис. 71. Ранорасширитель для грудної порожнини гвинтовий. Рис. 72. Дзеркало дротове для відведення легенів і серця. Рис. 73. Щипці для захоплення легені. Рис. 74. Бронхофиксатор. Рис. 75. Затискачі прямий і вигнутий для клиноподібної резекції легені. Рис. 76. Дзеркало для відведення серця. Рис. 77. Зажим для вушка серця. Рис. 78. Комиссуротом - ніготь. Рис. 79. Вальвулотом з двома ножами. Рис. 80. Розширювач для звужених отворів серця. Рис. 81. Вилка для спускання лігатури. Рис. 82. Дзеркало для черевної стінки. Рис. 83. Дзеркало для відведення печінки. Рис. 84. Затискач кишковий еластичний прямій. Рис. 85. Затискач кишковий жорсткий. Рис. 86. Кишковий Жом який роздавлює. Рис. 87. Затискач для жовчного міхура. Рис. 88. Ложки для видалення жовчних каменів. Рис. 89. Троакари. Рис. 90. Дзеркало ректальне. Рис. 91. Щипці гемороїдальні окончатые. Рис. 92. Голки для взяття і переливання крові. Рис. 93. Голка Кассирокого. Рис. 94. Апарати для тривалих крапельних вливань (дані в іншому масштабі). Рис. 95. Наконечники для відсмоктування. Рис. 96. Щипці для біопсій. Рис. 97. Шпатель.
28. первичная хирургическая обработка раны заключается в иссечении краев, стенок и дна ее в пределах здоровых тканей с восстановлением анатомических соотношений.
Первичная хирургическая обработка начинается с рассечения раны. Окаймляющим разрезом шириной 0,5—1 см иссекают кожу и подкожную клетчатку вокруг раны и разрез кожи продлевают вдоль оси конечности по ходу сосудисто-нервного пучка на протяжении, достаточном для того, чтобы можно было осмотреть все слепые карманы раны и иссечь нежизнеспособные ткани. Далее пдоль разреза кожи рассекают фасцию и апоневроз /-образным или дугообразным разрезом. Это обеспечивает хороший осмотр раны и уменьшает сдавление мышц нследствие их отека, что особенно важно при огнестрельных ранах.
После рассечения раны удаляют обрывки одежды, сгустки крови, свободно лежащие инородные тела и приступают к иссечению размозженных и загрязненных тканей.
Мышцы иссекают в пределах здоровых тканей. Нежизнеспособные мышцы темно-красного цвета, тусклые, не кровоточат на разрезе и не сокращаются при дотраги-иании пинцетом.
Неповрежденные крупные сосуды, нервы, сухожилия при обработке раны должны быть сохранены, с их поверхности осторожно удаляют загрязненные ткани. (1вободно лежащие в ране мелкие костные осколки удаляют, острые, лишенные надкостницы, выступающие в рану концы костных отломков скусывают кусачками. При обнаружении повреждений сосудов, нервов, сухожилий восстанавливают их целостность. При проведении обработки раны необходима тщательная остановка кровотечения. Если при хирургической обработке раны нежизнеспособные ткани и инородные тела полностью удалены, рану зашивают (первичный шов).
29. Набор инструментов, материалов, медикаментов для первичной хирургической обработки раны. Набор инструментов для первичной хирургической обработки раны Показания. Случайная рана. Оснащение: - стерильные: корнцанг – 2 шт, цапки для белья – 4 шт, пинцеты хирургические – 2 шт, пинцеты анатомические – 2 шт, шприц (10 мл) – 2 шт, скальпель – 1 шт, ножницы – 2 шт , кровоостанавливающие зажимы – 4-6 шт, крючки Фарабефа – 2 шт, острозубые крючки – 2 шт, иглы режущие – 4 шт, иглы колющие – 4 шт, зонд желобоватый – 1 шт, зонд пуговчатый – 1 шт, шовный материал, бикс с перевязочным материалом, перчатки, дренажи; - другие: антисептики для кожи (кутасепт, йодонат), антисептики для раны (3% раствор перекиси водорода, 0,06% раствор гипохлорита натрия), 70% этиловый спирт, препарат для дезинфекции инструментов (дезактин, неохлор), препарат для местного обезболивания (лидокаин, новокаин). ТЕХНИКА ВЫПОЛНЕНИЯ ПЕРВИЧНОЙ ХИРУРГИЧЕСКОЙ ОБРАБОТКИ РАНЫ 1. Уложить больного на кушетку, операционный стол. 2. Надеть стерильные перчатки. 3. Взять пинцет и тампоном, смоченным эфиром или нашатырным спиртом, очистить кожу вокруг раны от загрязнения. 4. Сухим тампоном или тампоном, смоченным перекисью водорода (фурацилином), удалить свободнолежащие в ране инородные тела и сгустки крови. 5. Тампоном, смоченным йодонатом (спиртовым раствором хлоргексидина), обработать операционное поле от центра к периферии. 6. Отграничить операционное поле стерильным бельем. 7. Тампоном, смоченным йодонатом (спиртовым раствором хлоргексидина), обработать операционное поле. 8. С помощью скальпеля рассечь рану на протяжении. 9. Иссечь, по возможности, края, стенки и дно раны, удалить все поврежденные, загрязненные, пропитанные кровью ткани. 10. Заменить перчатки. 11. Рану отграничить стерильной простыней. 12. Заменить инструментарий. 13. Тщательно перевязать кровоточащие сосуды, крупные – прошить. 14. Решить вопрос о наложении швов: а) наложить первичные швы (рану прошить нитками, края раны свести, нитки завязать); б) наложить первично-отсроченные швы (рану прошить нитками, края раны не сводить, нити не завязывать, повязка с антисептиком). 15. Обработать операционное поле тампоном, смоченным йодонатом (спиртовым раствором хлоргексидина). 16. Наложить сухую асептическую повязку. Выполнить перевязку чистой раны.
30. Невідкладна допомога.
Насамперед постраждалого звільняють від контакту з електрострумом (якщо це не зроблено раніше). Вимикають джерело електроживлення, а якщо це неможливо, відкидають обірваний провід діелектричним предметом (дерев'яним сухим ціпком). Якщо той, хто надає допомогу, одягнений у гумові чоботи і гумові рукавички, то можна відтягнути потерпілого від електропроводу. При зупинці дихання проводять штучне дихання, вводять серцево-судинні засоби (0,1% розчин адреналіну - 1 мл, 10% розчин кофеїну -1 мл підшкірно), засоби, що стимулюють дихання (1% розчин лобеліну - 1 мл внутрівенно чи повільно внутрішньом'язово), потім накладають стерильну пов'язку на електроопікову рану.
Штучне дихання продовжують киснево-повітряною сумішшю чи чистим киснем через маску, внутрівенно вводять 40% розчин глюкози з 0,5 мл 0,006% розчину корглікону. Штучне дихання не припиняють протягом тривалого часу. При зупинці серця - непрямий масаж серця, 0,1 % розчину адреналіну - 1 мл і 10 мл 10% розчину хлориду кальцію.
Госпіталізація.
Транспортування в положенні лежачи на ношах в опікове чи хірургічне відділення.
31. Ускладнення
Такі ж, як при в/в ін’єкціях. Інфекції асоційовані з катетером →розд. 18.8.
Підготовка пацієнта і місця пункції вени
Такі ж, як при в/в ін’єкціях.
Забезпечення
Таке ж, як при в/в ін’єкціях, замість голки – катетер (канюля) для периферичних вен. У дорослих застосовують канюлі розмірами: 22 G (голубий, Ø 0,8 мм), 20 G (рожевий, Ø 1,0 мм), 18 G (зелений, Ø 1,2 мм), 17 G (білий, Ø 1,4 мм), 16 G (сірий, Ø 1,7 мм) i 14 G (оранжевий, Ø 2,0 мм); найчастіше використовуються канюлі 18 G i 20 G. Катетери більшого діаметру дають можливість швидшої інфузії розчинів. Для крапельної інфузії – набір, який містить трубку із затискачем і невеликий резервуар із загостреною кінцівкою для введення у пляшку (контейнер) з інфузійним розчином (розчином ЛЗ); при необхідності краплемір і трьохходовий краник. Для безперервного введення – шприцевий дозатор (інфузомат, інфузійна помпа), подовжувач для інфузії, відповідний шприц (50, 20 або 10 мл; у деяких шприцевих дозаторах [інфузоматах] можна застосовувати тільки визначені моделі [типи] шприців) і трьохходовий краник.
Техніка
1. Виберіть відповідну периферичну вену.
2. Накладіть (зазвичай на плече) джгут, щоб наповнити вени. Візуалізацію і пункцію вени може полегшити зігрівання кінцівки і масаж (поплескування) місця пункції. Можна також попросити пацієнта про кількаразове стиснення руки в кулак і її розслаблення.
3. Помийте та обробіть руки, одягніть одноразові рукавички. Обробіть та дезінфікуйте шкіру в місці ін’єкції серветкою, змоченою дезінфікуючим засобом. Нанесіть на шкіру дезінфікуючий засіб із розпилювача на відстані 20‑30 см, почекайте ≈1–1,5 хв (якщо загальний стан хворого не вимагає негайної катетеризації вени).
4. Натягніть шкіру, потягуючи її великим пальцем або пальцями однієї руки нижче місця уколу. Введіть канюлю на голці у вену під кутом ≈30º до поверхні шкіри. (мал. 24.5-1).

Канюляція периферичних вен
5. Після появи краплі крові на кінці голки, утримуючи голку нерухомо однією рукою, іншою введіть канюлю по голці до судини, витягніть голку і звільніть джгут. Якщо голка з катетером вводилась повільно, то кров може з’явитись на кінці голки, тоді коли в просвіті судини знаходиться лише сама голка, а кінець канюлі (коротший від голки) є ще поза судиною. У такому випадку просуньте голку з катетером далі на ≈1 мм, зафіксуйте голку і розпочніть проводити канюлю по голці до судини.
6. Переконайтесь в прохідності канюлі шляхом аспірації крові та введенням невеликої кількості 0,9% розчину NaCl.
7. Зафіксуйте канюлю до шкіри лейкопластиром або спеціальною пов’язкою (мал. 24.5-2).
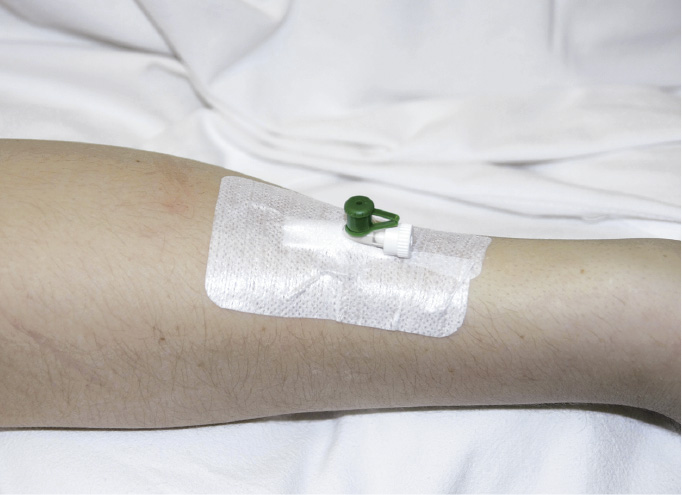
Фіксація канюлі пластиром
8. Занотуйте дату і годину введення канюлі у відповідних документах (або на пов’язці).
9. Введення ЛЗ
1) струминне введення (болюс) – дотримуючись стерильності, наберіть у шприц необхідний ЛЗ і відповідно його розведіть (якщо потрібно), та зазвичай, повільно вводьте через канюлю. При необхідності ліки можна вводити через звичайну голку (техніка, як при заборі крові звичайною голкою та шприцом, після аспірації крові у шприц введіть ЛЗ). Якщо увесь ЛЗ, що знаходиться в шприці не використано, і припускаєте необхідність ще одного введення, закрийте конус шприца стерильною голкою із ковпачком і підпишіть шприц (назва ЛЗ, доза у мг/мл); переконайтесь як довго і в яких умовах можна зберігати приготований розчин.
2) краплинне введення – дотримуючись стерильності, приготуйте розчин препарату в інфузійній рідині (запишіть назву і дозу розведеного ЛЗ на пляшці або контейнері), заповніть систему (трубка із невеликим резервуаром) цим розчином, таким чином, щоб видалити повітря і наповнити резервуар до половини, під'єднайте систему до катетера (зазвичай за допомогою трьохходового краника, раніше наповненого розчином), встановіть бажану швидкість введення за допомогою затискача або краплеміра.
3) безперервне введення – зберігаючи стерильність, приготуйте розчин ЛЗ в шприці, заповніть подовжувач (лінію) таким чином, щоб видалити повітря, під'єднайте подовжувач (лінію) до катетера (зазвичай за допомогою трьохходового краника), старанно зафіксуйте раніше підписаний шприц в шприцевому дозаторі (інфузоматі) (повинен бути видимим надпис – назва ЛЗ, повна доза або в мг/мл), встановіть швидкість введення (на вашому робочому місці повинні бути підготовані таблиці для розрахунку необхідної дози ЛЗ, що найчастіше призначаються на швидкість введення у мл/год [або хв]) та розпочніть введення.
10. Після кожного введення ЛЗ слід промити канюлю 0,9% NaCl. Не використовуйте повторно ті самі заглушки. Замініть пов’язку, якщо вона промокла. При появі місцевих запальних змін, больових відчуттів або гарячки негайно видаліть канюлю. Лікування флебіту поверхневих вен →розд. 2.30.
11. Після видалення канюлі слід дезінфікувати і затиснути місце її введення; накласти невелику (самоклеючу) пов’язку, щоб зупинити кровотечу
32. Проба на індивідуальну сумісність проводиться наступним чином: на чисту суху чашку Петрі наносяться дві краплі сироватки хворий і в кожну з них додається по маленькій краплі (в 5-10 разів менше) донорської крові. Краплі перемішують, після чого чашку Петрі ставлять на 10 хв на водяну баню при температурі від 46°. Результат оцінюється при хорошому освітленні на білому тлі відразу після того, як чашку Петрі вийняли з водяної бані. Якщо аглютинація еритроцитів відсутня, кров можна переливати, вона сумісна. Наявність аглютинації свідчить про те, що кров несумісна і переливати її не можна.
При проведенні проби на індивідуальну сумісність можуть бути допущено дві помилки. Перша полягає в тому, що іноді проба читається не відразу після зняття чашки Петрі з водяної бані, а через якийсь проміжок часу. У цьому випадку при охолодженні її може з'явитися неспецифічна, так звана помилкова, аглютинація. Кров помилково буде визнана несумісною. Ця помилка не заподіє шкоди безпосередньо хворий. Вона з'явиться лише причиною відстрочки початку гемотрансфузії - потрібно повторне проведення проби або підготовка до переливання інший ампули крові.
Друга помилка більш серйозна за своїми наслідками і виникає із-за того, що крапля донорської крові береться рівної величини або навіть більше кількості сироватки хворий. В цьому випадку можна не помітити аглютинацію еритроцитів і перелити несумісну кров.
33. Как проводится проба на совместимость по резус-фактору?
После проведения первой пробы необходимо провести пробу на совместимость по Rh-фактору. Для этого существует 2 доступных метода - реакция в сывороточной среде и в желатине.
Первый метод: на чашку Петри наносят 1-2 капли сыворотки больного и маленькую каплю донорской крови, после чего ее на 10 минут ставят в водяную баню (+46~+48 'С). Наличие агглютинации свидетельствует о несовместимости.
Второй метод: на дно пробирки помещают маленькую каплю донорской крови, добавляют 2 капли подогретого 10 % раствора желатина и 2 капли сыворотки крови больного. Через 10 минут инкубирования в водяной бане при. температуре +46-+48 'С в пробирку добавляют 5 мл подогретого изотонического раствора хлорида натрия. 'Наличие агглютинации свидетельствует о несовместимости крови донора и реципиента.
Следует отметить, что изоиммунные антитела и антитела других систем выявляются теми же методами, что и антитела анти-Rh, а некоторые - как антитела системы АВО. Поэтому несовместимость крови донора по этим антителам может быть выявлена при выполнении указанных проб на совместимость.
34. БИОЛОГИЧЕСКАЯ ПРОБА
Существует большое количество второстепенных групповых систем, которые могут стать причиной развития осложнений. Для исключения этой возможности в начале гемотрансфузии проводится еще одна проба на совместимость — биологическая проба.
Вначале струйно переливают 10-15 мл крови, после чего трансфузию прекращают (перекрывают капельницу) и в течение 3-х минут наблюдают за состоянием больного. При отсутствии клинических проявлений реакции или осложнения (учащение пульса, дыхания, появление одышки, затрудненное дыхание, гиперемия лица и т. д.) вводят вновь 10-15 мл крови и в течение 3 минут снова наблюдают за больным. Так повторяют трижды.
Отсутствие реакций у больного после трехкратной проверки являтся признаком совместимости вливаемой крови и служит основанием для осуществления всей гемотрансфузии.
При несовместимости крови донора и реципиента во время биологической пробы поведение пациента становится беспокойным: появляется тахикардия, одышка, гиперемия лица, ощущение озноба или жара, стеснение в груди, боли в животе и очень важный признак — боли в поясничной области.
При появлении этих признаков кровь считают несовместимой и гемотрансфузию не проводят.
35. Кровь должна быть разделена на 3 слоя: сверху – желтая прозрачная плазма, внизу слой осевших эритроцитов, между ними – тонкий слой в виде линий из лейкоцитов и тромбоцитов.
· Если плазма мутная, с хлопьями – это говорит об инфицированности крови. Переливать кровь нельзя.
· Если содержимое контейнера все однородно красное – это говорит о гемолизе. Переливать кровь нельзя.
· Кровь проверяется на наличие сгустков. Если они обнаружены, то кровь переливать нельзя.
36. Определение резус-фактора экспресс-методом
· В последнее время для определения резус-принадлежности применяют экспресс-метод. Реакцию проводят в пробирках без подогрева. Для этого необходима специальная, универсальная для всех групп крови системы АВО сыворотка, приготовленная особым способом на полиглюкине.
· В пробирку помещают 1 каплю сыворотки, добавляют 1 каплю исследуемых эритроцитов и после 3-минутного покачивания заливают 3—5 мл изотонического раствора хлорида натрия, трижды переворачивают пробирку и определяют результат в отраженном свете. Наличие агглютинации свидетельствует о наличии Rh-антигена.
37.
Цоліклони анти-А і анти-В призначені для визначення груп крові людини системи АВО замість стандартних ізогем-аглютинативна сироваток.
Визначення груп крові системи АВО включає виявлення антигенів А і В в еритроцитах стандартнимиантитілами і виявлення аглютинінів в сироватці або плазмі досліджуваної крові стандартними еритроцитами. Антигени А і В визначають за допомогою Цоліклони анти-А і анти-В. У донорів обов'язково визначення не тільки антигенів в еритроцитах, але і агглютининов в сироватці (плазмі) за допомогою стандартних еритроцитів.
Основні властивості цоліклональних сироваток.
Цоліклони анти-А і анти-В є продуктом гібридомної клітинних ліній,отриманих в результаті злиття мишачих антітелообразующіх В-лімфоцитів з клітинами мишачої мієломи. Індивідуальні гібридомної лінії продукують гомогенні антитіла тільки одного класу імуноглобулінів, які повністю ідентичні за структурою та біологічної активності. Антитіла, які продукують клітинами одного клона (потомство однієї клітини), є моноклональними.
Довідка. Клональні антитіла.
Культура клітин однієї специфічності, що походять з одного лімфоцита, утворює клітини одного клону. Головне полягає в наступному: необхідно отримати від однієї клітини специфічні антитіла і напрацювати їх у необмеженій кількості. Складність полягає в подоланні двох завдань: по-перше, нормальні клітини після декількох ділень гинуть, по-друге, тільки ракові клітини здатні необмежено розмножуватися. Для вирішення цих двох несумісних проблем в 1975 році Г. Келер і К. Мільштейн створили клітинні гібриди, або гібридоми. Гібридоми - це злиття нормальних лімфоцитів у живильному середовищі з клітинами мієломи. Лімфоцити в цьому середовищі не гинуть, а від мієломної партнера отримують можливість нескінченно розмножуватися. Таким чином, гібридомної клан розмножується, а в результаті цього процесу утворюються моноклональні антитіла.
Лімфоцити, що несуть агтлютіноген А, Виробляють специфічне антитіло анти-А; лімфоцити, що несуть агтлютіноген В, виробляють специфічне антитіло анти-В.
Моноклональні анти-А і анти-В антитіла продукуються двома різними гібридоми. Цоліклони анти-А і анти-В є розведену асцітную рідина мишей-носіїв відповідної гібридоми, в якій містяться специфічні імуноглобуліни класу М (IgM), спрямовані проти группоспеціфіческіх антигенів А або В людини.
Таким чином, Цоліклони не містять антитіл іншої специфічності і тому не викликають неспецифічної поліагглютінаціі еритроцитів.
Авідність, то є час настання реакції аглютинації і її вираженість, у Цоліклони анти-А і анти-В вище, ніж у ізогемагглютінірующіх АВО-сироваток, особливо у випадку слабко виражених антигенів еритроцитів.
Цоліклони не є клітинами людських тканин, що виключає можливість інфекційного зараження.
Методика визначення груп крові за допомогою Цоліклони анти-А і анти-В.
Визначення груп крові системи АВО реагентами Цоліклони проводиться в нативної крові, стабілізованої за допомогою застосовуваних консервантів (глюгіцір, цітроглюкофосфат, гепарин та ін); в крові, взятої з пальця; в крові, взятої без консерванту. Найбільш чітка реакція аглютинації спостерігається при використанні високої концентрації еритроцитів.
Визначення групи крові проводиться в приміщенні з хорошим освітленням при температурі від +15 ° до +25 ° С. Реагенти не повинні зберігатися відкритими, так як при висиханні активність антитіл знижується. Не слід користуватися реагентами, якщо в них є нерозчинні пластівці або помутніння. Для кожного реагенту використовують свою марковану (анти-А або анти-В) піпетку. Визначення групи крові системи АВО проводиться звичайними методами на білій порцеляновій або будь-який інший планшетки з змочувані поверхнею.
Висока активність і авідність реагентів Цоліклони дозволяє застосовувати по одній серії реагентів анти-А і анти-В. На площину планшета або тарілку наносять Цоліклони анти-А і анти-В по дві краплі (01 мл) під відповідними написами: анти-А або анти-В. Поряд з краплями антитіл наносять досліджувану кров по одній маленькій краплі, приблизно в 10 разів менше (001 мл). У разі визначення групи крові, взятої з пальця або взятої без консерванту, необхідно брати велику кількість еритроцитів, тобто перші краплі з пальця (без сильного видавлювання) або вільні еритроцити з осаду згорнутої крові.
При визначенні групи крові антитіла і кров змішують скляною паличкою або кутом предметного скла, які промивають і насухо витирають перед розмішуванням кожної краплі. Спостереження за реакцією проводять при легкому погойдуванні протягом не більше 25 хвилини. Позитивний результат при визначенні групи крові виявляє себе агглютинацией (склеюванням) еритроцитів. При цьому агглютінати можна побачити без будь-яких пристосувань у вигляді дрібних червоних агрегатів, швидко зливаються і утворюють великі пластівці.
При негативній реакції визначення групи крові крапля залишається рівномірно забарвленою в червоний колір, агтлютінати в ній не виявляються. Аглютинація, зазвичай, визначається протягом перших 3-5 секунд. Незважаючи на це, спостереження за результатами необхідно вести не менше 25 хвилини через можливість більш пізнього настання аглютинації з еритроцитами, що містять слабкі різновиди антигенів А або В.
38. упу крові визначають за допомогою стандартних гемаглютинуючих сироваток, аглютиніни яких відомі, при доброму освітленні та температурі 20-25°С.
Для визначеня групи крові необхідні стандартні сироватки 0(І), А(ІІ), В(Ш) двох серій і АВ(ІУ) стандартна сироватка, їх ампули слід зберігати при температурі 4-6°С відповідно терміну зберігання; перед використанням ампули перевіряють - вміст має бути прозорий, без осаду. Відкриту ампулу можна зберігати 1 добу. Також потрібно мати тарілочку з поділками та позначенням усіх груп, ізотонічний розчин хлориду натрію, скляні палички, предметні скельця, піпетки.
Спочатку на тарілочку відповідно позначок наносять стандартні сироватки - по дві краплі кожної групи (двох різних серій). Кров вносять кутиком предметного скельця у стандартні сироватки та змішують. Кількість крові хворого має бути в 10 разів меншою від сироватки. Предмет для забору та змішування (предметне скельце, паличка) забороняється використовувати повторно. Тарілочку похитують 3 хв, після чого до кожної краплі додають одну краплю ізотонічного розчину, чекають ще 2 хв, періодично похитуючи тарілочку, після чого читають результат. Якщо аглютинація не наступила в жодній краплі, у хворого 0(І) група крові; якщо у хворого А(ІІ) або В(Ш) група, то аглютинація буде у всіх сироватках за винятком ідентичної групи. Якщо аглютинація відбулася у всіх стандартних сироватках, то досліджувана кров - АВ(ІУ) групи; тоді додатково перевіряють стандартною сироваткою АВ(ІУ) групи, з якою не повинна відбуватися аглютинація.
39. Повязки в иннете видео вк
40. Клеевые повязки. Для создания клеевой повязки используются различные клеящие вещества: клеол, резиновый клей, коллодий. При наложении клеевой повязки кожу вокруг стерильной марлевой салфетки, наложенной на рану, смазывают клеем и дают ему немного подсохнуть. После этого поверхность прикрывают растянутым куском марли и плотно его прижимают. Края марли, не прилипшие к коже, подрезают ножницами. Приклеивание перевязочного материала по всему периметру раны препятствует его смещению. Клеевая повязка не стягивает кожу, не оказывает раздражающего воздействия, поэтому ее можно применять многократно (меняя перевязочный материал). Перед повторным наложением клеевой повязки кожу очищают тампоном, смоченным в эфире.
Повязки с пленкообразующими веществами. Для выполнения такой повязки применяют разнообразные полимеризующиеся на воздухе вещества, содержащие в своем составе антисептики. Таким образом, эта повязка является смесью асептической и клеевой повязки. Чаще всего используют клей БФ-6, фурапласт, церигель, жидкость Новикова, лифузоль. Такая повязка одновременно эластичная и прочная, не вызывает стягивания и раздражения кожи, защищает рану от проникновения вторичной инфекции, позволяет наблюдать за состоянием раневой поверхности.
· 40. Главная
· Материалы для врачей
· Общее в медицине
· Хирургический инструмент
· Инструменты для трахеостомии