 |
|
КОНТРОЛЬ ЯКОСТІ ХАРЧОКОНЦЕНТРАТІВ СОЛОДКИХ СТРАВ
Аналіз якості готових виробів.Для характеристики якості готових виробів необхідно дати органолептичну оцінку відповідно до вимог Державного стандарту ДСТУ 2418:2003 за такими показниками: зовнішній вигляд (однорідність порошкоподібної маси для насипних концентратів; правильність форми, рівномірність за товщиною для брикетів), колір, смак і запах, консистенція; визначити фізико-хімічні показники: масову частку вологи, масову частку сахарози, загальну кислотність, об’єму вуглекислого газу в 5,0 г розпушувача для печива (лише напівфабрикати борошняних виробів). Крім того, регламентовано вміст металічних і мінеральних домішок. Зараженість шкідниками хлібних запасів і наявність сторонніх домішок не допускається.
Правила прийому і відбору проб обідніх страв наведено в лаб. 1
Робота 1.Визначення органолептичних показників третіх обідніх страв
Визначення органолептичних показників.Органолептичні показники оцінюють після приготування страви за наведеним на етикетці способом. Солодкі страви, як правило, споживають у холодному вигляді та аналізують за температури 20 ± 5 ºС.
Результати оформлюють у вигляді таблиці за формою, наведеною нижче:
Таблиця 3. Форма запису
| Показник | Характеристика показника за стандартом | Фактичний показник |
| Зовнішній вигляд | ||
| Колір | ||
| Смак і запах | ||
| Консистенція |
Робота 2.Визначення фізико-хімічних показників солодких страв
Визначення масової частки сахарози в харчових концентратах солодких страв. Для харчових концентратів солодких страв показник масової частки сахарози регламентує стандарт, оскільки вміст його в продуктах може досягати 64 % . У лабораторній практиці вміст сахарози визначають двома способами: хімічним і рефрактометричним.
Поняття про загальний цукор та редукуючі цукри наведені в підрозділі 2.3.5.
Всі хімічні методи визначення цукрів ґрунтуються на їх редукуючій здатності. Сахароза, як відомо, не є редукуючим цукром, але у процесі її розкладання утворюються еквівалентні кількості глюкози і фруктози, які містять глікозидний гідроксил:
C12H22O11 = C6H12O6 + C6H12O6.
Слід зазначити, що у харчових концентратах солодких страв, крім нередукуючої сахарози, можуть бути наявні інші цукри з редукуючою здатністю. Вони можуть бути, наприклад, внесені з такими рецептурними інгредієнтами, як плодово-ягідний екстракт, борошно, фруктові сиропи тощо. Враховуючи це, сахарозу в харчових концентратах солодких страв слід визначати у такій послідовності:
1) приготування водної витяжки з метою переведення цукрів досліджуваного концентрату у розчин;
2) визначення вмісту редукуючих цукрів у витяжці до гідролізу сахарози;
3) проведення гідролізу сахарози для утворення редукуючих глюкози і фруктози;
4) визначення загальної кількості редукуючих цукрів у витяжці;
5) розрахунок кількості сахарози за різницею між загальною кількістю редукуючих цукрів та їх кількістю до гідролізу.
Для приготування водної витяжки зважують аналітичну пробу зразка масою 1,00–10,00 г з розрахунку, що вміст цукру у витяжці буде в межах 0,3–1,0 %. Необхідну масу наважки розраховують за формулою 2.3.40, яка наведена в підрозділі 2.3.5 (2).
Для деяких концентрацій сахарози маси наважок продукту розраховані та подані нижче:
| Масова частка сахарози, % | |||
| Маса наважки, г | 2,5 | 2,0 | 1,3 |
Наважку кількісно переносять у мірну колбу місткістю 250 см3, заповнюють водою на 2/3 об'єму та витримують протягом 40–50 хв, часто збовтуючи для кращого переходу цукрів у розчин. Потім для осадження розчинних білкових та інших речовин у колбу додають по 10 см3 15 % розчину ZnSО4 та 4 % розчину КаОН. Про повноту осадження свідчить прозорість розчину над осадом. Якщо розчин залишається мутним, етап додання осаджувачів повторюють.
Вміст колби доводять до позначки дистильованою водою, ретельно перемішують і відфільтровують через складчастий фільтр у суху колбу. Отриманий фільтрат (витяжку) використовують для подальших досліджень.
Безпосереднє визначення вмісту редукуючих цукрів можна проводити різними хімічними методами: методом Бертрана (перманганатний) – арбітражний метод; методом Шорля (йодометричний напівмікрометод); прискореним методом гарячого титрування (ебуліостатичний). Всі ці хімічні методи ґрунтуються на окисленні вільних альдегідних або кетонних груп цукрів у лужному розчині двовалентним купрумом. Тоді альдегідні й кетонні групи сахарози переходять у циклічну форму і не дають реакції з Фелінговою рідиною, тому й потрібно проводити гідроліз сахарози.
У зв'язку з тим, що оксиди металів, окиснюючи цукри, самі відновлюються, цукри, здатні відновлюватись окисниками, називають редукуючими.
Швидкість процесу окиснення та склад продуктів реакції передусім залежить від активності окисника, рН середовища і температури. Вирішальне значення має рН середовища. У кислому середовищі моноцукри порівняно стійкі, а в лужному молекули цукрів розпадаються. Тому в усіх хімічних методах реакцію окиснення цукрів проводять у лужному середовищі.
Іони важких металів прискорюють реакцію окиснення. Як каталізатори вони активують кисень повітря і переносять його на молекулу цукру, при цьому змінюється їх валентність. Найактивнішими каталізаторами є іони купруму, слабкішими – іони заліза, найслабкішими – іони йоду.
Залежно від активності окисника і умов проведення реакції, окиснення альдоз і кетоз може закінчуватися на різних стадіях.
Прискорений йодометричний напівмікрометод (метод Шорля) простіший за перманганатний, дає більшу точність результатів (коефіцієнт варіації 0,8 %) і дає змогу визначити вміст цукру в широких межах його концентрації.
Визначення вмісту редукуючих цукрів методом Шорля (йодометричний напівмікрометод). Цей метод ґрунтується на визначенні кількості окисного купруму до і після відновлення лужного розчину купруму цукром. Принцип цього методу полягає в наступному: під час кип'ятіння точно визначеної кількості рідини Фелінга з дослідним розчином цукру двовалентний купрум оновлюється редукуючим цукром до оксиду одновалентного купруму:
Сu2+ →Сu+.
Потім на залишок двовалентного купруму діють КJ, при цьому іон йоду окиснюється, а двовалентний купрум відновлюється:
2Сu2+ +2КJ→2Сu+ +J2.
Взаємодіє Сu2+, який не вступив в реакцію з редукуючими цукрами, а не Сu+, що утворився. Молекулярний йод, що виділяється, у перебігу реакції відновлення купруму відтитровують тіосульфатом натрію.
Про кількість відновленого цукром оксиду купруму (Сu2О) судять за різницею об'ємів 0,1 моль/дм3 розчину тіосульфату натрію (Nа2S203), який пішов на титрування J2 після взаємодії КJ з усім двовалентним купрумом, взятим для визначення (контрольний дослід), і тим, що залишився після взаємодії з цукрами. Вміст сахарози знаходять за кількістю відновленого купруму, вираженою у см3 0,1 моль/дм3 розчину Na2S2О3.
Техніка визначення. В конічну колбу місткістю 200–300 см3 піпеткою вносять 30 см3 досліджуваного розчину, додають точно піпеткою або бюреткою 10 см3 6,925 % розчину сульфату купруму (II) і 10 см3 лужного розчину сегнетової солі (калій-натрій виннокислий), доводять суміш протягом 2 хв до кипіння, кип'ятять рівно 2 хв, швидко охолоджують до кімнатної температури, додають по 10 см3 30 % розчину КJ та 25 % розчину Н2SО4 і відразу ж титрують 0,1 моль/дм3 розчином тіосульфату натрію до солом'яно-жовтого забарвлення. Потім додають 2 см3 індикатора (1 % розчину розчинного крохмалю) і продовжують титрувати до зникнення синього забарвлення. Аналогічно проводять контрольний дослід з водою.
Масову частку редукуючих цукрів, % в перерахунку на певний вид цукру, проводять за формулою:

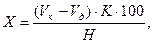
де Vк – об'єм Nа2S2О3, витрачений на титрування контрольного досліду з дистильованою водою, см3; Vд – об'єм Na2S2О3, витраченого на титрування досліджуваного розчину, см3; К – коефіцієнт перерахунку на певний вид цукру (для глюкози – 3,3; фруктози – 3,7; сахарози – 3,4; мальтози – 5,4), мг; Н – кількість наважки продукту, що відповідає фільтрату, узятому для титрування, мг.
Масу наважки концентрату, що відповідає фільтрату, взятому на титрування, визначають за формулою:

де M – маса наважки продукту, взятого для дослідження, мг; V1 ― об’єм водної витяжки, взятої для аналізу, см3, V1 = 30 см3; V2 ― місткість мірної колби, в якій готували водну витяжку, см3, V2 = 250 см3.
У разі застосування прискореного напівмікрометоду Шорля розбіжність між двома паралельними визначеннями в одній лабораторії не має перевищувати 0,5 % (абсолютна), а в різних лабораторіях – не більше 1,0 %. Розрахунок ведуть з точністю до 0,1 % .
Для проведення гідролізу сахарози в мірну колбу місткістю 100 см3 поміщають точно 50 см3 витяжки, додають 5 см3 20 % розчину НСІ і поміщають на водяну баню з водою температурою 68–70 °С на 8 хв.
Одержаний гідролізат охолоджують під проточною водою, додають одну–дві краплі індикатора метилового червоного і нейтралізують розчином NаОН до жовто-рожевого кольору. Нейтралізацію слід проводити не поспішаючи, щоб не допустити появи жовтого забарвлення, яке свідчить про встановлення лужного середовища, оскільки у лужному середовищі редукуючі цукри розкладаються.
Далі вміст колби доводять до позначки дистильованою водою і використовують для визначення загального вмісту цукру.
Визначення загальної кількості редукуючих цукрів проводять аналогічно визначенню цукрів до гідролізу.
Масову частку редукуючих цукрів після гідролізу розраховують за формулою 5.2.1.
Масу наважки концентрату, що відповідає фільтрату, взятому після проведення гідролізу на титрування, визначають за формулою:

де M – маса наважки продукту, взятого для дослідження, мг; V1 ― об’єм водної витяжки, взятої для проведення гідролізу, см3, V1 = 50 см3; V2 ― місткість мірної колби, в якій готували водну витяжку, см3, V2 = 250 см3; V3 ― об’єм водної витяжки, взятої для визначення редукуючих речовин, см3, V3 = 30 см3; V4 – місткість мірної колби, в якій готували водну витяжку для проведення гідролізу, см3, V4 = 100 см3.
Масову частку сахарози S, %, розраховують за формулою:

 ,
,
де Х1, Х2 – масова частка сахарози, відповідно, після і до гідролізу, %.
Кінцевий результат виражають з точністю до 0,1 %.
Загальна кислотність солодких стравзумовлена наявністю в них кислоти (зазвичай лимонної, рідше яблучної або винної), яку використовують у виробництві як смаковий компонент.
Кислотність визначають методом водної витяжки. Для цього наважку продукту масою 5-10 г, зважену з точністю до ± 0,01 г, переносять в мірну колбу місткістю 250 см3, доливають 2/3 об’єму дистильованої води, інтенсивно збовтують і залишають у спокої на 30 хв. Потім вміст колби доводять дистильованою водою до мітки, добре перемішують і відфільтровують через сухий складчастий фільтр у суху колбу.
У конічну колбу місткістю 100 см3 відбирають піпеткою 20 см3 фільтрату, додають дві-три краплі індикатора фенолфталеїну і титрують 0,1 моль/дм3 розчином NaOH до появи рожевого забарвлення, що не зникає протягом 20-30 с.
Загальну (титровану) кислотність К, % на відповідну кислоту, розраховують за формулою:

 (5.2.5)
(5.2.5)
де V – об'єм 0,1 моль/дм3 NаОН, витрачений на титрування контрольного фільтрату, см3; Vв – об'єм витяжки, приготованої з наважки концентрату, см3; m – кількість наважки концентрату, взятої для приготування витяжки, г; Vф – об'єм фільтрату, взятого на титрування, см3; k – коефіцієнт перерахунку на кислоту (для кислоти лимонної – 0,0070; яблучної – 0,0067; винної – 0,0075).
Результатом аналізу є середнє арифметичне двох паралельних визначень, розходження між якими не має перевищувати 0,05 %, виражене з точністю до 0,1 %.