 |
|
Определение константы диссоциации метилового оранжевого (бромкрезолового зеленого)
Определение констант равновесий основывается на использовании трех законов: закона действующих масс, основного закона светопоглощения и закона аддитивности оптических плотностей.
Полосы поглощения молекулярной и ионизированной форм кислоты НАn находятся в различных областях спектра. В соответствии с законом действующих масс при увеличении рН раствора концентрация молекулярной формы кислоты уменьшается, а ионизированной – возрастает. Следовательно, при длине волны lНАn , отвечающей полосе поглощения молекулярной формы, оптическая плотность раствора кислоты будет уменьшаться и достигнет минимума, а при длине волны lАn , отвечающей полосе поглощения ионизированной формы, оптическая плотность, напротив, будет возрастать и достигнет максимума в момент полной ионизации кислоты.
Необходимым условием проведения точных определений является правильный выбор аналитической длины волны. Если полосы поглощения не накладываются, измерения проводят при lmax более интенсивной полосы поглощения. Если полосы поглощения перекрываются, то выбирают длину волны, при которой наблюдается максимальное поглощение одной формы, а поглощение другой формы пренебрежимо мало (рис.1.11, с. 42).
По закону аддитивности оптическая плотность раствора, содержащего обе формы кислоты, определяется выражением:

где А – оптическая плотность раствора кислоты, eНАn и eАn – коэффициенты поглощения молекулярной и ионизированной форм; aНАn и aАn – их молярные доли; С – общая (аналитическая) концентрация кислоты в растворе.
Подставляя


(где Ка – константа диссоциации кислоты) в выражение (1.33) и решая уравнение относительно Ка, получим:

или
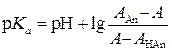
АНАn, ААn – оптическая плотность молекулярной и ионизированной форм кислоты, А – оптическая плотность раствора, содержащего обе формы кислоты.