 |
|
Термодинамическое сродство полимера и растворителя
Способность к набуханию и растворению полимеров в тех или иных растворителях зависит от строения их молекул. Набухание и растворимость полимера в том или ином растворителе зависят от взаимодействий функциональных групп или атомов, в результате которых возникают донорно-акцепторные и другие связи, приводящие к образованию устойчивых комплексов макромолекул полимера с молекулами растворителя.
Процесс растворения (набухания) идет только в том случае, если компоненты могут взаимно смешиваться или взаимно растворяться, т. е. зависит от того имеется ли между ними термодинамическое сродство. В зависимости от степени термодинамического сродства растворителей к полимерам их подразделяют на термодинамически совместимые с полимерами и несовместимые. Количественную оценку термодинамического сродства компонентов друг к другу проводят по степени снижения в результате взаимодействия их химических потенциалов. Химический потенциал компонента в растворе должен быть меньше его химического потенциала до растворения, следовательно, разность этих величин должна быть отрицательной Δμ <0.
Процесс идет в направлении смешения компонентов только в том случае, если между ними имеется сродство, поэтому критерии сродства и направленности одни и те же (ΔG <0 и Δμ <0): чем больше абсолютные значения этих величин, тем больше термодинамическое сродство между компонентами, тем полнее идет процесс их взаимодействия.
Химические потенциалы определяют, измеряя давление пара растворителя над раствором, осмотическое давление, и другими методами.
Полимеры не переходят в парообразное состояние, поэтому давление над растворами полимеров является давлением пара растворителя и наблюдается резкое отрицательное отклонение от закона Рауля. Чем выше термодинамическое сродство растворителя к полимеру, тем меньше при данной концентрации раствора значение р, и больше абсолютное значение Δμ.
Если растворитель отделить от раствора полупроницаемой мембраной, то он будет проникать через нее до тех пор, пока в растворе не возникнет гидростатическое давление, компенсирующее давление растворителя на мембрану. Это давление называется осмотическим.
Осмотическое давление – это показатель термодинамического сродства между компонентами, отнесенный к единице объема растворителя: чем больше осмотическое давление, тем больше абсолютное значение Δμ, т. е. тем выше термодинамическое сродство растворителя к полимеру.
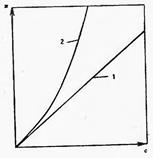
В разбавленных растворах низкомолекулярных веществ осмотическое давление π подчиняется закону Вант-Гоффа: 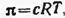 где с – концентрация растворенного вещества; R – универсальная газовая постоянная; Т – температура.
где с – концентрация растворенного вещества; R – универсальная газовая постоянная; Т – температура.
В растворах полимеров каждый сегмент макромолекулы перемещается независимо от других, ведет себя как кинетически самостоятельная единица. Поэтому осмотическое давление растворов полимеров не подчиняется закону Вант-Гоффа и зависит от гибкости макромолекул: чем выше гибкость, тем короче сегменты и больше их содержится в макромолекуле, тем выше осмотическое давление и сильнее отклонение от закона Вант-Гоффа. Кроме того, осмотическое давление растворов полимеров возрастает не пропорционально их концентрации, как в случае низкомолекулярных веществ, а значительно быстрее (рис. 6.6). Поэтому для описания зависимости осмотического давления от концентрации полимеров пользуются не уравнением Вант-Гоффа, а уравнением Ван-дер-Ваальса в виде вириального разложения, т. е. по степеням концентрации с:
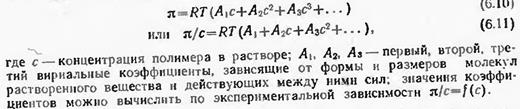
где с — концентрация полимера в растворе; А1, А2, A3 — первый, второй, третий вириальные коэффициенты, зависящие от формы и размеров молекул растворенного вещества и действующих между ними сил; значения коэффициентов можно вычислить по экспериментальной зависимости π= f(с).
Первый вириальный коэффициент А1 непосредственно связан с молекулярной массой М полимера соотношением А1 = 1/М. Третий и последующий члены степенного ряда незначительно сказываются на результатах, поэтому уравнение можно записать в виде: 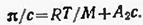
Для растворов одного и того же полимера в различных растворителях зависимость π/с= f(с) выражается серией веерообразных прямых (рис. 6.7), наклон которых определяется значением второго вириального коэффициента А2. Этот коэффициент является мерой термодинамического сродства растворителя к полимеру. Чем выше положительное значение А2, тем лучше растворитель, т. е. для семейства линий 3, 4, 5 термическое сродство растворителя возрастает в ряду 3<4<5. Таким образом, если А2>0, растворитель «хороший», А2<0, растворитель «плохой». В случае идеального растворителя (Θ-растворителя) А2 = 0.
 В хорошем растворителе глобулы макромолекул будут более рыхлыми, развернутыми и протяженными, а концентрация насыщения раствора будет высокой. И наоборот, если сродство полимера с растворителем незначительно, энергия растворения невелика (т.е. полимер с растворителем слабо взаимодействует друг с другом), в свернутой глобуле преобладает внутримолекулярное взаимодействие участков макромолекулы, следствием чего является более плотная компактная форма глобул. Такие растворители называют «плохими». Концентрация насыщения в «плохих» растворителях обычно невысока. Однако в «плохих растворителях» очень слабые межмолекулярные взаимодействия, и такие растворы больше приближаются к идеальным.
В хорошем растворителе глобулы макромолекул будут более рыхлыми, развернутыми и протяженными, а концентрация насыщения раствора будет высокой. И наоборот, если сродство полимера с растворителем незначительно, энергия растворения невелика (т.е. полимер с растворителем слабо взаимодействует друг с другом), в свернутой глобуле преобладает внутримолекулярное взаимодействие участков макромолекулы, следствием чего является более плотная компактная форма глобул. Такие растворители называют «плохими». Концентрация насыщения в «плохих» растворителях обычно невысока. Однако в «плохих растворителях» очень слабые межмолекулярные взаимодействия, и такие растворы больше приближаются к идеальным.
В идеальном растворителе энергия взаимодействия полимер–растворитель равна энергии взаимодействия полимер–полимер.
В Θ-растворителе устанавливается некоторое распределение звеньев внутри объема, занятого макромолекулярным клубком, относительно центра массы макромолекулы. Это распределение описывается функцией Гаусса. Поэтому макромолекулы, звенья которых распределены по закону Гаусса, называются гауссовыми клубками. В таких клубках концентрация звеньев уменьшается от некоторого максимального значения в центре клубка до нуля на расстоянии, равном радиусу макромолекулы.
Размеры макромолекулы в Q-условиях называют невозмущенными. Невозмущенные размеры макромолекулы в растворе при постоянной температуре зависят только от химического строения цепи: числа и длин связей, валентных углов и энергии невалентных взаимодействий близких по цепи атомов и групп, приводящих к заторможенности внутреннего вращения цепи. Эти факторы определяют способность к конформационным превращениям изолированной полимерной цепи, т.е. ее гибкость.