 |
|
Способы выражения концентрации растворов.
Концентрация растворов определяется количеством вещества, заключенным в определенном объеме (или определенной массе) раствора или растворителя в зависимости от того, что выбрано в качестве меры измерения.
Жидкости удобнее измерять по объему, а не по массе, поэтому в химии чаще всего используют объемные концентрации, и в первую очередь молярную концентрацию.
Для различных практических расчетов широко используются также массовые концентрации.
Массовую долю или процентную концентрацию обычно выражают в долях единицы или в процентах. Не следует смешивать растворимость веществ и массовую долю растворенного вещества.
Растворимость вещества показывает, сколько вещества может раствориться в 100 г растворителя. Единицей растворимости является грамм на 100 г растворителя. Массовая доля растворенного вещества показывает долю этого вещества, содержащуюся в растворе, и является безразмерной величиной.
Процентная
Массовая доля вещества — это отношение массы растворенного вещества к общей массе раствора:
 (7.3.3)
(7.3.3)
С% = mв-ва/mр-ра.100 (7.3.4)
Молярная
Молярная концентрация (молярность) — это число молей (γв-ва= mв-ва/M) растворенного вещества, содержащееся в 1 литре раствора:
 (7.3.5)
(7.3.5)
Нормальная
Нормальность раствора обозначает число грамм-эквивалентов (Э) данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора (используется только для растворов электролитов).
СN=Э /Vр-ра= mв-ва n1 n2/M/Vр-ра (7.3.6)
Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Эоснования = Моснования/число замещаемых в реакции гидроксильных групп (n1)
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода (n2)
Эсоли = Мсоли / произведение числа катионов на его заряд (n1 n2).
Пример: рассчитаем грамм – эквивалент соли Аl2(SO4)3.
Э Аl2(SO4)3=(27.2+(32+16 4) 3)/2/3=342/6=57 г.
Из соотношений (7.3.5) и (7.3.6) следует, что молярная концентрация либо равна нормальности (однозарядные ионы кислоты, основания, соли), либо меньше в число раз равной прноизведения образовавшихся ионов из одной молекулы электролита.
Моляльная
Моляльность раствора Cm (B) равна числу молей вещества n (B), растворенного в 1 кг (1000 г) растворителя (А), размерность моль/кг.
Cm (B) = 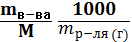 (7.3.7)
(7.3.7)
Мольная доля
Мольная доля растворенного вещества χ (B) выражается соотношением
  (7.3.8) (7.3.8)
|
Сумма мольных долей k компонентов раствора χi равна единице:
