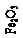|
|
Результаты анализа щелочей
Сизяков В.М.
С 349 МЕТАЛЛУРГИЯ ЛЕГКИХ МЕТАЛЛОВ. Производство глинозема: Лабораторный практикум / В.М.Сизяков, В.Н.Бричкин. Санкт-Петербургский государственный горный институт (технический университет). СПб, 2004. 90 с.
ISBN 5-94211-122-7
УДК 669.7, 669.712(075.80)
ББК 24.123
| Ó Санкт-Петербургский горный институт им. Г.В.Плеханова, 2003 г. |
ВВЕДЕНИЕ
Металлургия легких металлов – это динамично развивающаяся область металлургии, позволяющая производить легкие, высокопрочные и коррозионно-устойчивые материалы, потребление которых во многом определяет технический прогресс государства. К легким относятся 11 металлов, плотность которых в твердом состоянии составляет 0,534-3,6 г/см3, например, г/см3: алюминий – 2,7, магний – 1,74, бериллий – 1,85, щелочно-земельные металлы: кальций – 1,55, стронций – 2,6, барий – 3,6 и щелочные металлы: литий – 0,534, натрий – 0,93, калий – 0,86, рубидий – 1,52, цезий – 1,87.
Однако не все легкие металлы играют равноценную роль в технике. Важнейшие из них – алюминий, магний и бериллий. Из щелочно-земельных металлов наиболее важен кальций и барий, а из щелочных – литий и натрий.
Легкие металлы помимо малой плотности обладают общностью ряда физико-химических свойств, что объединяет их в металлургии. Они характеризуются большой химической активностью, значительной энергией Гиббса образования соединений с кислородом, галоидами, серой, а также высокой электроотрицательностью в ряду напряжений.
Электроотрицательный характер легких металлов обуславливает необходимость высокой чистоты материалов, поступающих на электролиз, что уменьшает вероятность загрязнения металлов более электроположительными примесями и улучшает технико-экономические показатели передела. Современная металлургия легких металлов представляет собой комплекс химических и электрохимических процессов, каждый из которых нередко выделяется в самостоятельное производство. Металлургия алюминия, например, включает производство глинозема, фтористых солей, углеграфитовых изделий и собственно электролитическое производство алюминия.
Цель практикума – помочь студентам закрепить знания, полученные в лекционном курсе, и на лабораторных работах приобрести практические навыки по технологии легких металлов. При этом решаются задачи, связанные с технологическими и физико-химическими расчетами, организацией эксперимента, овладением техникой экспериментальных исследований, технологическим и аналитическим контролем моделируемых процессов, обработкой результатов эксперимента и их анализом.
Производство легких металлов полностью отвечает общим технологическим принципам переработки рудного сырья и состоит из следующих основных переделов:
· вскрытие исходного сырья, включая операции шихтоподготовки;
· выделение химически чистого соединения металла, удобного для последующей переработки;
· получение металла в элементарном состоянии;
· рафинирование металла, его дополнительная обработка и производство первичных изделий.
При этом используют разнообразные гидро- и пирометаллургические процессы, а также процессы общего назначения (фильтрация, промывка, репульпации и др.). Применительно к производству легких металлов не все технологические процессы одинаково хорошо моделируются, что несколько ограничивает возможность лабораторного практикума.
Производство алюминия, важнейшего легкого металла, ввиду специфики технологии распадается на два равноценных этапа: производство глинозема и получение металлического алюминия. В связи с большим разнообразием исходного алюминийсодержащего сырья и, соответственно, технологических приемов его переработки производство глинозема выделяется в самостоятельное направление. Получение легких металлов в элементарном состоянии методами химического и электрохимического восстановления обладает определенной однотипностью, что делает удобным их совместное рассмотрение как в лекционном курсе, так и в лабораторном практикуме.
Ряд специфических вопросов производства глинозема и получения легких металлов рассматривается в специальном технологическом курсе, который расширяет и дополняет основной, поэтому соответствующие работы включены в данный лабораторный практикум. Выполнение основных и специальных лабораторных работ позволяет студентам приобрести необходимую квалификацию и наметить вопросы исследований более высокого уровня, что является исключительно важным в подготовке магистрантов и аспирантов. В связи с этим в практикум включены основные методические рекомендации к лабораторно-исследовательской работе магистрантов, специализирующихся в области производства легких металлов.
В содержании отчета к лабораторной работе рекомендуется приводить:
· цель работы;
· краткую характеристику изучаемой технологии, процесса или явления;
· описание лабораторной установки или используемого лабораторного оборудования;
· задание на проведение исследований, включающее сведения об используемых материалах, условиях проведения опытов, изменениях в ходе работы и рекомендации по обработке полученных данных;
· расчетные и экспериментальные данные, результаты их обработки в виде таблиц, графиков и аналитических зависимостей;
· выводы по работе.
ПРОИЗВОДСТВО ГЛИНОЗЕМА
В настоящее время глинозем производится на основе гидро- и пирометаллургических и пирогидрометаллургических методов. Выбор того или иного метода определяется физико-химическими свойствами как алюминийсодержащих материалов, так и их примесей.
|
Рассмотрим растворимость Al2O3, SiO2, Fe2O3 и других оксидов в зависимости от рН среды (рис.1 и 2). Оксид алюминия растворим как в кислых, так и в щелочных растворах; оксид кремния – преимущественно в щелочных, а оксид железа – в кислых растворах. Значит, алюминиевые руды могут быть переработаны как щелочными, так и кислотными способами. Выбор способа определяется содержанием основных примесей. При наличии большого количества железосодержащих минералов в руде наиболее эффективны щелочные способы, в которых железо не переходит в раствор, а остается в шламе. Если кроме железа в руде присутствует кремний, эти способы могут быть использованы при условии предварительного связывания его в малорастворимые соединения. Последнее может быть осуществлено, например, в результате спекания руды с известняком (СаСО3) с образованием 2CaO×SiO2 (способ спекания) или при гидрохимической обработке руды в специальных условиях со связыванием SiO2 в Na2O×2CaO×2SiO2×H2O или mCaO×SiO2×nH2O.
При отсутствии железосодержащих минералов и большом содержании в руде кремния наиболее эффективны кислотные способы, так как в кислых растворах кремний остается в шламе – сиштофе в виде SiO2×nH2O, а следовательно, отделяется от алюминия.
В настоящее время во всем мире применяют только щелочные гидрометаллургические или щелочные пиро- и пирогидрометаллургические способы. Это обусловлено, с одной стороны, спецификой сырьевой базы, основу которой составляет высокожелезистое сырье – бокситы, с другой – простотой аппаратурного оформления щелочных способов, не требующего специальных марок сталей и других дорогостоящих материалов для изготовления реакторов и их футеровки.
|
Щелочные способы (рис.3) в зависимости от качества перерабатываемого сырья подразделяются на: гидрометаллургические или гидрохимические; пирометаллургические; комбинированные.
К гидрометаллургическим способам относятся: способ Байера; гидрохимическое и химическое обогащение сырья.
Пирометаллургические способы включают: спекание бокситов на основе 2- и 3-компонентной шихты; спекание шламов – продуктов способа Байера на основе 3- и 4-компонентной шихты; спекание нефелинов на основе 2-3-компонентной шихты; спекание бесщелочных алюмосиликатов на основе получения саморассыпающихся спеков; предварительную термическую обработку сырья (бокситов, алунитов).
|
Учебные работы
Работа 1. КОНТУРЫ ТЕХНОЛОГИИ ПРОИЗВОДСТВА ГЛИНОЗЕМА ПО СПОСОБУ БАЙЕРА
Цель работы – знакомство с теоретическими и технологическими основами переработки высококачественного бокситового сырья на основе лабораторного моделирования ряда технологических процессов. Практическое знакомство с аналитической химией алюминатных растворов.
Основные определения, теория и технология
Способ был открыт в 1889-1892 годах Карлом Иосифом Байером, австрийским химиком, работавшим в России. В настоящее время это основной способ производства глинозема во всем мире.
Суть способа Байера (рис.4) состоит в выщелачивании предварительно раздробленного и измельченного боксита щелочно-алюминатным раствором с каустическим модулем aк = 3,5¸4,0. Каустический модуль – это молярное отношение Na2O к Al2O3:
 , (1)
, (1)
где 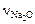 и
и 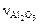 – соответственно число молей Na2O и Al2O3;
– соответственно число молей Na2O и Al2O3; 
 и [Na2O], [Al2O3] – массы и концентрации соответствующих оксидов в растворе; 102 и 62 г/моль – молекулярные массы соответственно Al2O3 и Na2O.
и [Na2O], [Al2O3] – массы и концентрации соответствующих оксидов в растворе; 102 и 62 г/моль – молекулярные массы соответственно Al2O3 и Na2O.
Каустический модуль выражает избыток свободной щелочи в растворе по отношению к количеству, необходимому для образования алюмината натрия NaAlO2 (Na2O×Al2O3). В данных технологических условиях (температура, концентрация) aк является термодинамической характеристикой насыщения раствора алюминием и кинетическим показателем его относительной устойчивости к разложению в случае пересыщения растворов.
|
Алюминийсодержащие минералы (гиббсит Al(OH)3; бемит и диаспор AlOOH) взаимодействуют с раствором каустической щелочи, в результате чего алюминий переходит в раствор в виде алюмината натрия с понижением aк до 1,3-1,7:
Al(OH)3 + NaOH = NaAl(OH)4
или
AlOOH + NaOH + H2O = NaAl(OH)4. (2)
Железо из железосодержащих минералов остается в шламе в виде гематита Fe2O3 или гидрогематита Fe2O3×nH2O – твердого раствора воды в гематите.
Кремнийсодержащие минералы в процессе выщелачивания боксита взаимодействуют с алюминатным раствором с образованием малорастворимого гидроалюмосиликата натрия (ГАСН) или производных соединений на его основе:
Al2O3×2SiO2×2H2O + 2NaOН = Na2O×Al2O3×2SiO2×2H2O + H2O. (3)
В результате вместе с SiO2 теряются, переходя в шлам, полезные компоненты – Na2O и Al2О3. Поэтому с высокой эффективностью способом Байера можно перерабатывать бокситы только с низким содержанием SiO2 по отношению к содержанию Al2O3, т.е. с высоким кремневым модулем
 (4)
(4)
где А, S – соответственно содержание Al2O3 и SiO2 в боксите.
С учетом химической потери одного моля Al2O3 на каждые два моля SiO2, переходящие в ГАСН, теоретическое извлечение Al2O3 из боксита в раствор в процентах
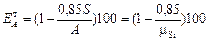 . (5)
. (5)
К наиболее существенным факторам, определяющим практическое извлечение Al2O3 в раствор, относятся: природа алюминийсодержащих минералов в боксите, температура процесса, концентрация щелочи, aк оборотного раствора, продолжительность выщелачивания, крупность помола, добавка извести, интенсивность массообменных процессов.
Пульпу после выщелачивания подвергают разбавлению промывной водой от промывки шлама. При этом происходит частичное обескремнивание раствора в связи с уменьшением растворимости ГАСН при снижении концентрации щелочно-алюминатного раствора. Красный шлам после отделения от раствора направляют на промывку, а раствор – на выделение из него гидроксида алюминия.
При охлаждении алюминатного раствора происходит его гидролитическое разложение (декомпозиция)
NaAl(OH)4 = NaOH + Al(OH)3, (6)
которое сопровождается массовой кристаллизацией гидроксида алюминия на оборотной затравке Al(OH)3. Поскольку реакция (6) полностью пройти слева направо не может, получается гидроксид алюминия и алюминатный раствор с более высоким содержанием свободной NaOH (aк = 3,5¸4,0). Щелочно-алюминатный раствор после упаривания возвращают на выщелачивание.
Таким образом, в способе Байера осуществляется замкнутый по щелочи цикл, а изменяющиеся составы растворов находят отражение в тройной системе Na2O-Al2O3-H2O (рис.5). Выделенный гидроксид алюминия подвергают кальцинации 2Al(OH)3 = Al2O3 + + 3H2O с получением глинозема.
|
Основные достоинства способа Байера – небольшое количество технологических операций, относительно простое аппаратурное оформление процессов, невысокие расходные показатели по затратам энергии и материалов и, как следствие, низкая себестоимость продукции.
Главные недостатки – применимость способа только к высококачественным бокситам и значительные невосполнимые потери дорогостоящей каустической щелочи (гидроксида натрия).
Подготовка к работе
Лабораторное оборудование должно обеспечивать возможность моделирования операций для приготовления исходной сырьевой смеси (пульпы), высокотемпературного выщелачивания, отделения и промывки красного шлама, а также выполнения соответствующих химико-аналитических работ (рис.6).
Измельчение боксита выполняется на виброистирателе системы «Механобр» или в стальных и фарфоровых ступках. Взвешивание твердых материалов (дозировка) производится на технических весах с точностью до 0,1-0,01 г. Необходимые объемы растворов отмеряют мерными цилиндрами с точностью 0,5 мл.
Выщелачивание исходной шихты ведут в лабораторных автоклавах объемом 75-100 мл. Автоклавы – толстостенные стальные сосуды с герметично закрывающейся крышкой и фторопластовой уплотнительной прокладкой. Автоклавы позволяют нагревать пульпы до высоких температур (более 200 °С), что обеспечивает интенсивное ведение процесса выщелачивания. При работе с автоклавами необходимо тщательно соблюдать правила техники безопасности, следить за исправностью сосудов и правильностью сборки. Нагрев автоклавов в воздушном термостате и их изотермическая выдержка проводится в присутствии и под наблюдением преподавателя или сотрудника кафедры.
Контроль регулировки температуры выщелачивания выполняется по температуре в термостате с помощью пирометрического регулирующего милливольтметра группы ХК с одновременным контролем температуры ртутным термометром.
Рисунок 6
Отделение алюминатного раствора от шлама и его промывка выполняются на вакуум-фильтровальной установке с использованием фарфоровой воронки Бюхнера и стеклянной колбы Бунзена. Оборудование для химического анализа содержит все необходимое для проведения объемного титриметрического анализа и фотоколориметрического анализа.
Задание на выполнение экспериментальной части включает:
· сведения о химическом и фазовом составе боксита и каустической щелочи;
· температуру и продолжительность выщелачивания;
· величину aк и [Na2Oк] алюминатного раствора;
· массу исходной навести боксита;
· рекомендации по разбавлению автоклавной пульпы и растворов, отбираемых на анализ, методике анализов и обработке экспериментальных данных.
Ход работы
1. По показателям mSi и 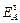 из уравнений (4) и (5) определить пригодность пробы боксита для переработки способом Байера.
из уравнений (4) и (5) определить пригодность пробы боксита для переработки способом Байера.
2. Методом дробления и измельчения подготовить пробу к шихтовке. Крупность боксита должна соответствовать 100 % фракции –80 мкм по ситовому анализу.
3. На заданную навеску боксита (mб = 15¸20 г) рассчитать требуемое для выщелачивания количество каустической щелочи mк, объем воды VН2О и количество извести mизв.
Масса щелочи в граммах
mк = [0,785 aк(Аб– 0,85Sб) + 0,667Sб]mб, (7)
где aк – каустический модуль раствора в конце выщелачивания; Аб, Sб – содержание Al2O3 и SiO2 в боксите, %; 0,785; 0,85; 0,667 – расходные коэффициенты согласно стехиометрии уравнений (2) и (3).
Объем исходного раствора для выщелачивания навески боксита в миллилитрах
 , (8)
, (8)
где [Na2Oк] – концентрация каустической щелочи в исходном растворе, равная примерно 300 г/л; [NaOH]к – содержание NaOH в техническом каустике, %.
Необходимый для приготовления щелочного раствора объем воды в миллилитрах
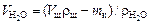 , (8а)
, (8а)
где rН2О, rщ – плотность воды и щелочного раствора заданной концентрации, г/мл.
Количество извести задается в процентах от массы боксита и составляет обычно 3-5 % или в граммах mизв = (0,03¸0,05)mб.
4. Приготовить необходимое количество одинаковых по составу шихт (по указанию преподавателя). Для этого в автоклав залить расчетный объем воды, с соблюдением необходимых предосторожностей внести навеску каустической щелочи и при перемешивании стеклянной палочкой добиться ее растворения. Добавить соответствующие количества боксита и извести, репульпировать их в объеме раствора. Собрать автоклавы под наблюдением преподавателя и установить в заранее разогретый до температуры выщелачивания (150-200 °С) воздушный термостат.
5. Включить привод механизма вращения автоклавов, обеспечивающего интенсивное перемешивание пульпы. Произвести необходимую изотермическую выдержку. Как правило, при снятии кинетической кривой с тремя автоклавами время выщелачивания составляет 15; 30 и 45 мин.
6. После заданной временнόй выдержки остановить привод перемешивающего устройства, соответствующий автоклав достать из термостата и поместить на охлаждение проточной холодной водой (5-10 мин). Продолжить выщелачивание оставшихся проб по п. 5, 6.
7. Произвести разборку охлажденного автоклава под наблюдением преподавателя. Температура поверхности автоклава при этом не должна значимо отличаться от температуры окружающей среды. Пульпу вылить в фарфоровый стакан и добавить 150-200 мл горячей воды (70-90 °С), используя ее также для промывки автоклава, с присоединением промывных вод к основному объему пульпы.
8. Отфильтровать пульпу под вакуумом, а затем промыть осадок красного шлама на фильтре 50-80 мл горячей воды. Фильтровать без защитного кожуха на колбе Бунзена запрещено!
Полученные объемы фильтратов Vф,i измерить с помощью мерного цилиндра на 250 или 500 мл, результаты записать. Пробу шлама для максимального времени выщелачивания перенести с фильтра в фарфоровую чашку и просушить на песчаной бане или в воздушном термостате. После сушки взвесить и записать (mк.ш).
9. Приготовить пробы разбавленных растворов для химического анализа. Для этого от имеющихся фильтратов отобрать пипеткой аликвотную часть Vал = 10¸25 мл и перенести в мерную колбу на 100-250 мл (Vк), разбавить и довести до метки дистиллированной водой, перемешать. При этом разбавление исходного фильтрата n = Vк/Vал. Рекомендуемое в условиях опыта разбавление 10-12.
10. Рассчитать ожидаемые концентрации анализируемых компонентов в щелочно-алюминатных растворах и определить оптимальную в условиях анализа аликвотную часть разбавленного раствора.
С учетом близости [Na2Oобщ] и [Na2Oк], потери части щелочей за счет образования ГАСН и недоотмывки шлама их ожидаемые концентрации в граммах на литр
 , (9)
, (9)
где  – ожидаемое извлечение щелочей в фильтрат, обычно равное 85-95 %.
– ожидаемое извлечение щелочей в фильтрат, обычно равное 85-95 %.
Ожидаемая концентрация [Al2O3] в фильтрате в граммах на литр
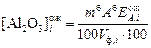 , (10)
, (10)
где  – ожидаемое в условиях опыта извлечение Al2O3 из боксита в раствор для i-й пробы с заданным временем выщелачивания, принимается по рекомендации преподавателя, %.
– ожидаемое в условиях опыта извлечение Al2O3 из боксита в раствор для i-й пробы с заданным временем выщелачивания, принимается по рекомендации преподавателя, %.
С учетом результатов расчетов по уравнениям (9) и (10), титров используемых реактивов и округления расчетных аликвот до ближайших стандартных объемов пипеток (5; 10; 15; 20; 25) получим в миллилитрах
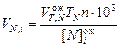 , (11)
, (11)
где 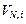 – аликвотная часть разбавленного раствора, отбираемая для анализа на содержание общей и каустической щелочи;
– аликвотная часть разбавленного раствора, отбираемая для анализа на содержание общей и каустической щелочи;  – рекомендуемый объем титранта при определении щелочей,
– рекомендуемый объем титранта при определении щелочей,  = 10-15 мл;
= 10-15 мл; 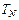 – титр щелочей по разбавленной HCl, г/мл.
– титр щелочей по разбавленной HCl, г/мл.
Соответственно, аликвотная часть раствора для анализа Al2O3 в миллилитрах
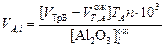 , (12)
, (12)
где VТрБ – объем трилона-Б (комплексона) для проведения анализа, обычно VТрБ = 20 мл;  – ожидаемый объем титранта Zn(NO3)2 или Zn(CН3COO)2,
– ожидаемый объем титранта Zn(NO3)2 или Zn(CН3COO)2,  = 10÷15 мл; ТА – титр Al2O3 по разбавленному раствору трилона-Б, г/мл.
= 10÷15 мл; ТА – титр Al2O3 по разбавленному раствору трилона-Б, г/мл.
11. Ознакомиться с порядком проведения анализов объемно-титрометрическим методом на содержание общей [Na2Oобщ] и каустической щелочи [Na2Oк], [Al2O3]. Провести анализ и при необходимости выполнить параллельные определения. Рассчитать концентрации компонентов в растворе [Na2Oк]i, [Al2O3]i и углекислой щелочи [Na2Oугл] = [Na2Oобщ] – [Na2Oк].
Результаты анализа свести в табл.1, 2.
Таблица 1
Результаты анализа щелочей
| Номер пробы | n, мл/мл | Vал, мл |  , г/мл , г/мл
| VHCl, мл | [Nк], г/л | [Nобщ], г/л |
| - | ||||||
| - | ||||||
| ¼ | ||||||
| i |
Таблица 2
Результаты анализа на содержание Al2O3
| Номер пробы | n, мл/мл | Vал, мл |  г/мл г/мл
| VТрБ, мл | VZn(NO3)2, мл | [Al2O3], г/л |
| ¼ | ||||||
| i |
12. Анализ на содержание SiO2 в растворе выполняется только по указанию преподавателя.
13. Рассчитать в граммах на литр концентрации компонентов в растворе, приведенные к единому объему жидкой фазы, по формулам
[Na2Oк]in = [Na2Oк]i (Vф,i/Vщ);
[Na2Oугл]in = [Na2Oугл]i (Vф,i/Vщ); (13)
[Al2O3]in = [Al2O3]i (Vф,i/Vщ).
Построить графики кинетических зависимостей
[Na2Oк]n, [Na2Oугл]n, [Al2O3]n = f(ti),
где ti – время изотермической выдержки.
14. Рассчитать каустические модули растворов по формуле (1) и построить зависимость aк = f(t).
15. Рассчитать практическое извлечение Al2O3 (  ) в раствор и представить его в процентах от теоретически возможного (
) в раствор и представить его в процентах от теоретически возможного ( 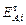 ):
):
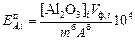 ;
;
 . (14)
. (14)
Построить зависимость  ,
,  = f(t). Все показатели свести в табл.3, а установленные зависимости объяснить.
= f(t). Все показатели свести в табл.3, а установленные зависимости объяснить.
Таблица 3