 |
|
Результаты седиментационного анализа
| t, ч | d, мкм | m, мг | Dm, мг | Содержание фракции –di+dj, % |
| t1 | d1 | m1 | ||
| Dm1, 2 | (Dm1, 2/m)100 | |||
| t2 | d1 | m2 | ||
| ¼ | ||||
| ti | di | mi | ||
| Dmi, j | (Dmi, j/m)100 | |||
| tj | dj | mj |
Подготовка к работе
Лабораторное оборудование включает установку для исследования карбонизации (см. рис.8), вакуум-фильтровальную установку, прокалочные печи, установку для виброситового и седиментационного анализов. Методика приготовления алюминатных растворов и проведения карбонизации описана в работах 5 и 2.
Задание на выполнение экспериментальной части включает характеристику исследуемых факторов и оптимизируемых параметров. При этом задаются нулевые уровни факторов и интервалы варьирования, методика выполнения экспериментальной и расчетной частей.
Ход работы
1. Приготовить исходный алюминатный раствор с aк » 1,6, устойчивый при комнатной температуре (см. п. 1 лабораторной работы 5).
2. Получить задание от преподавателя по характеру исследуемых факторов и интервалам варьирования, например:
· х1 – температура карбонизации, х1 = 60 ± 20 °С;
· х2 – содержание СО2 в дутье, х2 = 15 ± 5 %;
· х3 – расход газа, х3 = 50 ± 20 л/ч.
Состав раствора отвечает производственным данным. Продолжительность карбонизации – по указанию преподавателя.
3. Приготовить необходимое количество (200 мл для одного опыта) алюминатного раствора с заданным aк и [Na2Oк] (см. п. 3 лабораторной работы 5). Выполнить опыты согласно матрице планирования (табл.6) по методике, приведенной в лабораторной работе 2.
4. Рассчитать для каждого опыта влажность гидрата по уравнению (41), степень использования СО2 по уравнению (42) и степень разложения раствора при фиксированном времени карбонизации в процентах по формуле
 ,
,
где mглин – масса глинозема после прокалки, г; Vисх – объем исходного алюминатного раствора, л; [Al2O3] – содержание в нем Al2O3, г/л.
5. Определить фракционный состав глинозема методом весовой седиментации.
6. Установить аналитическую форму зависимости параметров карбонизации (влажность гидрата, расход СО2, 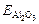 , фракционный состав и др.) от исследуемых факторов по методике, приведенной в работе 5. Проанализировать полученные результаты.
, фракционный состав и др.) от исследуемых факторов по методике, приведенной в работе 5. Проанализировать полученные результаты.
Работа 7. АНАЛИЗ АЛЮМИНАТНЫХ РАСТВОРОВ
ГЛИНОЗЕМНОГО ПРОИЗВОДСТВА
Цель работы – знакомство с теоретическими основами и методами химического анализа алюминатных растворов. Практическое выполнение аналитических работ и оценка полученных результатов.
Основные определения, теория и технология
Многочисленные технологические операции современного производства глинозема связаны с переработкой и использованием растворов и пульп. Для их успешного осуществления необходим контроль за различными параметрами жидких фаз, включая химический состав, без знания которого невозможен как текущий контроль процесса, так и оценка конечного результата. Производство глинозема в настоящее время является комплексным и многопоточным, использующим разнообразное природное сырье, в связи с чем возникает необходимость в определении целого ряда химических элементов, накапливающихся в технологических растворах.
Аналитическая служба глиноземных предприятий, как правило, является централизованной и использует разнообразные физико-химические методы для проведения экспресс-анализов с обработкой результатов на ЭВМ. В то же время, благодаря целому ряду преимуществ, не утратили своего значения и традиционные химические методы анализа алюминатных растворов, широко используемые в исследовательской работе заводских лабораторий и отраслевых институтов.
Метод нейтрализации. Данный метод использует титриметрические определения, в основе которых лежит реакция между ионом водорода и гидроксил-ионом
Н+ + ОН– = Н2О.
Методом нейтрализации проводят количественное определение кислот (титруя их основаниями), оснований (титруя их кислотами), солей, имеющих в растворе кислую или щелочную реакции, и ряда других соединений.
Различают ацидиметрическое титрование (от acidium – кислота), в котором в качестве титранта используют растворы серной или соляной кислоты, и алкалиметрическое титрование (от alkalis – щелочь), где титрантом служат, как правило, растворы гидроксида натрия или калия.
В ходе титрования изменяется концентрация водородных и гидроксильных ионов в растворе. В точке эквивалентности концентрации водородных и гидроксильных ионов должны быть равны, и в этом случае она совпадает с точкой нейтрализации. Однако это возможно только при взаимодействии сильной кислоты и сильного основания. Если в реакции участвует слабое основание или слабая кислота, то в точке эквивалентности наблюдается некоторый избыток водородных или гидроксильных ионов, т.е. точка эквивалентности не совпадает полностью с точкой нейтрализации вследствие гидролиза образующихся продуктов.
Точку эквивалентности при кислотно-основном титровании определяют с помощью химических индикаторов или физико-химическими методами. Бόльшая часть кислотно-основных индикаторов существует в двух формах, имеющих различную окраску, причем переход из одной формы в другую связан с изменением концентрации ионов водорода, т.е. рН среды. Этот переход может быть обусловлен превращением недиссоциированной формы индикатора в диссоциированную или изменением электронной структуры органической молекулы (образование хиноидного соединения).
Например, метиловый оранжевый – натриевая соль 4-диметиламиноазобензол-4-сульфокислоты окрашивает щелочной раствор в оранжево-желтый цвет. При подкислении окраска раствора изменяется на розово-красную вследствие образования хиноидного соединения:
Оранжево-желтый (азо-форма) Û розово-красный (хиноидная форма).
Изменение окраски происходит в определенном интервале рН: начинается при рН = 4,4 и заканчивается при рН = 3,1. Интервал рН, в котором окраска индикатора изменяется, называют интервалом перехода индикатора (табл.9).
Таблица 9