 |
|
Характеристика важнейших кислотно-основных индикаторов
| Название | Интервал перехода рН | Изменение окраски |
| Метиловый оранжевый | 3,0-4,4 | Розово-красная → оранжево-желтая |
| Конго красный | 3,0-5,2 | Сине-фиолетовая → красная |
| Метиловый красный | 4,4-6,2 | Красная → желтая |
| Лакмус | 5,0-8,0 | Красная → синяя |
| Нейтральный красный | 6,8-8,0 | Красная → желтая |
| Бромтимоловый | 6,0-7,6 | Желтая → синяя |
| Фенолфталеин | 8,2-10,0 | Бесцветная → красно-оранжевая |
| Тимолфталеин | 9,4-10,6 | Бесцветная → синяя |
Методика определения общей щелочности (Na2Oобщ). Применение индикатора метилового красного для определения общей щелочности в растворах, содержащих алюминий, обусловлено изменением окраски при рН = 4,4, т.е. до начала титрования Al(OH)3, начинающегося при рН = 4,5.
Необходимые реактивы:
1) кислота соляная – 0,1 M раствор;
2) метиловый красный – 0,1-процентный спиртовой раствор.
Ход анализа. Необходимый объем крепкого алюминатного раствора (V) переносят в мерную колбу емкостью Vк, доводят объем до метки и перемешивают, что обеспечивает приготовление разбавленных растворов с разбавлением nр = Vк/V, необходимым для повышения их устойчивости и экономного расходования реактивов. Рекомендуемое значение n определяется начальной концентрацией раствора и аликвотной частью разбавленного раствора, отбираемого на титрование. Отбирают пипеткой аликвотную часть объемом 5-20 мл, обеспечивающую ожидаемый расход титранта 0,1 M раствора HCl около 10 мл, и переносят в коническую колбу емкостью 500 мл. Затем в коническую колбу добавляют 100 мл воды и четыре капли метилового красного. Пробу нагревают до кипения, кипятят 3 мин и горячую титруют 0,1 M раствором соляной кислоты до розовой окраски.
Концентрация общей щелочи в граммах на литр рассчитывается по формуле
 , (82)
, (82)
где у – количество раствора соляной кислоты, израсходованной на титрование, мл; ТHCl – титр раствора HCl, выраженный по Na2O и равный 3,1×10-3 г/мл для 0,1 M HCl; Vал – аликвота раствора, мл.
Определение каустической окиси натрия (Na2Oк).При прибавлении к алюминатному раствору, содержащему карбонат и сульфат натрия, избытка хлористого бария происходят реакции
Na2CO3 + BaCl2 = 2NаCl + BaCO3;
Na2SO4 + BaCl2 = 2NaCl + BaSO4.
Если после этого медленно титровать раствор в присутствии фенолфталеина 0,1 M раствором соляной кислоты, раствор обесцвечивается в момент нейтрализации едкого натра, свободного и связанного с алюминием в алюминат. Сумма последних в пересчете на оксид натрия носит техническое название каустической окиси натрия.
Необходимые реактивы:
1) соляная кислота – 0,1 M раствор;
2) барий хлористый – 10-процентный раствор;
3) фенолфталеин – 1-процентный спиртовой раствор.
Ход анализа. Отбирают пипеткой пробу алюминатного раствора в мерную колбу, доводят до метки водой и перемешивают, обеспечивая необходимое разбавление. Из мерной колбы отбирают пипеткой аликвотную часть и переносят в коническую колбу емкостью 250 мл. Приливают 100 мл воды, добавляют 5 мл раствора хлористого бария и по каплям фенолфталеин до окрашивания раствора в малиновый цвет. Холодный раствор титруют 0,1 M соляной кислотой до исчезновения розовой окраски. Содержание каустической щелочи в граммах Na2Oк на литр вычисляют по формуле, аналогичной (82).
Метод комплексонометрии. Данный метод основан на образовании комплексных соединений анализируемых компонентов с органическими реактивами – комплексонами. В комплексонометрическом анализе в качестве рабочего вещества чаще всего используется трилон Б, представляющий собой натриевую соль этилендиаминотетрауксусной кислоты. Сокращенное обозначение молекулы трилона Б – Na2H2Tp. Это соединение легко образует прочные внутрикомплексные соли со многими катионами.
При комплексонометрическом титровании к раствору, содержащему определенные ионы, постепенно добавляют титрованный раствор комплексона. По мере титрования определенные ионы связываются в комплекс, и в точке эквивалентности они практически отсутствуют в растворе. Реакцию применительно к титрованию алюминия можно записать в следующем виде:
2Al3+ + 3Na2H2Tp = Al2(Na2Tp)3 + 6H+.
Чтобы реакция комплексообразования шла до конца, нужно связать выделяющиеся ионы водорода, поэтому при титровании к анализируемому раствору добавляют буферный раствор.
При титровании трилоном Б раствора, содержащего окрашенное комплексное соединение, образованное определяемым металлом и индикатором, трилон Б разрушает это комплексное соединение и сам образует с металлом свой комплекс. В точке эквивалентности комплексное соединение индикатора разрушается полностью и индикатор выделяется в свободном виде. Поскольку окраска свободного индикатора отличается от окраски его комплексного соединения с металлом, происходит изменение цвета титруемого раствора (соединения металлов с трилоном Б чаще всего бесцветны или имеют слабую окраску).
Следует отметить, что индикаторы также образуют с металлами прочные внутрикомплексные соединения, ионный состав которых (и соответственно цвет) зависит от кислотности раствора.
Определение оксида алюминия (Al2O3). Метод основан на обратном комплексонометрическом титровании, что связано с отсутствием подходящего индикатора, избирательно окрашиваемого в присутствии алюминия. Поэтому к алюминатному раствору добавляют избыток трилона Б, который связывает алюминий в комплекс с сохранением естественной окраски вводимого индикатора. Чаще всего в качестве индикатора используют ксиленоловый оранжевый (КО) – шестипротонную кислоту из группы органических красителей трифенилметанового ряда. Его применяют в виде 0,5-процентного спиртового раствора для комплексонометрического определения в кислой среде многих катионов.
В свободном виде растворенный индикатор имеет желтый (при рН < 6,4) или красный (при рН > 6,4) цвет. С катионами металлов образует комплексы красного цвета.
При титровании избытка трилона Б катионами цинка в точке эквивалентности раствор изменяет окраску с желтой на красную, а количество закомплексованного алюминием трилона Б определяется по разнице между объемом, введенным в раствор и связанным в комплекс при титровании цинком.
Необходимые реактивы:
1) кислота соляная, 1:1;
2) трибон Б, 0,05 М раствор;
3) ацетатный буферный раствор;
4) ксиленоловый оранжевый, 0,5-процентный раствор;
5) цинк азотнокислый, 0,05 М раствор.
Ход анализа. Отбирают пипеткой необходимый объем крепкого алюминатного раствора в мерную колбу. Разбавляют водой до метки и тщательно перемешивают. Из этой колбы отбирают пипеткой аликвотную часть раствора и помещают в коническую колбу емкостью 500 мл, добавляют воды 200 мл и трилона Б 20 мл. Затем раствор нагревают до кипения, в горячий раствор добавляют 10 капель ксиленолового оранжевого и нейтрализуют раствор соляной кислотой с разбавлением (1:1) до перехода окраски в желтый цвет (кислоту добавлять по каплям). После нейтрализации прибавляют 20 мл ацетатного буферного раствора и колбу с раствором кипятят 3 мин. Затем раствор охлаждают на водяной бане и титруют 0,05 М раствором азотно-кислого цинка до перехода окраски из желтой в розовую.
Содержание окиси алюминия в граммах на литр вычисляют по формуле:
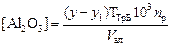 , (83)
, (83)
где у – количество 0,05 М раствора трилона Б, мл; у1 – количество 0,05 М раствора азотно-кислого цинка, пошедшего на титрование избытка трилона Б, мл; ТТрБ – титр 0,05 М раствора трилона Б, выраженный по Al2O3, г/мл, ТТрБ = 2,55×10-3; nр – степень разбавления крепкого алюминатного раствора; Vал – объем аликвотной части разбавленного раствора, отобранного для титрования, мл.
Колориметрический анализ. Метод основан на использовании химических реакций, сопровождающихся изменением цвета анализируемого раствора. Измеряя светопоглощение такого окрашенного раствора или сравнивая полученную окраску с окраской раствора известной концентрации, определяют содержание окрашенного вещества в испытуемом растворе.
Количественные измерения в колориметрических методах анализа основаны на законе Бугера – Ламберта – Бера, выражаемого уравнением
I = I0×10–eCl,
где I – интенсивность света, прошедшего через раствор; I0 – интенсивность падающего на раствор света; e – коэффициент поглощения света – постоянная величина, характерная для каждого окрашенного вещества и зависящая от его природы; С – концентрация окрашенного вещества в растворе; l – толщина слоя светопоглощающего раствора.
В логарифмической форме уравнение принимает следующий вид:
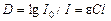 .
.
Величина  носит название оптической плотности раствора и обозначается буквой D. Из уравнения вытекает, что оптическая плотность раствора прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора.
носит название оптической плотности раствора и обозначается буквой D. Из уравнения вытекает, что оптическая плотность раствора прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора.
Таким образом, чтобы определить концентрацию окрашенного раствора, необходимо измерить интенсивность светового потока, падающего на раствор и прошедшего через него. Интенсивность светового потока измеряют фотоэлектрическими колориметрами различных конструкций. Для определения этим методом концентрации исследуемого вещества (Сисп) измеряют оптическую плотность испытуемого раствора (Dисп) и эталонного раствора (Dэт), концентрация которого известна (Сэт). Расчет проводят по формуле
Сисп = (Dисп / Dэт)Сэт.
При массовых фотоколориметрических анализах используют метод калибровочной кривой, заключающийся в построении зависимости светопоглощения от концентрации эталонных растворов. Имея такую кривую, достаточно измерить светопоглощение раствора и по калибровочной кривой найти концентрацию, соответствующую найденному светопоглощению.
Колориметрическое определение кремнекислоты в алюминатных растворах. Метод основан на образовании кремнемолибденовой кислоты и ее последующем восстановлении аскорбиновой кислотой. Окраска комплексного соединения при этом переходит из желтой в синюю. Фотометрирование окрашенного раствора производят на фотоколориметре при l = 630 нм в кюветах с толщиной светопоглощающего раствора 1 см.
Необходимые реактивы:
1) кислота соляная, 3 М раствор;
2) аммоний молибденово-кислый, 10-процентный раствор;
3) кислота серная, 4 М раствор;
4) кислота аскорбиновая, 1-процентный раствор свежеприготовленный;
5) стандартный раствор кремнекислоты.
Ход анализа. Отбирают пипеткой 10 мл алюминатного раствора в мерную колбу емкостью 250 мл, приливают воды до метки и тщательно перемешивают.
В зависимости от содержания кремнекислоты на определение отбирают такую аликвотную часть разбавленного раствора, чтобы содержание кремнекислоты в ней не превышало 0,24 мг. Так, например, при содержании в алюминатном растворе кремнекислоты до 0,5 г/л на определение отбирают 10-25 мл разбавленного раствора, а при содержании более 0,50 г/л – 5 мл. Таким образом, можно охватить содержание кремнекислоты до 1,0 г/л.
Отбирают аликвотную часть алюминатного раствора в мерную колбу на 100 мл и приливают из бюретки по каплям 3 М раствор HCl в количестве, необходимом для нейтрализации алюминатного раствора по индикаторной бумаге «Конго красный». Окраска бумаги меняется с красной на сиреневую. Затем добавляют избыток 3 М HCl – 3 мл, при этом окраска бумажки становится синей. Разбавляют раствор водой до объема 50 мл. Затем прибавляют 5 мл молибденовокислого аммония, перемешивают и оставляют на 10-15 мин. По оптической плотности растворов определяют содержание двуокиси кремния и рассчитывают ее концентрацию.
Для построения градуировочного графика в мерные колбы на 100 мл приливают из бюретки различные количества разбавленного раствора кремнекислоты (стандартного). В одну из колб раствор SiO2 не прибавляют, в ней готовят раствор холостого опыта. В каждую из колб прибавляют по 20 мл воды и по 2,5 мл 3 М раствора HCl. Разбавляют растворы водой до объема, равного 50 мл, и далее поступают, как описано в ходе анализа. По результатам строят градуировочный график D = f(mSiO2).
Содержание двуокиси кремния в растворе в граммах на литр вычисляют по формуле
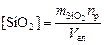 , (84)
, (84)
где 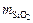 – количество кремнекислоты, найденное по градуировочному графику (мг) или рассчитанное для D = 0,15¸1,5 по уравнению mSiO2 = kD, в описанных условиях k = 0,34.
– количество кремнекислоты, найденное по градуировочному графику (мг) или рассчитанное для D = 0,15¸1,5 по уравнению mSiO2 = kD, в описанных условиях k = 0,34.
Математическая обработка результатов анализа проводится на основе данных о выполнении параллельных определений. При этом по уравнению (75) вычисляют дисперсию и определяют стандартное отклонение среднего арифметического по формуле
 . (85)
. (85)
Затем вычисляют ошибку среднего результата
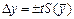 , (86)
, (86)
где t – табличное значение критерия Стьюдента (коэффициента нормированных отклонений) при выбранном уровне значимости (доверительной вероятности) и числе параллельных анализов n (табл.10).
Тогда определяемая величина запишется в виде 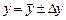 , т.е. с принятой вероятностью можно заключить, что искомый результат лежит в пределах от
, т.е. с принятой вероятностью можно заключить, что искомый результат лежит в пределах от 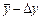 до
до 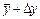 .
.
Таблица 10