 |
|
Уравнение состояния идеального газа
В состоянии термодинамического равновесия параметрами системы являются давление Р, температура Т, объем V, масса m и т. д.
Указанные параметры (Р, V, T, m) не являются исчерпывающими из всего многообразия макроскопических параметров.
Все они описывают внутреннее состояние тел с точностью до флуктуаций.
Флуктуациями называют случайные отклонения физической величины от ее среднего значения.
Особенно малы флуктуации, когда физическая система находится в состоянии термодинамического равновесия.
Поэтому макроскопические параметры с высокой точностью характеризуют внутреннее состояние тел.
Закон, выражающий зависимость между параметрами состояния, называют уравнением состояния:
f (Р, V, T) = 0. (1.6)
Установление вида этой функции в каждом конкретном случае является сложной задачей, которая решена только для идеальных газов.
Из-за серьезных трудностей получить уравнение состояния для жидких и твердых тел на основе микроскопических представлений пока не удалось.
Идеальным называют газ, взаимодействием между молекулами которого можно пренебречь.
Взаимодействие молекул идеального газа со стенками сосуда, в котором они находятся, – абсолютно упругое.
Газ – состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и находятся в тепловом хаотическом движении, заполняя весь объем.
Газы широко распространены и в космическом пространстве.
Нейтральные, или ионизированные атомы межзвездной среды входят в состав галактик в виде молекулярных облаков, в которых рождаются звезды, звездные ассоциации и т. д.
В состав атмосферы Земли входят газы: азот, кислород, углекислый газ и т. д.
Опытным путем установлено, что при комнатной температуре и нормальном атмосферном давлении идеальный газ подчиняется уравнению Клапейрона.
Уравнение Клапейрона устанавливает зависимость между термодинамическими параметрами идеального газа : Р, V, Т – характеризующими его состояние, т. е.
РV = BT, (1.7)
где В – коэффициент пропорциональности; V – объем, занимаемый идеальным газом, зависит от массы газа m и его молярной массы М.
Уравнение состояния для одного моля идеального газа получено Менделеевым:
РVм = RT, (1.8)
где R = 8,31 Дж / (моль ×К) – универсальная газовая постоянная; Vм – объем одного моля идеального газа.
Для произвольной массы газа формула (12.8) принимает вид
РV = 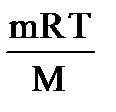 , (1.9)
, (1.9)
где m – масса газа; n =  – число молей.
– число молей.
Формулу (12.9) называют уравнением состояния идеального газа Менделеева – Клапейрона.
Из уравнения состояния идеального газа следует два следствия: закон Авогадро и закон Дальтона.
Закон Авогадро
В равных объемах различных газов, находящихся при одинаковых давлениях и температурах, содержится одинаковое число молекул, равное постоянной Авогадро.
Следовательно, постоянная Авогадро – число структурных элементов (атомов, молекул, ионов или других частиц) в единице количества вещества (например, в одном моле). В частности, в 1 м3 любого идеального газа при
t = 0 oC и Р = 1 атм содержится число молекул, равное числу Лошмидта,
т. е. L = 2,7×1019 молекул.
Закон Дальтона
В состоянии теплового равновесия давление в смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений отдельных газов, входящих в смесь.
Р = Р1 + Р2 + Р3 + ... (1.10)
Парциальным называют давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал весь объем, равный объему смеси при той же температуре.
Пусть смесь состоит из Z газов. Число молекул первого газа равно N1, второго – N2 и т. д.
В состоянии термодинамического равновесия при постоянной температуре (Т = const) на основании уравнения Клапейрона для одного моля идеального газа (1.8)
РV = RT, где R = Nak.
Тогда РV = NakT. Для произвольного числа молекул PV = NkT.
Уравнение состояния для каждого газа запишем в виде
P1V = N1kT, P2V = N2kT, ... , PzV = NzkT,
где P1, P2, ... , Pz – парциальные давления 1-го, 2-го и т.д. компонент смеси газов. После сложения получим
PV = (P1 + P2 + ... + Pz)V = kT(N1 + N2 +...+ Nz),
где N = N1+ N2+...+ Nz – общее число частиц смеси газов.
Следовательно, полное давление смеси газов равно сумме парциальных давлений:
Р = Р1 + Р2 + Р3 + ...+ Рz.