 |
|
Основные теоретические положения
Рассмотрим термодинамическую систему, в которой протекает некоторая обобщенная химическая реакция
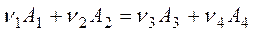 (3.1)
(3.1)
где ni - стехиометрический коэффициент, Аi- реагент.
Полный дифференциал функции Гиббса для этой системы запишется как
 . (3.2)
. (3.2)
В состоянии равновесия при постоянных температуре и давлении  , следовательно,
, следовательно,
 (3.3)
(3.3)
В состоянии динамического равновесия dniне может быть равно нулю, следовательно,
 (3.4)
(3.4)
Соотношение (3.4) является условием химического равновесия реакции. Из него можно получить очень важный для химии закон действия масс. Если реакции (3.1) гомогенная, например, все реагенты - газообразные вещества, то с учетом значений химических потенциалов каждого компонента реакции можно записать:
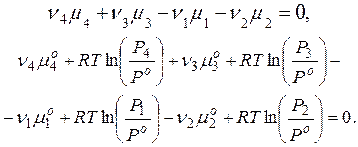 (3.5)
(3.5)
После группировки членов, зависимых только от температуры и зависимых только от содержания реагентов, получаем:
 (3.6)
(3.6)
Это соотношение можно записать компактнее, если учесть, что стандартное давление Ро=1 атм., а  :
:
 (3.7)
(3.7)
В состоянии равновесия при постоянной температуре, выражение в квадратных скобках также будет постоянным. Следовательно, в состоянии равновесия выражение в квадратных скобках является константой Кри называется константой равновесия химической реакции
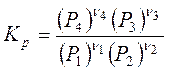 . (3.8)
. (3.8)
Выражение (3.8) является законом действующих масс. Закон действия масс применим и к системам, в которых протекают реакции с участием твердых реагентов, т.н. гетерогенные реакции. В качестве примеров можно привести следующие реакции:
- восстановление оксида железа (+2):
FeO(тв) + CO(г) = Fe(тв) + CO2(г), (3.9)
- разложение карбоната кальция:
CaCO3(тв) = CaO(тв) + CO2(г), (3.10)
- окисление никеля:
Ni(тв) + 1/2O2(г) = NiO(тв). (3.11)
Согласно термодинамическому условию равновесия (3.4), например, для реакции окисления никеля будем иметь
 (3.12)
(3.12)
Для газообразного реагента (кислорода)  , для твердого -
, для твердого - 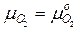 , так как химический потенциал твердой фазы зависит только от температуры и не зависит от его содержания (давления). С учетом этого уравнение (3.12) преобразуется к виду
, так как химический потенциал твердой фазы зависит только от температуры и не зависит от его содержания (давления). С учетом этого уравнение (3.12) преобразуется к виду
 (3.13)
(3.13)
Следовательно, константы равновесия реакций 3.9, 3.10 и 3.11 запишутся, соответственно:
 ,
, 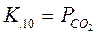 и
и  (3.14)
(3.14)
Таким образом, выражение закона действующих масс для гетерогенных химических реакций остается таким же, как и для гомогенных, но только парциальные давления (или концентрации) твердых фаз не входят в уравнения констант равновесия.
Константа равновесия конкретной реакции (Кри Кс) зависит только от температуры. Влияние температуры на константу равновесия можно получить непосредственно из связи стандартного изобарного потенциала с константой равновесия реакции (7)
 (3.17)
(3.17)
Из соотношения (3.17) можно оценить стандартные энтальпию и энтропию химической реакции:
 ; (3.18)
; (3.18)
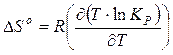 (3.19)
(3.19)
3.1.2 Аппаратура.Схема установки для измерения давления диссоциации карбонатов щелочноземельных металлов представлена на рис 3.1. Основными узлами установки являются: реакционный сосуд (1), выполненный из жаропрочного материала и помещенный в электропечь (2); ртутный манометр (3), герметично связанный с реакционным сосудом и через кран (4) с ручным вакуумным насосом (5). Температура в печи поддерживается при помощи регулятора (6), контроль температуры ведется при помощи термопары (7) и вольтметра (8). В реакционный сосуд помещено некоторое количество исследуемого порошкообразного вещества (9) (MgCO3, CaCO3 или SrCO3).
Приборы и реактивы
| 1. Измерительная система (печь, кварцевая труба, термопара) | 5. Компенсатор температуры КТ-64 ХА68 |
| 2. Ртутный манометр | 6. Вакуумный ручной насос |
| 3. Нановольтметр В2-38 | 7. CaCO3 |
| 4. Регулятор температуры ВРТ |
3.2. Порядок выполнения работы. Прежде всего, следует убедиться в герметичности системы. Для этого с помощью ручного вакуумного насоса создают разряжение 5-10 мм ртутного столба. Герметичность системы можно считать удовлетворительной, если за 10-15 мин давление изменится не более, чем на 1-2 мм ртутного столба.
Включают печь и с помощью регулятора устанавливают первоначальную температуру реакционного сосуда не выше 600о С что соответствует показанию вольтметра, подключенного к термопаре порядка 24 мВ. Разряжение при этом в системе должно поддерживаться минимальное – порядка 5-10 мм ртутного столба. Записывают первые показания термопары и манометра. После этого, с помощью регулятора (6) повышают температуру в печи на 10-20 градусов, ждут установления нового постоянного значения температуры и записывают соответствующее этой температуре значение давления.

Рис. 3.1. Установка для определения упругости диссоциации карбонатов щелочноземельных металлов.
Таким образом, постепенно повышая температуру, проводят не менее 10-15 замеров. Измерения проводят до тех пор, пока давление в реакционном сосуде не достигнет 700 мм ртутного столба. В случае повышения давления свыше 720 мм ртутного столба немедленно сообщить газовую систему установки с атмосферой и начать охлаждение печи.
После окончания эксперимента печь охлаждают до 600о С и систему через кран (4) соединяют с атмосферой. Затем выключают печь и вольтметр.