 |
|
Основні положення молекулярно-кінетичної теорії речовини
Основні положення молекулярно-кінетичної теорії речовини. Експериментальні підтвердження основних положень молекулярно-кінетичної теорії
Основні положення молекулярно-кінетичної теорії речовини.Гіпотеза про існування атомів як найменших неподільних частинок речовини була висунута понад 2500 років тому давньогрецькими ученими Левкіпом і Демокрітом. Цю гіпотезу давньогрецькі філософи висловили на основі аналізу причин таких природних явищ, як здатність води до випаровування і конденсації із пари, здатність до розширення і розчинення твердих тіл, поширення запахів. Зокрема, відмінність запахів, смаків різних речовин і механічних властивостей тіл давньогрецькі атомісти пояснювали відмінностями форм і розмірів атомів, їх здатностей до з’єднань.
На основі гіпотези про існування найменших частинок речовини була створена молекулярно-кінетична теорія.
Молекулярно-кінетичною теорією (МКТ) називають теорію, яка пояснює будову і властивості тіл на основі закономірностей руху і взаємодії атомів та молекул.
Значний внесок у створення основ МКТ зробили у другій половині ХІХ ст. німецький фізик Р. Клаузіус (1822 – 1888), російський фізик (студент Києво-Могилянської академії) М. В. Ломоносов (1711 – 1765), австрійський фізик Л. Больцман (1844 – 1906). Вагомим також є внесок учених України: М. П. Авенаріуса (1835 – 1895), М. О. Умова (1846 – 1915), М. М. Бекетова (1827 – 1911), М. М. Шіллера (1848 – 1910), І. П. Пулюя (1845 – 1918) та інших.
На початку ХХ ст. над розробленням атомно-молекулярної теорії та її експериментальним обґрунтуванням працювали А. Ейнштейн (1879 – 1955), французький вчений Ж. Перрен (1870 – 1942), німецький фізик О. Штерн (1888 – 1969).
Молекулярно-кінетична теорія пояснює теплові явища у макроскопічних тілах на основі уявлень, що всі тіла складаються з окремих частинок, які рухаються хаотично та взаємодіють між собою. У цій теорії ставиться завдання пов’язати закономірності поведінки окремих атомів і молекул з величинами, які характеризують властивості макротіл.
Спочатку зупинимося на основних положеннях МКТ, відомих вам частково з курсу фізики vii і viii класів. Потім ознайомимося із застосуванням цієї теорії до найпростішої системи – газу порівняно невеликої густини.
В основу молекулярно-кінетичної теорії речовини покладено три положення:
1. Будь-які речовини мають дискретну (переривчасту) будову. Вони складаються з найдрібніших частинок – молекул або атомів (іонів). Підтвердженням дискретності є пароутворення, поширення пахощів, розчинність речовин тощо. Молекули не видимі для людського ока, але наші уявлення про молекули і їх рух підтверджуються багатьма дослідами. Перш ніж розглянути ці досліди докладніше, уточнимо, що ми розуміємо під найдрібнішими частинками речовини.
Молекули– найменші частинки, які мають хімічні властивості речовини. Молекули складаються з більш простих частинок – атомів хімічних елементів. Атом – найменша частина хімічного елемента, що є носієм його властивостей.
Молекули складних речовин складаються з різних атомів. Кількість атомів у молекулі може бути від двох (N2, O2, H2, KCL) до тисячі і більше (полімери). Багатоатомні молекули (тисяча і більше атомів) називають макромолекулами.
Якщо різних видів молекул у природі надзвичайно багато, то кількість різних видів атомів обмежена.Речовину, яка побудована з атомів лише одного виду, називають елементом (Гідроген, Оксиген тощо). Кожен елемент має свій номер Z у таблиці Менделєєва. Число Z визначає кількість протонів у ядрах атомів і електронів, що рухаються в атомі навколо ядра. У природі є 92 хімічні елементи. Разом зі штучними наразі налічується 106 елементів.
Іони – це частинки, які утворилися з молекул або атомів. Вони мають надлишок або недостачу електронів, тобто заряджені позитивно або негативно.
2. Молекули знаходяться у стані безперервного хаотичного (невпорядкованого) руху, що називається тепловим і у загальному випадку є сукупністю поступального, обертального і коливального рухів.
Під час нагрівання речовини швидкість теплового руху і кінетична енергія його частинок збільшуються, а під час охолодження зменшуються. Ступінь нагрітості тіла характеризує його температура, яка є мірою середньої кінетичної енергії хаотичного поступального руху молекул цього тіла.
3. Молекули взаємодіють одна з одною із силами електромагнітної природи, причому на відстанях більших за два – три діаметри молекули вони притягуються, а на відстанях менших за диаметр молекули – відштовхуються. Сили притягання і відштовхування між молекулами діють постійно і одночасно.
Графічну залежність результуючої сили взаємодії 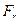 (1), сили відштовхування
(1), сили відштовхування  (2) і сили притягання
(2) і сили притягання  (3) молекул від відстані між молекулами зображено на мал. 5.1. Спочатку одна з молекул перебуває на відстані r1 від іншої, яка знаходиться у початку координат. На цій відстані діє дуже мала сила взаємного притягання і ще менша сила відштовхування. Якщо молекули перебувають на відстанях, що перевищують їхні розміри в кілька разів, то сили взаємодії практично не виявляються, адже вони є короткодіючими. Зі зменшенням відстані сила притягання спочатку зростає. У міру зменшення відстані починає проявлятися сила відштовхування. Ця сила дуже швидко зростає, коли починають перекриватися електронні оболонки атомів.
(3) молекул від відстані між молекулами зображено на мал. 5.1. Спочатку одна з молекул перебуває на відстані r1 від іншої, яка знаходиться у початку координат. На цій відстані діє дуже мала сила взаємного притягання і ще менша сила відштовхування. Якщо молекули перебувають на відстанях, що перевищують їхні розміри в кілька разів, то сили взаємодії практично не виявляються, адже вони є короткодіючими. Зі зменшенням відстані сила притягання спочатку зростає. У міру зменшення відстані починає проявлятися сила відштовхування. Ця сила дуже швидко зростає, коли починають перекриватися електронні оболонки атомів.
На відстані r0, що відповідає рівності сил притягання і відштовхування і приблизно становить суму радіусів молекул, молекули перебувають у рівновазі. Цю відстань називають рівноважною.
Кожна ордината кривої взаємодії (1), яка відповідає довільній відстані r, є результатом алгебраїчного додавання ординат кривих (2) і (3). А сама крива (1) показує, що при відстанях, менших деякої рівноважної відстані, між молекулами  переважають сили відштовхування і навпаки. Зображена на мал. 5.1 залежність сил взаємодії молекул від відстані між ними хоч і є наближеною, але якісно дає змогу пояснити виникнення сили пружності у процесі стискування і розтягування тіл.
переважають сили відштовхування і навпаки. Зображена на мал. 5.1 залежність сил взаємодії молекул від відстані між ними хоч і є наближеною, але якісно дає змогу пояснити виникнення сили пружності у процесі стискування і розтягування тіл.
Молекули різних речовин по-різному взаємодіють одна з одною. Ця взаємодія залежить від типу молекул і відстані між ними. Залежно від характеру руху і взаємодії молекул розрізняють такі стани речовини: твердий, рідкий, газоподібний, плазма.
Плазма– сильно іонізований газ, під дією високих температур. Для газів характерні великі міжмолекулярні відстані, малі сили притягання, тому гази можуть необмежено розширюватись. Молекули газу хаотично рухаються, співударяються одна з одною і зі стінками посудини (мал. 5.2).
У рідинах молекули розміщені щільно і коливаються навколо положення рівноваги, а також перескакують з одного рівноважного положення в інше, чим зумовлюють текучість рідини (мал. 5.3).
У твердих тілах сили взаємодії кожної молекули із сусідніми настільки великі, що молекула здійснює малі коливання навколо деякого сталого положення рівноваги – вузла кристалічної решітки (мал. 5.4). Цим пояснюється властивість твердих тіл зберігати форму та об’єм.
Експериментальні підтвердження основних положень молекулярно-кінетичної теорії. Положення молекулярно-кінетичної теорії речовини повністю підтверджено. Молекули і атоми мають настільки малі розміри, що їх неможливо бачити за допомогою навіть оптичного мікроскопа. Але здавна вчені мріяли побачити молекули. Лише у 1974 р. за допомогою електронного мікроскопа (мал. 5.5), який має збільшення у мільйони разів, роздивилися великі молекули білкових сполук.
Потім, сконструювавши іонний проектор (мал. 5.6), де на люмінесцентному екрані утворюється збільшене у мільйони разів зображення ультрагострого вістря із вольфраму, уточнили розміщення іонів (мал. 5.7). Наразі за допомогою тунельного мікроскопа (мал. 5.8) вдається роздивитися на поверхні твердих тіл навіть окремо взятий домішковий атом (мал. 5.9). Це дає змогу конструювати штучні речовини.Все це є переконливим доказом існування молекул, атомів, іонів.
Безперервним хаотичним рухом молекул та майже відсутньою силою притягання пояснюється здатність газів необмежено розширюватися і займати весь наданий їм об’єм. Пружність газів, твердих тіл і рідин, здатність рідин змочувати тверді тіла, процеси фарбування, склеювання, деформації твердих тіл тощо свідчать про існування сил притягання і відштовхування між молекулами. Довести існування значних сил притягання між атомами або молекулами твердих тіл можна, зокрема, за допомогою досліду з товстою палицею, яку важко зламати. Але одні лише сили притягання не можуть забезпечити існування стійких атомів і молекул. Завдяки силам відштовхування молекули не проникають одна в одну.
Переконливими підтвердженнями основних положень серед дослідів є дифузія і броунівський рух.
Дифузія (від лат. diffusio – розливання)– процес спонтанного взаємного проникнення молекул однієї речовини в міжмолекулярні проміжки іншої.
Причиною дифузії є тепловий рух молекул і наявність проміжків між молекулами речовин, що змішуються. Внаслідок дифузії густина газу в усьому його об’ємі вирівнюється. Приклад дифузії в газах – це швидке поширення запахів навіть у спокійному повітрі: аромат парфумів за кілька хвилин відчувається в усій кімнаті; у рідинах – перемішування рідин різної густини. З підвищенням температури швидкість дифузії зростає внаслідок зростання швидкості частинок.
У рідинах дифузія відбувається значно повільніше, ніж у газах, але швидше ніж у твердих тілах. Це пояснюється відмінністю характеру теплового руху атомів і молекул. Якщо налити у скляний циліндр до половини його висоти концентрованого розчину мідного купоросу, а потім обережно долити дистильованої води, то спочатку можна спостерігати досить чітку межу поділу між розчином і водою. З часом вона стає розпливчастою; молекули розчину піднімаються вгору і протягом кількох діб обидві рідини перемішаються, утворюючи однорідний світло-блакитний розчин (мал. 5.10).
Дифундують і молекули (атоми) твердих тіл, але за низьких температур це відбувається досить повільно. Підтвердили це таким дослідом. На пластинку із золота ставили свинцевий циліндр з ретельно очищеною основою і залишали їх у такому положенні у приміщенні лабораторії на кілька років. Молекули золота і свинцю внаслідок дифузії протягом 4 років утворили шар з однорідного сплаву золота зі свинцем завтовшки 5 мм (хоча, звичайно, ні про яке плавлення цих металів при температурі 20 ºС не йшлося). Це пояснюється тим, що хоча переважна частина молекул або атомів твердих тіл коливаються навколо положень рівноваги однак є і частинки, які зрідка покидають їх і переходять на інші. Саме ці молекули зумовлюють дифузію у твердих тілах.
Дифузію, що відбувається через напівпроникні перегородки, називають осмосом.
У природі дифузія сприяє живленню рослин з ґрунту. Ґрунтова вода містить у собі різні розчинні речовини; деякими з них живиться рослина. Речовини засвоюються рослиною, і тому їх концентрація в кореневій системі та поза нею буде різною, що приводить до дифузійного потоку необхідних для живлення речовин з оточуючої ґрунтової води у кореневу систему. Ті розчинені речовини, які рослині не потрібні і не споживаються нею, мають однакову концентрацію як у кореневій системі, так і поза нею, – це припиняє дифузійний потік непотрібних рослині розчинених речовин у її кореневу систему.
Аналогічна роль дифузії у живленні організмів тварин і людини. Через стінки шлунка і кишок організм «всмоктує» тільки ті розчинені в страві речовини, які потрібні для побудови його клітин. Насичення крові киснем і відведення шкідливих речовин – теж дифузія (осмос).
Завдяки процесу дифузії відбувається соління огірків. Підтримання однорідного складу атмосферного повітря поблизу поверхні Землі, змішування різнорідних рідин, процес розчинення твердих тіл у рідинах, зварювання металів як шляхом їх плавлення, так і в результаті стиснення, пояснюються явищем дифузії, яке підтверджує правильність основних положень МКТ.
Одним із найпереконливіших доказів існування молекул і їх хаотичного теплового руху є броунівський рух, названий на честь англійського ботаніка Р. Броуна (1773 – 1858), який у 1827 р. відкрив хаотичний рух спори плауна у воді. Спочатку Броун вважав, що рух частинок відбувається через те, що вони живі. Однак частинки продовжували хаотично рухатися і після кип’ятіння суміші. Пізніше Броун спостерігав такий самий хаотичний рух дрібних частинок з інших речовин. Однак він не зміг пояснити відкритого ним явища.
Тепер використовують частинки фарби гумігуту, не розчинної у воді. Броунівський рух можна спостерігати у газі. Його здійснюють завислі у повітрі частинки пилу або диму в промені світла, стрілки чутливих вимірювальних приладів.
Вивченням броунівського руху займалося багато учених і нарешті було встановлено, що рух завислих частинок, який спостерігався у полі зору оптичного мікроскопа, відбувається в результаті руху молекул рідини. Молекули передають частинкам імпульс, а отже, чинять на них тиск. Якщо частинка має малу площу поверхні S1, то на один з її боків у будь-яку мить середнє значення тиску може бути більшим, ніж на інший, тому частинка здійснює безладний рух в об’ємі рідини (мал. 5.11). Ця «заплутана» ламана, побудована для однієї окремо взятої для спостереження частинки відмічанням її положення крапками через однакові послідовні інтервали часу (наприклад 30 с) не є справжньою траєкторією її руху, ця траєкторія набагато складніша.
Головною причиною броунівського руху є нескомпенсованість сил з якими молекули діють на броунівську частинку. У випадку колитиск з усіх боків на броунівську частинку однаковий вона (частинка 2) не здійснює броунівського руху (мал. 5.12).
Спостерігати можна за рухом частинок, завислих у рідинах або газах, якщо їх розміри не перевищують 10– 6 м. Броунівські частинки рухаються незалежно одна від одної. Рух броунівських частинок не припиняється за жодних обставин. Його інтенсивність тим більша, чим вища температура і менша в’язкість рідини, менша маса завислих частинок, і не залежить від їх природи. Через ці обставини його ще називають тепловим рухом завислих у рідині (або газі) частинок.
? Запитання для самоперевірки
1. У чому полягає основне завдання молекулярної фізики?
2. Що таке МКТ? Сформулюйте основні положення МКТ.
3. Що таке молекула? Атом?
4. Які спостереження й експерименти підтверджують основні положення МКТ?
5. Атоми і молекули тіла хаотично рухаються. Як це узгоджується з тим, що багато тіл зберігають форму та об’єм?
6. Що таке броунівський рух? Про що свідчить броунівський рух?
7. Що називають дифузією? Наведіть приклади дифузії в газах, рідинах і твердих тілах.
8. Чи однаково швидко забарвлюється холодна і гаряча вода від краплини чорнила?
9. Як пояснити процес фарбування твердих тіл барвниками?
10. Чим з’єднання деталей паянням подібне до склеювання?
11. Чи є безладний рух порошин у повітрі броунівським рухом?
12. Яка природа міжмолекулярних сил? Які властивості мають сили молекулярної взаємодії?
13. Як сили взаємодії між молекулами залежать від відстані між ними?
14. Як пояснюється на основі молекулярно-кінетичних уявлень поява сили пружності внаслідок стиснення і розтягування тіл?
15. Чим визначається в’язкість речовини?
16. Вода має малу в’язкість і добре змочує деталі машин. Чому ж її не використовують як мастильний матеріал?
17. Опишіть характер руху молекул у газах, рідинах і твердих тілах.
18. Який характер розміщення частинок у газах, рідинах і твердих тілах?
19. Назвіть основні властивості газів, рідин, твердих тіл.