 |
|
Ідеальний газ. Основне рівняння молекулярно-кінетичної теорії ідеального газу
Мікроскопічні і макроскопічні параметри стану. Ідеальний газ. Тиск газу. Основне рівняння молекулярно-кінетичної теорії ідеального газу.
Мікроскопічні і макроскопічні параметри стану.Сформульовані вище основні положення МКТ спочатку були застосовані до найпоширенішого і найпростішого за будовою стану речовини – газоподібного. За її допомогою на основі здобутих експериментальних результатів із дослідження газів була побудована молекулярно-кінетична теорія газів. На основі цієї теорії ви можете легко здобути газові закони, раніше встановлені експериментально. Всупереч складності руху молекул у газі він є дуже простою для математичного опису системою.
Індивідуальні характеристики молекул газу називають мікроскопічними параметрами. До них відносяться маса молекул, їх швидкість і кінетична енергія хаотичного поступального руху. Параметри газу як фізичного тіла, що вивчається звичайними методами механіки і термодинаміки, називаються макроскопічними параметрами.До них відносяться об’єм, тиск і температура. Одним із важливих завдань молекулярно-кінетичної теорії було встановлення зв’язку між макроскопічними і мікроскопічними параметрами газу. Для виконання цього завдання в молекулярно-кінетичній теорії використовувалася модель ідеального газу.
Ідеальний газ. Ідеальний газ – це газ, у якому молекули можна вважати матеріальними точками які майже не взаємодіють між собою. У цій моделі передбачалося, що об’єм усіх молекул газу дуже малий порівняно з об’ємом посудини, між молекулами не діють сили притягання, а під час зіткнень молекул між собою і зі стінками посудини діють сили відштовхування. Найближче всього ця модель газу відповідає властивостям одноатомних газів, що знаходяться при тисках близьких до атмосферного, і температурах від -200 0С до декількох тисяч градусів.
За звичайних умов власний об’єм молекул газу значно менший за об’єм посудини, у якій він міститься. Через це гази легко стискуються. Вони не мають власної форми і заповнюють увесь об’єм посудини, в якій містяться. Усі гази за не дуже високих тисків і низьких температур є близькими за своїми властивостями до ідеального газу. За високих тисків і низьких температур газ не може вважатися ідеальним. Такий газ називають реальним. Реальні гази набувають властивостей ідеального газу при значному розрідженні, коли середня відстань між молекулами набагато більша за їх розмір. Поведінка реального газу описується законами, що відрізняються від законів ідеального газу.
Тиск газу.З курсу фізики 7 класу ви знаєте, що тиск газу на стінки посудини (чи будь-яку іншу поверхню) зумовлений ударами молекул. Тиск газу на оточуючі тіла – найголовніша відмінність газу від рідин і твердих тіл. Молекули газу, що рухаються із надзвуковою швидкістю за звичайної температури, стикаючись із будь-якими перепонами на їх шляху (стінки посудини, люди, тварини, автомобілі, скелі), діють на них.
У результаті удару кожна молекула передає стінці імпульс, а отже, діє на неї з певною (дуже малою) силою. Натомість стінка діє на молекулу з такою самою силою у протилежному напрямі. Коли кількість молекул у посудині мала, ці удари відбуваються зі значними (у молекулярному масштабі) інтервалами часу, і це сприймається не як безперервна дія, а як низка послідовних дуже малих дій. Коли кількість молекул у посудині велика, що реально (крім штучно створюваних умов високого вакууму), ці удари відбуватимуться безперервно. Нескінченно малі дії окремих молекул додаються і результуюча дія сприймається як практично постійно діюча сила. Усереднена за часом результуюча сила дії молекул на одиницю площі посудини і є тиском газу.
Оскільки величезна кількість молекул газу рухається хаотично, то відбувається у середньому однакова кількість ударів у будь-якому напрямі, а отже, тиск на всі стінки посудини має бути однаковим, на що вказує закон Паскаля.
У випадку однієї чи кількох молекул поняття тиску взагалі втрачає сенс. Таким чином, тиск газу – це величина, яка характеризує стан великої кількості молекул, тобто макроскопічна величина. За одиницю тиску в СІ беруть такий тиск, за якого на 1 м2 поверхні на неї діє сила в 1 Н. Цю одиницю називають паскалем: 1 Па = 1 Н/м2. Використовують і позасистемні одиниці. Вимірюють тиск газу нижчий і вищий від атмосферного за допомогою манометрів, атмосферний – барометрами.
Основне рівняння молекулярно-кінетичної теорії ідеального газу.Використовуючи модель ідеального газу, німецький фізик Рудольф Клаузіус вивів рівняння, що встановлює зв’язок між тиском ідеального газу p, масою молекули m0, концентрацією молекул n і середнім квадратом швидкості ‹υ2›. Це рівняння називається основним рівнянням молекулярно-кінетичної теорії ідеального газу.
 . (5.2)
. (5.2)
Основне рівняння МКТ газів дає можливість, знаючи масу молекули  , знайти середню квадратичну швидкість
, знайти середню квадратичну швидкість  і концентрацію молекул
і концентрацію молекул 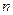 , розрахувати тиск, який чинить газ на стінку посудини, в якій він знаходиться. Це рівняння можна подати і в іншому вигляді, врахувавши, що
, розрахувати тиск, який чинить газ на стінку посудини, в якій він знаходиться. Це рівняння можна подати і в іншому вигляді, врахувавши, що  :
:
 (5.3)
(5.3)
Поділимо і помножимо праву частину рівняння (5.2) на 2:
 (5.4)
(5.4)
Тиск ідеального газу дорівнює 2/3 добутку концентрації молекул на середнє значення кінетичної енергії хаотичного руху молекул.
Основне рівняння МКТ газів підтверджує той факт, що чим більша маса молекул і їх швидкості, а також концентрація, тим більший тиск вони чинять на стінки посудини. Основне рівняння МКТ газів установлює зв’язок між легко вимірюваними величинами макроскопічного параметра тиску з такими мікроскопічними параметрами, як маса однієї молекули і концентрація молекул.
? Запитання для самоперевірки
1. Що є ідеальним газом у МКТ?
2. Назвіть умови, за яких газ можна вважати ідеальним.
3. Який механізм виникнення тиску газу з погляду МКТ?
4. Чому барабанна перетинка вуха людини не протискується молекулами атмосферного повітря, що бомбардують її?
5. Що називають концентрацією молекул?
6. Запишіть і поясніть фізичний зміст основного рівняння МКТ.
7. Як записується основне рівняння МКТ через середній квадрат швидкості молекул газу і його густину?
8. Якими приладами вимірюють тиск газу?
9. Які особливості основного рівняння ідеального газу і чому його називають основним?