 |
|
Маса та розміри молекул
Маса та розмір молекул. Кількість речовини. Стала Авогадро
Маса та розмір молекул. У світі молекул, або у мікросвіті, ми зустрічаємося з великою кількістю дуже малих частинок. Встановлено, що в 1 см3 будь-якого газу за нормальних умов (0 0 С і 760 мм. рт. ст.) міститься майже 2,7х1019 молекул. Величезна кількість молекул в одиниці об’єму свідчить про дуже малі розміри і маси самих молекул. Діаметром молекули прийнято вважати мінімальну відстань, на яку їм дають можливість зблизитися сили відштовхування. Розмір молекули – величина умовна. Відстань найменшого зближення центрів двох молекул називають ефективним діаметром молекули. Тому дуже наближено можна вважати, що молекули речовин є пружними кульками, які взаємодіють між собою на відсталі за допомогою електричного поля. Більшість молекул неорганічних речовин мають діаметр d ≈ 10-10 м і масу m = 10-26 кг.
Гігантами є, наприклад, молекули білків. Молекула дезоксирибонуклеїнової кислоти (ДНК) (мал. 5.13), яка є носієм спадкової інформації живого організму, у випрямленому стані досягає довжини десятків сантиметрів.
Оскільки маси молекул неорганічних речовин дуже малі, то в розрахунках краще використовувати не абсолютні значення мас, а відносні. Тому для зручності розрахунків ввели поняття «відносна атомна (молекулярна) маса»
 ,
,
де  – відносна молекулярна (атомна) маса;
– відносна молекулярна (атомна) маса;  – маса атома або молекули довільної речовини;
– маса атома або молекули довільної речовини;  –
–  – маса 1/12 частини маси атома карбону.
– маса 1/12 частини маси атома карбону.
Величину  використовують для порівняння з масою молекули (атома) тому, що Карбон є поширеним елементом, на цю величину майже націло діляться всі маси атомів інших хімічних елементів.
використовують для порівняння з масою молекули (атома) тому, що Карбон є поширеним елементом, на цю величину майже націло діляться всі маси атомів інших хімічних елементів.
З визначенням відносної молекулярної маси ви знайомилися в курсі хімії. Нагадаємо, наприклад, для Н2О: 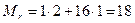 ; для Сu:
; для Сu:  .
.
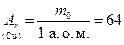 .
.
Абсолютні значення атомних мас різних хімічних елементів лежать у межах 10 – 25 – 10 – 27 кг, а їхні відносні маси, наведені у періодичній таблиці хімічних елементів Д. І. Менделєєва, – у межах 1–102 а. о. м. Для органічних речовин значення Mr (Ar) може досягати сотень тисяч.
Для практичних розрахунків наведені у цій таблиці відносні атомні маси хімічних елементів ми надалі заокруглюватимемо до найближчого цілого числа.
Щоб остаточно впевнитися в реальності існування молекул, треба визначити їх розміри. Для цього розглянемо розпливання краплі маслинової оливи об’ємом 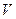 на поверхні чистої води. Можна припустити, що, розпливаючись по максимальній площі, олива утворює шар завтовшки в діаметр молекули. Вимірюючи площину плівки
на поверхні чистої води. Можна припустити, що, розпливаючись по максимальній площі, олива утворює шар завтовшки в діаметр молекули. Вимірюючи площину плівки  за максимального розпливання оливи, з відношення
за максимального розпливання оливи, з відношення  можна оцінити розміри молекул. Цим способом було оцінено розмір (діаметр) молекул оливи,
можна оцінити розміри молекул. Цим способом було оцінено розмір (діаметр) молекул оливи,  ≈ 4·10 -9 м.
≈ 4·10 -9 м.
Сучасними методами уже знайдено розміри значно менших молекул. Наприклад, лінійні розміри молекул кисню становлять 3·10 -10 м, а молекули водню – 2,6·10 -10 м.
Кількість речовини.Оскільки будь-яке тіло складається з величезної кількості окремих частинок, тому у молекулярній фізиці виникла потреба введення відносної величини – кількості речовини ν,що прямо пропорційна до кількості частинок, тобто структурних елементів, що містяться в тілі. Одиницею кількості речовини ємоль – одна з основних одиниць Міжнародної системи фізичних одиниць (СІ). Один моль – це така кількість речовини, що містить стільки ж структурних елементів будь-якої речовини, скільки міститься атомів у 12 г ізотопу карбону (С 12). Інколи вживається не коректно термін, наприклад, «моль води», а, згідно з означенням кількості речовини, слід вживати термін «моль молекул води».
Стала Авогадро.В 1 молі будь-якої речовини міститься однакова кількість структурних елементів. Цю кількість називають сталою Авогадрона честь італійського вченого ХIХ ст:  .
.
Кількість молів молекул речовини знаходять за формулою
 , (5.1)
, (5.1)
де  – кількість молекул або атомів (структурних одиниць) у певній масі речовини;
– кількість молекул або атомів (структурних одиниць) у певній масі речовини;  – маса речовини; μ – молярна маса – маса одного моля структурних одиниць речовини.;
– маса речовини; μ – молярна маса – маса одного моля структурних одиниць речовини.;  (маса однієї молекули помножена на сталу Авогадро) або
(маса однієї молекули помножена на сталу Авогадро) або  ;
;

Для молекули Н2О:  кг/моль або 18 г/моль.
кг/моль або 18 г/моль.
Усі ці параметри називаються мікроскопічними параметрами, оскільки вони характеризують дуже малі величини. Молярну масу визначають хімічними методами. Стала Авогадро з високою точністю визначена кількома фізичними методами. Маси молекул і атомів зі значним ступенем точності визначаються за допомогою масспектрографа.Це прилад, у якому за допомогою електричних і магнітних полів відбувається поділ пучків заряджених частинок (іонів) у просторі залежно від їх маси і заряду.
Із рівняння (5.1) одержимо вираз для розрахунку кількості атомів або молекул у тілі певної маси  :
:
 .
.
Знаючи густину речовини ρ, на основі попередніх понять, можна знайти наближене значення її діаметра, вважаючи молекулу кулею,  .
.
? Запитання для самоперевірки
1. Який порядок величини діаметра і маси молекул неорганічних речовин?
2. Чому молекулярна фізика використовує відносні величини для вимірювання маси? Що називають відносною молекулярною масою? Яка формула виражає це поняття?
3. Чому дорівнює відносна молекулярна маса води?
4. Що таке кількість речовини? Яка формула виражає зміст цього поняття? Яка одиниця кількості речовини? Дайте визначення цієї одиниці.
5. Що називають сталою Авогадро? Чому вона дорівнює?
6. Що таке молярна маса речовини? Яка формула виражає зміст цього поняття? Яка одиниця молярної маси?
7. Установіть зв’язок між молярною масою та відносною молекулярною масою речовини.
8. За якою формулою визначають кількість молекул у довільній масі речовини?
9. Визначте молярну масу будь-якої речовини. Чому дорівнює молярна маса вуглекислого газу?
Вправа 9.
1. (п). Визначити молярну масу води. Скільки молів молекул води міститься в 1 кг води? Скільки молекул води міститься в 1 м3 води? Розрахувати масу і об’єм однієї молекули води.
2 (д). Радонові ванни містять 1,8·106 атомів радону на 1 л води. Обчислити, на скільки молекул води припадає один атом радону.
3 (c). У посудині об’ємом 40 л міститься 10 кг ацетилену (С2Н2). Визначити концентрацію молекул газу.
4 (c). Який об’єм займуть 10-15 молів скляних кульок радіусом 0,5 см при їх щільній упаковці?
5 (c). Який об’єм займуть 1,0·10 22 атомів алмазу?
6 (c). За 10 діб із посудини випарувалося 100 г води. Яка середня кількість молекул води «вилітала» з поверхні щосекунди?
7 (в).Визначити початкову температуру газу, що знаходиться у закритій посудині, якщо при збільшенні тиску на 0,4% від початкового тиску, температура зросла на 1 К.
8 (в). Скільки частинок (атомів та молекул) знаходиться в азоті масою 1,0 г, якщо ступінь дисоціації азоту 7%?
9 (в). Кристали кухонної солі NaCl кубічної системи складаються з іонів натрію і хлору. Визначити середні відстані між їх центрами. Густина кухонної солі 2200 кг/м3.
10 (в). Супутник площею поперечного перерізу S = 1 м 2 рухається з першою космічною швидкістю по навколоземній орбіті на висоті 200 км. Атмосферний тиск на цій висоті 1,37·10- 4 Па, температура 1226 К.