 |
|
Математическое описание стоячих волн
В одномерном случае две волны одинаковой частоты, длины волны и амплитуды, распространяющиеся в противоположных направлениях (например, навстречу друг другу), будут взаимодействовать, в результате чего может возникнуть стоячая волна. Например, гармоничная волна, распространяясь вправо, достигая конца струны, производит стоячую волну. Волна, что отражается от конца, должна иметь такую же амплитуду и частоту, как и падающая волна.
Рассмотрим падающую и отраженную волны в виде:
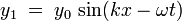

где:
· y0 — амплитуда волны,
· 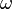 — циклическая (угловая) частота, измеряемая в радианах в секунду,
— циклическая (угловая) частота, измеряемая в радианах в секунду,
· k — волновой вектор, измеряется в радианах на метр, и рассчитывается как 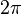 поделённое на длину волны
поделённое на длину волны 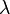 ,
,
· x и t — переменные для обозначения длины и времени.
Поэтому результирующее уравнение для стоячей волны y будет в виде суммы y1 и y2:
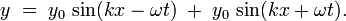
Используя тригонометрические соотношения, это уравнение можно переписать в виде:
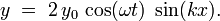
Если рассматривать моды 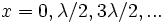 и антимоды
и антимоды 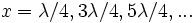 , то расстояние между соседними модами / антимодами будет равно половине длины волны
, то расстояние между соседними модами / антимодами будет равно половине длины волны 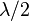 .
.
Волновое уравнение
Для того, чтобы получить стоячие волны как результат решения однородного дифференциального волнового уравнения (Даламбера)
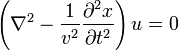
необходимо соответствующим образом задать его граничные условия (например, закрепить концы струны).
В общем случае неоднородного дифференциального уравнения
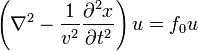 ,
,
где 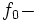 выполняет роль «силы», с помощью которой осуществляется смещение в определенной точке струны, стоячая волна возникает автоматически
выполняет роль «силы», с помощью которой осуществляется смещение в определенной точке струны, стоячая волна возникает автоматически
28.Термодинамическая система — это некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом. Также обычно полагается, что такая система подчиняется статистическим закономерностям. Для термодинамических систем справедливы законы термодинамики.
Для описания термодинамической системы вводят так называемые термодинамические величины — набор физических величин, значения которых определяют термодинамическое состояние системы. Примерами термодинамических величин являются:
· температура
· давление
· объём
· внутренняя энергия
· энтропия
· энтальпия
· свободная энергия Гельмгольца
· энергия Гиббса
Если термодинамическое состояние системы не меняется со временем, то говорят, что система находится в состоянии равновесия. Строго говоря, термодинамические величины, приведённые выше, могут быть определены только в состоянии термодинамического равновесия.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
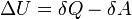
где
· 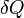 — подведённое к телу количество теплоты, измеренное в джоулях
— подведённое к телу количество теплоты, измеренное в джоулях
· 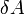 [1] — работа, совершаемая телом против внешних сил, измеренная в джоулях
[1] — работа, совершаемая телом против внешних сил, измеренная в джоулях
Эта формула является математическим выражением первого начала термодинамики
Для квазистатических процессов выполняется следующее соотношение:
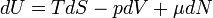
где
· 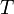 — температура, измеренная в кельвинах
— температура, измеренная в кельвинах
· 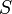 — энтропия, измеренная в джоулях/кельвин
— энтропия, измеренная в джоулях/кельвин
· 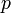 — давление, измеренное в паскалях
— давление, измеренное в паскалях
·  — химический потенциал
— химический потенциал
·  — количество частиц в системе
— количество частиц в системе
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
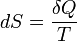 ,
,
где 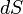 — приращение энтропии;
— приращение энтропии; 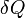 — минимальная теплота, подведенная к системе; T — абсолютная температура процесса;
— минимальная теплота, подведенная к системе; T — абсолютная температура процесса;
Свобо́дная эне́ргия Гельмго́льца (или просто свобо́дная эне́ргия) — термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами.
Свободная энергия Гельмгольца для системы с постоянным числом частиц определяется так:
· 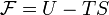 , где
, где 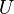 — внутренняя энергия,
— внутренняя энергия, 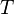 — абсолютная температура,
— абсолютная температура, 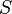 — энтропия.
— энтропия.
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:

где 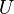 — внутренняя энергия,
— внутренняя энергия, 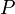 — давление,
— давление, 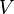 — объём,
— объём, 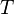 — абсолютная температура,
— абсолютная температура, 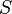 — энтропия.
— энтропия.