 |
|
Изотермический процесс
Изотермический процесс протекает при постоянной температуре. Уравнение изотермического процесса T=const.
В соответствии с уравнением политропы Tvn-1=const, политропа превращается в изотерму Т=const при показателе политропы n=1.
Теплоемкость изотермы при n=1 равна бесконечности cт=±∞. Доля теплоты, идущая на увеличение внутренней энергии в изотермическом процессе равна нулю α= 0.
Кроме уравнения Т=const, для изотемического процесса можно записать уравнение Pvn = const, которое при n=1 превращается в уравнение Pv=const.
Таким образом, основные величины, характеризующие изотермический процесс будут представлены выражениями:

|
Теплота изотермического процесса равна работе, т.к. изменение внутренней энергии идеального газа при Т=const равно нулю.
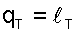
| (5.27) |
а работа изменения объема определяется по уравнению:
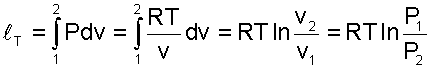
| (5.28) |
Изменение внутенней энергии и энтальпии в изотермическом процессе для идеального газа равно нулю;

|
а изменение энтропии определяется выражением:
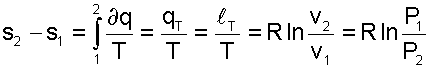
| (5.29) |
Адиабатный процесс
Адиабатный процесс - это процесс без теплообмена с окружающей средой, т.е. для него δq = 0 или q = 0.
Уравнение адиабатного процесса соответствует выражению s=const, т.к. δq=Tds=0 при ds=0.
Поэтому адиабатный процесс имеет еще одно название - изоэнтропный процесс.
Теплоемкость адиабаты равна нулю сs=0, т.к. температура в этом процессе изменяется, а δq=cdT=0.
Показатель политропы при сS=0 будет соответствовать выражению n=cP/cV=к, т.е. показатель политропы в адиабатном процессе равен коэффициенту Пуассона.
Доля теплоты, идущая на увеличение внутренней энергии в адиабатном процессе равна бесконечности α=∞.
Таким образом, основные величины, характеризующие адиабатный процесс будут представлены выражениями:

|
Теплота адиабатного процесса равна нулю, следовательно, для идеального газа в адиабатном процессе работа равна изменению внутренней энергии, взятой с обратным знаком:
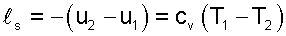
| (5.30) |
Изменение энтальпии в адиабатном процессе ведется традиционно h2-h1=cP(T2-T1), а изменения энтропии в этом процессе равно нулю s2-s1=0.
36.Энтропи́я (от др.-греч. ἐντροπία - поворот, превращение) — в естественных науках мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации; в исторической науке, для экспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса).
Энтропия в информатике — степень неполноты, неопределённости знаний.
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
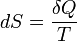 ,
,
где 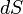 — приращение энтропии;
— приращение энтропии; 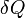 — минимальная теплота, подведенная к системе; T — абсолютная температура процесса;
— минимальная теплота, подведенная к системе; T — абсолютная температура процесса;
Термодинамическая энтропия — термодинамическая функция, характеризующая меру неупорядоченности термодинамической системы, то есть неоднородность расположения и движения её частиц.
37.Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:

где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная.
Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Хотя модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высоких температурах, в других условиях её соответствие с опытом гораздо хуже. В частности, это проявляется в том, что реальные газы могут быть переведены в жидкое и даже в твёрдое состояние, а идеальные — не могут.
Для более точного описания поведения реальных газов при низких температурах была создана модель газа Ван-дер-Ваальса, учитывающая силы межмолекулярного взаимодействия. В этой модели внутренняя энергия 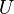 становится функцией не только температуры, но и объёма.
становится функцией не только температуры, но и объёма.
Уравнение Ван-дер-Ваальса — это одно из широко известных приближённых уравнений состояния, имеющее компактную форму и учитывающее основные характеристики газа с межмолекулярным взаимодействием
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:

где
·  — давление,
— давление,
· 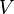 — молярный объём,
— молярный объём,
· 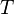 — абсолютная температура,
— абсолютная температура,
·  — универсальная газовая постоянная.
— универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка  учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка
учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка  — объем молекул газа.
— объем молекул газа.
Для  молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
молей газа Ван-дер-Ваальса уравнение состояния выглядит так:

где
· 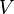 — объём,
— объём,
Вывод уравнения
Наиболее известны два способа получения уравнения: традиционный вывод самого Ван-дер-Ваальса и вывод методами статистической физики.
Традиционный вывод
Рассмотрим сначала газ, в котором частицы не взаимодействуют друг с другом, такой газ удовлетворяет уравнению состояния идеального газа:

Далее предположим, что частицы данного газа являются упругими сферами одинакового радиуса r. Так как газ находится в сосуде конечного объёма, то пространство, где могут перемещаться частицы, будет несколько меньше. В исходной формуле следует вычесть из всего объёма некую его часть b, которая, вообще говоря, зависит только от вещества, из которого состоит газ. Таким образом, получается следующее уравнение:
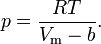
Стоит заметить, что вычитаемый объём b не будет в точности равен суммарному объёму всех частиц. Если частицы считать твёрдыми и абсолютно упругими шариками, то вычитаемый объём будет примерно в четыре раза больше. Это легко объясняется тем, что центры упругих шаров не могут приближаться на расстояние ближе  .
.
Далее Ван-дер-Ваальс рассматривает силы притяжения между частицами газа и делает следующие допущения:
· Частицы распределёнными равномерно по всему объёму.
· Силы притяжения стенок сосуда не учитываются, что в общем случае неверно.
· Частицы, находящиеся внутри сосуда и непосредственно у стенок, ощущают притяжение по-разному: внутри сосуда действующие силы притяжения других частиц компенсируют друг друга.
Таким образом, для частиц внутри сосуда силы притяжения не учитываются. А частицы, находящиеся непосредственно у края сосуда, затягиваются внутрь силой, пропорциональной концентрации:
 .
.
Число частиц, которые находятся непосредственно у стенок, в свою очередь тоже предполагается пропорциональным концентрации n. Можно считать, что давление на стенки сосуда меньше на некоторую величину, обратно пропорциональную квадрату объёма:

Окончательное уравнение:
