 |
|
Вывод с помощью статистической физики
Внутренняя энергия газа Ван-дер-Ваальса
Потенциальная энергия межмолекулярных сил взаимодействия вычисляется как работа, которую совершают эти силы, при разведении молекул на бесконечность:

Внутренняя энергия газа Ван-дер-Ваальса складывается из его кинетической энергии (энергии теплового движения молекул) и только что нами посчитанной потенциальной. Так, для одного моль газа:
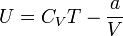
где  — молярная теплоёмкость при постоянном объёме, которая предполагается не зависящей от температуры.
— молярная теплоёмкость при постоянном объёме, которая предполагается не зависящей от температуры.
Эффе́ктом Джо́уля — То́мсона называется изменение температуры газа при адиабатическом дросселировании — медленном протекании газа под действием постоянного перепада давлений сквозь дроссель (пористую перегородку). Данный эффект является одним из методов получения низких температур.
Изменение энергии газа в ходе этого процесса будет равно работе:  . Следовательно, из определения энтальпии (
. Следовательно, из определения энтальпии (  ) следует, что процесс изоэнтальпиен.
) следует, что процесс изоэнтальпиен.
Изменение температуры при малом изменении давления (дифференциальный эффект) в результате процесса Джоуля — Томсона определяется производной 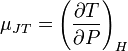 , называемой коэффициентом Джоуля — Томсона. С помощью элементарных преобразований можно получить выражение для этого коэффициента:
, называемой коэффициентом Джоуля — Томсона. С помощью элементарных преобразований можно получить выражение для этого коэффициента:
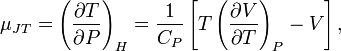
где 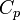 — теплоёмкость при постоянном давлении. Для идеального газа
— теплоёмкость при постоянном давлении. Для идеального газа 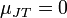 , а для реального газа он определяется уравнением состояния.
, а для реального газа он определяется уравнением состояния.
Если при протекании газа через пористую перегородку температура возрастает (  ), то эффект называют отрицательным, и наоборот, если температура убывает (
), то эффект называют отрицательным, и наоборот, если температура убывает (  ), то процесс называют положительным. Температуру, при которой
), то процесс называют положительным. Температуру, при которой  меняет знак, называют температурой инверсии.
меняет знак, называют температурой инверсии.
Применение
· Процесс Джоуля — Томсона используют для получения низких температур. Для этой цели обычно применяют интегральный процесс, при котором давление изменяется в широких пределах.
· Измерение  позволяет установить уравнение состояния газа.
позволяет установить уравнение состояния газа.
Фа́зовый перехо́д (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую при изменении внешних условий. С точки зрения движения системы по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и т. п.), фазовый переход происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
Поскольку разделение на термодинамические фазы — более мелкая классификация состояний, чем разделение по агрегатным состояниям вещества, то далеко не каждый фазовый переход сопровождается сменой агрегатного состояния. Однако любая смена агрегатного состояния есть фазовый переход.
Наиболее часто рассматриваются фазовые переходы при изменении температуры, но при постоянном давлении (как правило равном 1 атмосфере). Именно поэтому часто употребляют термины «точка» (а не линия) фазового перехода, температура плавления и т. д. Разумеется, фазовый переход может происходить и при изменении давления, и при постоянных температуре и давлении, но и при изменении концентрации компонентов (например, появление кристалликов соли в растворе, который достиг насыщения).
При фазовом переходе первого рода скачкообразно изменяются самые главные, первичные экстенсивные параметры: удельный объём, количество запасённой внутренней энергии, концентрация компонентов и т. п. Подчеркнём: имеется в виду скачкообразное изменение этих величин при изменении температуры, давления и т. п., а не скачкообразное изменение во времени (насчёт последнего см. ниже раздел Динамика фазовых переходов).
Наиболее распространённые примеры фазовых переходов первого рода:
· плавление и кристаллизация
· испарение и конденсация
· сублимация и десублимация
При фазовом переходе второго рода плотность и внутренняя энергия не меняются, так что невооружённым глазом такой фазовый переход может быть незаметен. Скачок же испытывают их производные по температуре и давлению: теплоёмкость, коэффициент теплового расширения, различные восприимчивости и т. д.
Фазовые переходы второго рода происходят в тех случаях, когда меняется симметрия строения вещества (симметрия может полностью исчезнуть или понизиться). Описание фазового перехода второго рода как следствие изменения симметрии даётся теорией Ландау. В настоящее время принято говорить не об изменении симметрии, но о появлении в точке перехода параметра порядка, равного нулю в менее упорядоченной фазе и изменяющегося от нуля (в точке перехода) до ненулевых значений в более упорядоченной фазе.
Наиболее распространённые примеры фазовых переходов второго рода:
· прохождение системы через критическую точку
· переход парамагнетик-ферромагнетик или парамагнетик-антиферромагнетик (параметр порядка — намагниченность)
· переход металлов и сплавов в состояние сверхпроводимости (параметр порядка — плотность сверхпроводящего конденсата)
· переход жидкого гелия в сверхтекучее состояние (п.п. — плотность сверхтекучей компоненты)
· переход аморфных материалов в стеклообразное состояние
Современная физика исследует также системы, обладающие фазовыми переходами третьего или более высокого рода.
В последнее время широкое распространение получило понятие квантовый фазовый переход, т.е. фазовый переход, управляемый не классическими тепловыми флуктуациями, а квантовыми, которые существуют даже при абсолютном нуле температур, где классический фазовый переход не может реализоваться вследствие теоремы Нернста.