 |
|
Показатель политропы
Кривая на термодинамических диаграммах, изображающая политропный процесс, называется «политропа». Для идеального газа уравнение политропы может быть записано в виде:

где р — давление, V — объем газа, n — «показатель политропы».
 . Здесь
. Здесь  — теплоёмкость газа в данном процессе,
— теплоёмкость газа в данном процессе,  и
и  — теплоемкости того же газа, соответственно, при постоянном давлении и объеме.
— теплоемкости того же газа, соответственно, при постоянном давлении и объеме.
В зависимости от вида процесса, можно определить значение n:
· Изотермический процесс:  , так как
, так как 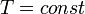 , значит, по закону Бойля — Мариотта
, значит, по закону Бойля — Мариотта  , и уравнение политропы вынуждено выглядеть так:
, и уравнение политропы вынуждено выглядеть так:  .
.
· Изобарный процесс: 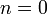 , так как
, так как  , и уравнение политропы вынуждено выглядеть так:
, и уравнение политропы вынуждено выглядеть так:  .
.
· Адиабатный процесс:  (здесь
(здесь  — показатель адиабаты), это следует из уравнения Пуассона.
— показатель адиабаты), это следует из уравнения Пуассона.
· Изохорный процесс:  , так как
, так как  , и в процессе
, и в процессе 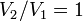 , а из уравнения политропы следует, что
, а из уравнения политропы следует, что 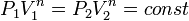 , то есть, что
, то есть, что 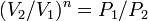 , то есть
, то есть  , а это возможно, только если
, а это возможно, только если  является бесконечным.
является бесконечным.
Частные случаи политропных процессов
Рассмотрим частные случаи политропных процессов, имеющих наибольшее распространение в практике. К таким процессам относятся: изобарный, изохорный, изотермический и адиабатный процессы. Для каждого из этих процессов оределим характеристики политропы:
n- показатель политропы,

|
теплоемкость политропы,

|
долю теплоты, идущую на увеличение внутренней энергии

|
Изобарный процесс
Изобарный процесс, протекает при постоянном давлении. Уравнение изобарного процесса Р=const.
В соответствии с уравнением политропы Pvn=const, политропа превращается в изобару Р=const при показателе политропы n=0.
Теплоемкость изобары cР при n=0 соответствует выражению c=cVk=cP.
Доля теплоты, идущая на увеличение внутренней энергии в изобарном процессе, соответствует величине α=1/к. Кроме уравнения Р=const, для изобарного процесса можно записать уравнение  , которое при n=0 превращается в уравнение T/v=const. Таким образом, основные величины, характеризующие изобарный процесс, будут представлены выражениями:
, которое при n=0 превращается в уравнение T/v=const. Таким образом, основные величины, характеризующие изобарный процесс, будут представлены выражениями:

|
Теплота изобарного процесса соответствует выражению:

| (5.17) |
а работа изменения объема - выражению:

| (5.18) |
Изменение внутенней энергии, энтальпии и энтропии в изобарном процессе соответствует выражениям:

| (5.19) |

| (5.20) |

| (5.21) |
Изохорный процесс
Изохорный процесс, протекает при постоянном объеме. Уравнение изохоного процесса v=const.
В соответствии с уравнением политропы , политропа превращается в изохору v=const при показателе политропы n=±∞.
Теплоемкость изохоры при n=±∞ соответствует выражению c=cV. Доля теплоты, идущая на увеличение внутренней энергии в изохорном процессе, соответствует величине α= 1.
Кроме уравнения v=const, для изохорного процесса можно записать уравнение  , которое при n=±∞ превращается в уравнение T/P=const.
, которое при n=±∞ превращается в уравнение T/P=const.
Таким образом, основные величины, характеризующие изохорный процесс будут представлены выражениями:

|
Теплота изохорного процесса соответствует выражению

| (5.22) |
а работа изменения объема равна нулю, т.к. dv=0:

| (5.23) |
Изменение внутенней энергии, энтальпии и энтропии в изохорном процессе соответствует выражениям:
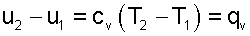
| (5.24) |

| (5.25) |

| (5.26) |