 |
|
Основные положения МКТ
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
В основе молекулярно-кинетической теории лежат три основных положения:
1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
2. Атомы и молекулы находятся в непрерывном хаотическом движении.
3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
29.
| Закон о равномерном распределении энергии по степеням свободы |
Итак, средняя энергия приходящаяся на одну степень свободы:
У одноатомной молекулы i = 3, тогда для одноатомных молекул
для двухатомных молекул
для трёхатомных молекул
Таким образом, на среднюю кинетическую энергию молекулы, имеющей i-степеней свободы, приходится
Это и есть закон Больцмана о равномерном распределении средней кинетической энергии по степеням свободы. Если система находится в состоянии термодинамического равновесия, при температуре Т, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы. На каждую поступательную iп и вращательную iвр степени свободы приходится энергия 1/2 kT. Для колебательной iкол, степени свободы она равна kT. Таким образом число степеней свободы i = iп + iвр + 2iкол
Для одноатомных газов это выполняется в очень широких пределах, а для двухатомных газов только в интервале от 100 до 1000 К. Отличие связано с проявлением квантовых законов. При низких температурах вращательное движение как бы «вымерзает» и двухатомные молекулы движутся поступательно, как одноатомные; равны их теплоёмкости. |
30.Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:

где
·  — давление,
— давление,
·  — молярный объём,
— молярный объём,
·  — универсальная газовая постоянная
— универсальная газовая постоянная
· 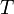 — абсолютная температура,К.
— абсолютная температура,К.
Так как  , где
, где  — количество вещества, а
— количество вещества, а 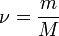 , где
, где  — масса,
— масса,  — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать:

Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:


Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
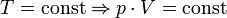 — закон Бойля — Мариотта.
— закон Бойля — Мариотта.
 — Закон Гей-Люссака.
— Закон Гей-Люссака.
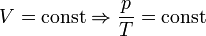 — закон Шарля (второй закон Гей-Люссака, 1808 г.)
— закон Шарля (второй закон Гей-Люссака, 1808 г.)
А в форме пропорции  этот закон удобен для расчёта перевода газа из одного состояния в другое.
этот закон удобен для расчёта перевода газа из одного состояния в другое.
С точки зрения химика этот закон может звучать несколько иначе: Объёмы вступающих в реакцию газов при одинаковых условиях (температуре, давлении) относятся друг к другу и к объёмам образующихся газообразных соединений как простые целые числа. Например, 1 объём водорода соединяется с 1 объёмом хлора, при этом образуются 2 объёма хлороводорода:

1 объём азота соединяется с 3 объёмами водорода с образованием 2 объёмов аммиака:
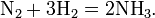
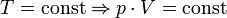 — закон Бойля — Мариотта.
— закон Бойля — Мариотта.
Закон Бойля — Мариотта назван в честь ирландского физика, химика и философа Роберта Бойля (1627—1691), открывшего его в 1662 г., а также в честь французского физика Эдма Мариотта (1620—1684), который открыл этот закон независимо от Бойля в 1677 году.
В некоторых случаях (в газовой динамике) уравнение состояния идеального газа удобно записывать в форме

где 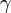 — показатель адиабаты,
— показатель адиабаты,  — внутренняя энергия единицы массы вещества.
— внутренняя энергия единицы массы вещества.
Эмиль Амага обнаружил, что при высоких давлениях поведение газов отклоняется от закона Бойля — Мариотта. И это обстоятельство может быть прояснено на основании молекулярных представлений.
С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объём газа. Это обстоятельство увеличивает число ударов молекул в стенку, так как благодаря ему сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки.
С другой стороны, в сильно сжатом и, следовательно, более плотном газе молекулы заметно притягиваются к другим молекулам гораздо большую часть времени, чем молекулы в разреженном газе. Это, наоборот, уменьшает число ударов молекул в стенку, так как при наличии притяжения к другим молекулам молекулы газа движутся по направлению к стенке с меньшей скоростью, чем при отсутствии притяжения. При не слишком больших давлениях более существенным является второе обстоятельство и произведение  немного уменьшается. При очень высоких давлениях большую роль играет первое обстоятельство и произведение
немного уменьшается. При очень высоких давлениях большую роль играет первое обстоятельство и произведение  увеличивается.
увеличивается.
31.Закон распределения молекул идеального газа по скоростям, теоретически полученный Максвеллом в 1860 г. определяет, какое число dN молекул однородного (p = const) одноатомного идеального газа из общего числа N его молекул в единице объёма имеет при данной температуре Т скорости, заключенные в интервале от v до v + dv.
Для вывода функции распределения молекул по скоростям f(v) равной отношению числа молекул dN, скорости которых лежат в интервале v ÷ v + dv к общему числу молекул N и величине интервала dv
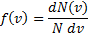
Максвелл использовал два предложения:
а) все направления в пространстве равноправны и поэтому любое направление движения частицы, т.е. любое направление скорости одинаково вероятно. Это свойство иногда называют свойством изотропности функции распределения.
б) движение по трем взаимно перпендикулярным осям независимы т.е. х-компоненты скорости  не зависит от того каково значения ее компонент
не зависит от того каково значения ее компонент  или
или 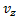 . И тогда вывод f (v) делается сначала для одной компоненты
. И тогда вывод f (v) делается сначала для одной компоненты  , а затем обобщается на все координаты скорости.
, а затем обобщается на все координаты скорости.
Считается также, что газ состоит из очень большого числа N тождественных молекул находящихся в состоянии беспорядочного теплового движения при одинаковой температуре. Силовые поля на газ не действуют.
Функции f (v) определяет относительное число молекул dN(v)/N скорости которых лежат в интервале от v до v + dv (например: газ имеет N = 106 молекул, при этом dN = 100
молекул имеют скорости от v =100 до v + dv =101 м/с (dv = 1 м  ) тогда
) тогда  .
.
Используя методы теории вероятностей, Максвелл нашел функцию f (v) - закон распределения молекул идеального газа по скоростям:

f (v ) зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т)
f(v) зависит от отношения кинетической энергии молекулы, отвечающей рассматриваемой скорости  к величине kT характеризующей среднюю тепловую энергию молекул газа.
к величине kT характеризующей среднюю тепловую энергию молекул газа.
 При малых v
При малых v  и функция f(v) изменяется практически по параболе
и функция f(v) изменяется практически по параболе  . При возрастании v множитель
. При возрастании v множитель  уменьшается быстрее, чем растет множитель
уменьшается быстрее, чем растет множитель  , т.е. имеется max функции f(v). Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью
, т.е. имеется max функции f(v). Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью  найдем из условия
найдем из условия


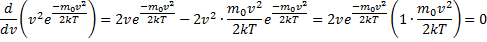
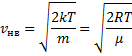
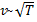 , следовательно, с ростом температуры наиболее вероятная скорость растёт, но площадь S, ограниченная кривой функции распределения остаётся неизменной, так как из условия нормировки
, следовательно, с ростом температуры наиболее вероятная скорость растёт, но площадь S, ограниченная кривой функции распределения остаётся неизменной, так как из условия нормировки  (так как вероятность достоверного события равна 1), поэтому при повышении температуры кривая распределения f (v) будет растягиваться и понижаться.
(так как вероятность достоверного события равна 1), поэтому при повышении температуры кривая распределения f (v) будет растягиваться и понижаться.
 В статистической физике среднее значение какой-либо величины определяется как интеграл от 0 до бесконечности произведения величины на плотность вероятности этой величины (статистический вес)
В статистической физике среднее значение какой-либо величины определяется как интеграл от 0 до бесконечности произведения величины на плотность вероятности этой величины (статистический вес)
<X>= 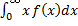
Тогда средняя арифметическая скорость молекул

и интегрируя по частям получили

Скорости, характеризующие состояние газа
· 
· 
· 
Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести.
Для идеального газа, имеющего постоянную температуру 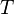 и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения
и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения 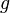 одинаково), барометрическая формула имеет следующий вид:
одинаково), барометрическая формула имеет следующий вид:

где  — давление газа в слое, расположенном на высоте
— давление газа в слое, расположенном на высоте  ,
, 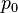 — давление на нулевом уровне (
— давление на нулевом уровне (  ),
),  — молярная масса газа,
— молярная масса газа,  — газовая постоянная,
— газовая постоянная, 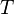 — абсолютная температура. Из барометрической формулы следует, что концентрация молекул
— абсолютная температура. Из барометрической формулы следует, что концентрация молекул  (или плотность газа) убывает с высотой по тому же закону:
(или плотность газа) убывает с высотой по тому же закону:

где  — масса молекулы газа,
— масса молекулы газа,  — постоянная Больцмана.
— постоянная Больцмана.
Барометрическая формула может быть получена из закона распределения молекул идеального газа по скоростям и координатам в потенциальном силовом поле (см. Статистика Максвелла — Больцмана). При этом должны выполняться два условия: постоянство температуры газа и однородность силового поля. Аналогичные условия могут выполняться и для мельчайших твёрдых частичек, взвешенных в жидкости или газе. Основываясь на этом, французский физик Ж. Перрен в 1908 году применил барометрическую формулу к распределению по высоте частичек эмульсии, что позволило ему непосредственно определить значение постоянной Больцмана.
Барометрическая формула показывает, что плотность газа уменьшается с высотой по экспоненциальному закону. Величина  , определяющая быстроту спада плотности, представляет собой отношение потенциальной энергии частиц к их средней кинетической энергии, пропорциональной
, определяющая быстроту спада плотности, представляет собой отношение потенциальной энергии частиц к их средней кинетической энергии, пропорциональной  . Чем выше температура
. Чем выше температура 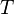 , тем медленнее убывает плотность с высотой. С другой стороны, возрастание силы тяжести
, тем медленнее убывает плотность с высотой. С другой стороны, возрастание силы тяжести  (при неизменной температуре) приводит к значительно большему уплотнению нижних слоев и увеличению перепада (градиента) плотности. Действующая на частицы сила тяжести
(при неизменной температуре) приводит к значительно большему уплотнению нижних слоев и увеличению перепада (градиента) плотности. Действующая на частицы сила тяжести  может изменяться за счёт двух величин: ускорения
может изменяться за счёт двух величин: ускорения 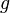 и массы частиц
и массы частиц  .
.
Следовательно, в смеси газов, находящейся в поле тяжести, молекулы различной массы по-разному распределяются по высоте.
Реальное распределение давления и плотности воздуха в земной атмосфере не следует барометрической формуле, так как в пределах атмосферы температура и ускорение свободного падения меняются с высотой и географической широтой. Кроме того, атмосферное давление увеличивается с концентрацией в атмосфере паров воды.
Барометрическая формула лежит в основе барометрического нивелирования — метода определения разности высот  между двумя точками по измеряемому в этих точках давлению (
между двумя точками по измеряемому в этих точках давлению (  и
и  ). Поскольку атмосферное давление зависит от погоды, интервал времени между измерениями должен быть возможно меньшим, а пункты измерения располагаться не слишком далеко друг от друга. Барометрическая формула записывается в этом случае в виде:
). Поскольку атмосферное давление зависит от погоды, интервал времени между измерениями должен быть возможно меньшим, а пункты измерения располагаться не слишком далеко друг от друга. Барометрическая формула записывается в этом случае в виде:  (в м), где
(в м), где  — средняя температура слоя воздуха между точками измерения,
— средняя температура слоя воздуха между точками измерения,  — температурный коэффициент объёмного расширения воздуха. Погрешность при расчётах по этой формуле не превышает 0,1—0,5 % от измеряемой высоты. Более точна формула Лапласа, учитывающая влияние влажности воздуха и изменение ускорения свободного падения.
— температурный коэффициент объёмного расширения воздуха. Погрешность при расчётах по этой формуле не превышает 0,1—0,5 % от измеряемой высоты. Более точна формула Лапласа, учитывающая влияние влажности воздуха и изменение ускорения свободного падения.
32.
| Число столкновений и средняя длина свободного пробега молекул в газах |
Обозначим 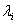 – длина свободного пробега молекулы.
Медленность явлений переноса, например диффузии ароматических веществ – «распространение запаха», - при относительно высокой скорости теплового движения молекул (103 м/с) объясняется столкновениями молекул. Молекула газа время от времени сталкивается с другими молекулами. В момент столкновения молекула резко изменяет величину и направление скорости своего движения. Расстояние, проходимое молекулой в среднем без столкновений, называется средней длиной свободного пробега. Средняя длина свободного пробега равна: – длина свободного пробега молекулы.
Медленность явлений переноса, например диффузии ароматических веществ – «распространение запаха», - при относительно высокой скорости теплового движения молекул (103 м/с) объясняется столкновениями молекул. Молекула газа время от времени сталкивается с другими молекулами. В момент столкновения молекула резко изменяет величину и направление скорости своего движения. Расстояние, проходимое молекулой в среднем без столкновений, называется средней длиной свободного пробега. Средняя длина свободного пробега равна:
где
Модель идеального газа – твёрдые шарики одного диаметра, взаимодействующие между собой только при столкновении.Обозначим σ – эффективное сечение молекулы, т.е. полное поперечное сечение рассеяния, характеризующее столкновение между двумя молекулами (рис. 3.2).
За одну секунду молекула проходит путь, равный средней арифметической скорости
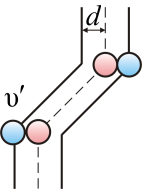
Подсчитаем число столкновений ν. Вероятность столкновения трех и более молекул бесконечно мала. Предположим, что все молекулы застыли, кроме одной. Её траектория будет представлять собой ломаную линию. Столкновения будут только с теми молекулами, центры которых лежат внутри цилиндра радиусом d (рис. 3.3).
Путь, который пройдет молекула за одну секунду, равен длине цилиндра
На самом деле, все молекулы движутся (и в сторону, и навстречу друг другу), поэтому число соударений определяется средней скоростью движения молекул относительно друг друга. По закону сложения случайных величин
А так как средняя длина свободного пробега
Уравнение состояния идеального газа позволяет нам выразить n через давление P и термодинамическую температуру Т. Так как
Таким образом, при заданной температуре средняя длина свободного пробега обратно пропорциональна давлению Р:
Например, при d = 3 Å = 3×10-10 м, Р = 1 атм., Т = 300 К, |
33.Явление переноса.
До сих пор рассматривался газ, находящийся в равновесном состоянии, т.е. когда во всех точках занимаемого объема такие величины, как T, P и n – концентрация молекул одинаковые.
Рассмотрим процессы, возникающие при отклонении газа от равновесия.
Явления (процессы), возникающие в газах при отклонении их от равновесия, называются явлениями переноса.
К этим явлениям относятся диффузия, теплопроводность и внутреннее трение. Все явления переноса связаны с выравниванием того или иного физического параметра в результате хаотического теплового движения молекул.
Процесс установления внутри фаз равновесного распределения концентрации газовых молекул (а также молекул жидких и твёрдых тел) называется диффузией.
Процесс направленного переноса внутренней энергии (выравнивание температуры) называется теплопроводностью.
Процесс направленного переноса количества движения (связано с возникновением сил трения между слоями) называется внутренним трением.
В газах все эти явления связаны с нарушением максвелловского распределения молекул по скоростям. Во всех этих явлениях мы имеем дело с переносом в газе какой-либо физической величины:
тепла ΔQ – теплопроводность;
количества движения ΔL – внутреннее трение;
массы ΔM – диффузия.

| Основа вывода всех уравнений едина, а именно: выбирается покоящаяся среда и выравнивание той или иной величины происходит исключительно благодаря неупорядоченному тепловому движению молекул (нет перемешивания). Т.к. движение газовых молекул беспорядочно, то любое из возможных движений считается равновероятным.
Выбирается произвольная площадка ΔS и рассматривается переход молекул из одной области в другую через площадку за время Δt.
Обозначая переносимую величину за B, получим:
 , (19) , (19)
|
где k – коэффициент пропорциональности;
l – коэффициент теплопроводности;
Д – коэффициент диффузии;
h – коэффициент вязкости;
 – градиент вдоль направления Х:
– градиент вдоль направления Х:
dH = dT – температуры;
dH = dn – концентрации;
dH = dv – скорости;
dB – переносимая величина:
dB = dQ – теплота;
dB = dM – масса;
dB = dF – сила (количество движения).
Тогда получаем систему уравнений:
 – уравнение теплопроводности;
– уравнение теплопроводности;
 – уравнение диффузии (1-й закон Фика);
– уравнение диффузии (1-й закон Фика);
 – уравнение внутреннего трения
– уравнение внутреннего трения

Знак “–“ указывает, что процесс происходит в сторону убывания градиента.
Коэффициенты имеют значения:
 , (20)
, (20)
где Cудv – удельная теплоёмкость при V = const;
r – плотность;
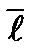 – средняя длина свободного пробега;
– средняя длина свободного пробега;
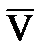 – средняя скорость движения молекулы.
– средняя скорость движения молекулы.
Сопоставляя формулы уравнения (20), видно, что один коэффициент может быть получен из другого.
Связь между коэффициентами:
l = η·Судv = Д·Судv·ρ (21)
Пример:
характеристики газовых молекул при нормальных условиях:
| Газ | h

| 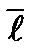 × 104 м
× 104 м
| l
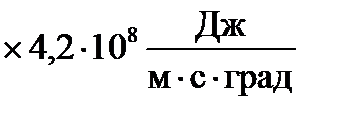
|
| O2 | 6,47 | ||
| CO2 | 3,97 | ||
| H2O (при 1000С) | 4,04 |
Уравнения переноса, рассмотренные для газов, имеют более общий характер, т.е. они частично годны для жидких и твёрдых тел.
34.Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
|
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
|







 энергии, так как при этом есть и кинетическая, и потенциальная энергия, то есть появляется шестая степень свободы – колебательная. При температуре равной 2500 К, молекулы диссоциируют. На диссоциацию молекул тратится энергия раз в десять превышающая среднюю энергию поступательного движения. Это объясняет сравнительно низкую температуру пламени. Кроме того, атом – сложная система, и при высоких температурах начинает сказываться движение электронов внутри него.
энергии, так как при этом есть и кинетическая, и потенциальная энергия, то есть появляется шестая степень свободы – колебательная. При температуре равной 2500 К, молекулы диссоциируют. На диссоциацию молекул тратится энергия раз в десять превышающая среднюю энергию поступательного движения. Это объясняет сравнительно низкую температуру пламени. Кроме того, атом – сложная система, и при высоких температурах начинает сказываться движение электронов внутри него.
 – средняя скорость теплового движения, τ – среднее время между двумя столкновениями. Именно
– средняя скорость теплового движения, τ – среднее время между двумя столкновениями. Именно  - средняя длина свободного пробега нас интересует (рис. 3.1).
- средняя длина свободного пробега нас интересует (рис. 3.1).
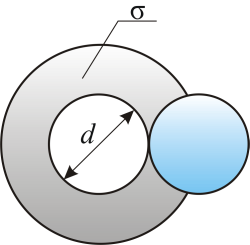
 – площадь, в которую не может проникнуть центр любой другой молекулы. Здесь
– площадь, в которую не может проникнуть центр любой другой молекулы. Здесь  – диаметр молекулы.
– диаметр молекулы. . За ту же секунду молекула претерпевает ν столкновений. Следовательно,
. За ту же секунду молекула претерпевает ν столкновений. Следовательно,
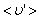 . Умножим объём цилиндра
. Умножим объём цилиндра  на число молекул в единице объёма n, получим среднее число столкновений в одну секунду:
на число молекул в единице объёма n, получим среднее число столкновений в одну секунду: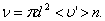

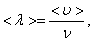 то получим:
то получим:
 , то есть
, то есть  то
то

 а, т.к.
а, т.к.  , то
, то 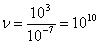 столкновений.
столкновений.