 |
|
Обращает на себя внимание наличие максимумов на этих зависимостях при значениях коэффициента затухания не превышающих некоторого

критического, равного dкр = wо/Ö2.
При больших затуханиях d > dкр амплитуда вынужденных колебаний монотонно убывает с ростом частоты вынуждающей силы.
На низких частотах w << wо имеем так называемый статический случай; соответствующее (статическое) значение амплитуды вынужденных колебаний равно: Аст = Fм/mwо2 = Fм/k. (Напомним, что wо2 = k/m).
Явление возрастания амплитуды вынужденных колебаний при изменении частоты вынуждающей силы называется резонансом. Значение резонансной амплитуды определим из условия экстремума зависимости A(w). Из dА/dw = 0 Þ w =
wрез = Ö(wо2 - 2d2) и Арез = Fм/2dmÖ(wо2 – d2)
При нулевом затухании резонанс происходит точно на частоте wо свободных колебаний системы, а значение резонансной амплитуды равно Арез = F/2dmwо = ¥. Нет ограничения для "раскачки" вынужденных колебаний. Затухание понижает резонансную частоту и понижает значение резонансной амплитуды вынужденных колебаний/ резонанс "тупеет" и "левеет"/. Явление резонанса представляет собой эффект являющийся амплитудно-фазовым эффектом. На некоторой частоте w = wр вынуждающая сила оказывается сфазированной со скоростью вынужденных колебаний и в течение всего периода колебаний действует "по скорости" u = dr/dt и, соответственно, "по перемещению dr" вынужденных колебаний, осуществляя их максимальную раскачку. При таком фазовом синхронизме, когда внешняя сила действует "в такт" вынужденным колебаниям; она совершает максимальную работу и развивает наибольшую мощность N = Fвынu.
Можно также считать, что при w = wр вынуждающая сила действует в противофазе
с силой сопротивления и, совершая максимальную работу, максимально повышает амплитуду
(и энергию) вынужденных колебаний.
При резонансе колебательная система отбирает от внешнего источника максимальную мощность. Это и есть фундаментальный признак резонанса.
24. Общее определение волнового процесса. Уравнение плоской
монохроматической волны. Длина волны. Волновое число. Фазовая ско-
рость распространения волны.
Под волнами в механике понимают вид движений в упругой среде, представляющий
собой взаимосвязанные колебания её частиц. Если в некоторой точке О упругой среды в момент времени t возбуждено гармоническое колебание частиц среды, за счёт последовательной передачи состояния возбуждения между упруго связанными частицами, это колебание придёт в точку Р с задержкой во времени
на Dt = r/u, где r - удаление точки О от точки Р, а u - скорость распространения колебаний (волны) в соответствующей среде.
Уравнение распространяющегося колебания и представляющего собой волну, запишется в виде:
х = Аcos[w(t – Dt) + j)] = Аcos(wt – wr/u + j) = Аcos(wt –2pr/uТ + j) = Аcos(2pt/Т –2pr/l + j) = = А cos (wt – kr + j) = А cos Ф.
Полученное уравнение называется уравнением бегущей гармонической волны (УБГВ), где введены обозначения:
l = uТ - длина волны; численно равна расстоянию, проходимому волной за время, равное периоду Т колебания частиц среды. Фактически длина волны представляет собой пространственный период волны, то есть расстояние, отсчитываемое вдоль направления распространения (вдоль вектора u скорости) волны, на протяжении которого ее фаза Ф в данный момент времени изменяется на 2p. Фаза характеризует состояние волнового процесса в данной точке в данный момент времени.
k = w/u = 2p/l - волновое число; оно определяет частоту повторения волнового процесса
в пространстве, являясь пространственным аналогом угловой (циклической) частоты w = 2p/Т.
Бегущая гармоническая волна является процессом периодическим не только во времени (как гармоническое колебание), но и в пространстве. Поэтому у волны есть два периода – временной Т и пространственный l - и две частоты – временная w и пространственная k. Пары этих характеристик связаны между собой посредством третьей характеристики волны – скорости u ее распространения: l/Т = w/k = u
Уравнение Ф = wt – kr + j = const является уравнением эквифазовой поверхности волны. Эту поверхность, все точки которой колеблются в одинаковой фазе, называют еще волновой поверхностью. Введенная ранее скорость распространения волны u = l/Т или u = w/k, фактически выражает скорость распространения ее эквифазовой поверхности волны, ибо указывает, что за время равное периоду Т, поверхность постоянной фазы перемещается на расстояние, равное длине волны l. Поэтому ее называют фазовой скоростью волны.
25. Волновой процесс. Упругие волны. Скорость распространения
упругой волны. Продольная и поперечная волна. Уравнение плоской мо-
нохроматической волны. Длина волны.
Под волнами в механике понимают вид движений в упругой среде, представляющий
собой взаимосвязанные колебания её частиц. Если в некоторой точке О упругой среды в момент времени t возбуждено гармоническое колебание частиц среды, за счёт последовательной передачи состояния возбуждения между упруго связанными частицами, это колебание придёт в точку Р с задержкой во времени на Dt = r/u, где r - удаление точки О от точки Р, а u - скорость распространения колебаний (волны) в соответствующей среде.
Уравнение распространяющегося колебания и представляющего собой волну, запишется в виде:
х = Аcos[w(t – Dt) + j)] = Аcos(wt – wr/u + j) = Аcos(wt –2pr/uТ + j) = Аcos(2pt/Т –2pr/l + j) = = А cos (wt – kr + j) = А cos Ф.
Полученное уравнение называется уравнением бегущей гармонической волны (УБГВ), где введены обозначения:
l = uТ - длина волны; численно равна расстоянию, проходимому волной за время, равное периоду Т колебания частиц среды. Фактически длина волны представляет собой пространственный период волны, то есть расстояние, отсчитываемое вдоль направления распространения (вдоль вектора u скорости) волны, на протяжении которого ее фаза Ф в данный момент времени изменяется на 2p. Фаза характеризует состояние волнового процесса в данной точке в данный момент времени.
k = w/u = 2p/l - волновое число; оно определяет частоту повторения волнового процесса
в пространстве, являясь пространственным аналогом угловой (циклической) частоты w = 2p/Т.
Бегущая гармоническая волна является процессом периодическим не только во времени (как гармоническое колебание), но и в пространстве. Поэтому у волны есть два периода – временной Т и пространственный l - и две частоты – временная w и пространственная k. Пары этих характеристик связаны между собой посредством третьей характеристики волны – скорости u ее распространения: l/Т = w/k = u.
Уравнение Ф = wt – kr + j = const является уравнением эквифазовой поверхности волны. Эту поверхность, все точки которой колеблются в одинаковой фазе, называют еще волновой поверхностью. Введенная ранее скорость распространения волны u = l/Т или u = w/k, фактически выражает скорость распространения ее эквифазовой поверхности волны, ибо указывает, что за время равное периоду Т, поверхность постоянной фазы перемещается на расстояние, равное длине волны l. Поэтому ее называют фазовой скоростью волны.
По виду, форме волновой поверхности волны делят на плоские, сферические, и др. В плоской волне в среде без поглощения амплитуда не зависит от удаления от источника, а в сферической волне убывает обратно пропорционально удалению r от источника волны.
Уравнение х =Аcos(wt – kr + j) = А cos Ф является решением следующего дифференциального уравнения, называемого волновым: хt¢¢ – u2хr¢¢ = 0
Проверим, что это так. Найдем вторые производные от х по времени (хt¢¢) и по пространственной координате (хr¢¢) и подставим их в волновое уравнение:
хt¢ = - wА sin (wt – kr + j); хt¢¢ = - w2А cos (wt – kr + j) = - w2х.
хr¢ = kАsin (wt – kr + j); хr¢¢ = - k2А cos (wt – kr + j) = - k2х.
Поделив вторые производные, получаем: хr¢¢/ хr¢¢ = w2/k2 Þ хt¢¢ – (w2/k2)хr ¢¢ = 0 или
хt¢¢ – u2хr¢¢ = 0 - дифференциальное уравнение бегущей гармонической (монохроматической- волна, у-ние кт-рой представ собой строго гармонич ф-цию и кот-я явл бесконесной во времени и в пр-ве) волны (ДУБГВ).
Действительно, бегущая гармоническая (монохроматическая) волна, так же, как и гармоническое колебание, изображается гармонической функцией, особенностью которой является то, что ее вторая производная "возвращается" к ней самой. Поэтому бегущая гармоническая волна и удовлетворяет уравнению (волновому), которое связывает вторые производные от функции по ее временной и пространственной координатам (переменным, аргументам).
В зависимости от соотношения между направлениями колебания частиц и распространения волны различают продольные волны, у которых эти направления параллельны,
и поперечные волны, у которых названные направления перпендикулярны.
Продольные волны обязаны своим существованием упругим деформациям сжатия - растяжения, а поперечные – деформациям сдвига. Соответственно поперечные волны могут существовать только в твердых телах (жидкости и газы не обладают упругостью к сдвигу).
Скорости распространения продольных и поперечных волн определяются следующими
выражениями: uпрод = ÖЕ/r; uпопер = ÖG/r, где r - плотность упругой среды; Е и G - модули упругости(Под модулями упругости понимают отношения механических напряжений (сил, приходящихся на единицу площади поверхности), соответственно нормального и касательного к деформациям сжатия-растяжения и сдвига соответственно), соответственно к сжатию (модуль Юнга) и сдвигу, являющиеся табличными характеристиками материала.
От скорости u распространения волны следует отличать скорость u колебания частиц среды. Последняя представляет собой быстроту смещения колеблющихся частиц, то есть
u = dх/dt = х¢t.
26. Динамика волнового процесса. Перенос энергии волной. Вектор Умова.
С энергетических позиций бегущая волна интересна тем, что способна переносить энергию без переноса вещества. В упругой волне кинетическая энергия колеблющихся частиц среды переходит в потенциальную энергию деформаций среды (сжатий - разряжений и сдвигов)
и обратно. Также как и при гармонических колебаниях, вследствие консервативного характера взаимодействий, максимальная кинетическая энергия равна максимальной потенциальной энергии: Ек макс = Еп макс = ЕS = const.
Для одной частицы массой m: Ек1 = mu2/2 = m(х¢¢)2/2 = (mw2А2/2)×sin2 (wt – kr + j), откуда
Ек1 макс = (mw2А2/2) = Е1 S.
Рассмотрим объём DV = DS×u×Dt, возбуждаемый волной за время Dt. Полная энергия частиц, колеблющихся в объёме DV (энергия, привнесённая волной в данный объём, возбуждённая волной в нём) равна: ЕS = Ек макс = Ек1 макс ×N = (mw2А2/2)×n×DV.
Так как m×n = r, то ЕS = (rw2А2/2)×DV, где n - концентрация частиц среды, r - плотность среды.
Энергия w единицы объёма (объёмная плотность энергии) равна: w = ЕS/DV = rw2А2/2; [w] = [Дж/м3].
Энергия, переносимая волной за единицу времени через единичную площадку, перпендикулярную направлению распространения волны, называется плотностью потока энергии или вектором Умова и равна: S = ЕS/DS×Dt = (rw2А2/2)×u = w×u; [S] = [Дж/м2с].
27. Сложение волн. Принцип суперпозиции. Стоячая волна. Узлы и
пучности в стоячей волне. Энергия стоячей волны.
В отличие от колебания волна является видом движения периодическим не только во времени, но и в пространстве. Формально сложение волн, изображаемых гармоническими функциями, сводится к сложению этих функций с помощью векторной диаграммы. На ней гармонические функции времени изображаются вращающимися векторами амплитуды. Точно также бегущие гармонические волны в каждой точке пространства можно заменить векторами, и сложение волн в пространстве представить как сложение векторов.
Рассмотрим сложение двух бегущих гармонических волн одинаковой частоты и направлений колебания частиц упругой среды. Пусть эти волны задаются следующими уравнениями:
х1 = А1cos (wt – kr1) = А1cos Ф1
х2 = А2cos (wt – kr2) = А2cos Ф2
 где r1 и r2 - расстояния, проходимые первой и второй волнами
где r1 и r2 - расстояния, проходимые первой и второй волнами
до некоторой точки М, в которой нас интересует их совместное проявление, их сложение. Заменяя гармонические функции равномерно вращающимися с угловой скоростью w векторами амплитуды, первоначально наклонёнными к оси х под углом начальной фазы Фо соответствующей волны, запишем выражения для модуля и угла наклона к оси х результирующего вектора;
х = х1 + х2 = А1cos Ф1 + А2cos Ф2 = Аcos Ф; А2 = А12 + А22 + 2А1А2cos DФ: DФ = Ф2 – Ф1;
tgФ = (А1sin Ф1 + А2sin Ф2)/(А1cos Ф1 + А2cos Ф2).
Значение амплитуды результирующего колебания в точке М зависит от разности фаз DФ, с которой приходят в эту точку складываемые волны. При этом возможны следующие два принципиально различных случая:
1. Разность фаз складываемых волн хаотически меняется во времени так, что среднее по времени значение от косинуса разности фаз равно нулю, т. е. <cos DФ> = 0. Такие волны называются некогерентными (не связанными по фазе), и для них среднее значение <А2> квадрата амплитуды результирующей волны равно сумме средних квадратов (а фактически просто квадратов) амплитуд складываемых волн; <А2> = <А12> + <А22> + <2А1А2cos DФ> Þ
А2 = А12 + А22 или J = J1 + J2, где J ~ А2 – интенсивность волны (величина, пропорциональная среднему квадрату амплитуды).
В этом случае во всём пространстве независимо от разности фаз складываемых волн
(и их разности хода) происходит сложение интенсивностей (средних квадратов амплитуды).
2. Складываемые волны когерентны, то есть, связаны по фазе, что выражается в неравенстве нулю среднего значения по времени от, косинуса разности волн:
<cos DФ> ¹ 0; <cos DФ> = < cos [k(r1 – r2) + j] = < cos [2p(r1 – r2)/l + j] > ¹ 0 и А2 = А12 + А22 + 2А1А2 cos DФ - результирующая амплитуда изменяется от максимального значения равного Амакс = А1 + А2 при cos DФ = 1,
до минимального значения Амин = А1 – A2 при cos DФ = - 1.Таким образом, при сложении когерентных волн в пространстве возникает картина чередующихся областей повышенной и пониженной интенсивности J (J ~ А2) волнового процесса. Эта картина называется интерференционной, и само явление сложения когерентных волн, сопровождающееся возникновением чередующихся в пространстве максимумов и минимумов результирующей волны, называется интерференцией.
Получим условия для экстремумов при интерференции для упрощённого случая равных начальных фаз складываемых волн, т. е. для j = 0.
Максимумы: cos DФ = 1 => DФ = ± 2pm; (2p/l)(r1 – r2) = ± 2pm Þ r1 – r2 = ± ml.
Разность хода складываемых волн для образования максимума должна быть кратной целому числу m длин волн. Сами волны оказываются при этом синфазными и при наложении усиливают друг друга.
Минимумы: cos DФ = -1 Þ DФ = (2p/l)(r1 – r2) = ± (2m + 1)p Þ r1 – r2 = ± (m + 1/2)l - возникают в тех местах пространства, разность хода складываемых волн до которых, составляет нечетное число длин полуволн или полуцелое число длин волн. При такой разности хода, складываемые волны приходят в соответствующую область в противофазе и взаимно компенсируют, ослабляют друг друга. При A1 = А2, Амин = А1 – А2 = 0.
Частным, но важным случаем сложения и интерференции когерентных волн является сложение противоположно распространяющихся (например, падающей от источника и отражённой от какого-либо препятствия) волн. Результатом такого наложения является возникновение так называемых стоячих волн.
Рассмотрим сложение двух, бегущих в противоположные стороны гармонических волн,
с одинаковой частотой и амплитудой колебаний:
х = х1 + х2 = Аcos(wt – kr) + Аcos(wt + kr) = 2Аcos kr×cos wt.
Получили уравнение стоячей волны, в соответствии с которым, все точки стоячей волны колеблются с разными амплитудами и, либо в одной фазе, либо в смещенной относительно неё на 180°. В бегущей волне, наоборот
амплитуды разных точек были одинаковыми (для рассматриваемых нами плоских волн), а фазы различными.
Точки, колеблющиеся с максимальными амплитудами, называются пучностями стоячей волны; они наблюдаются при координатах определяемых условием:
сos 2pr/l = ± 1 Þ rпуч = ± ml/2, где m = 0, 1, 2, …
Точки, колеблющиеся с нулевой амплитудой (точнее сказать, не колеблющиеся),
называются узлами стоячей волны. Их координаты определяются условием:
сos 2pr/l = 0 Þ rуз = ± (m + 1/2)l/2, где m = 0, 1, 2, …
Расстояние между соседними пучностями, так же, как и между соседними узлами, равно l/2. Все точки, лежащие между соседними узлами, колеблются синфазно, в то время как фазы точек, лежащих по разные стороны от узла, отличается на 180°. Все точки стоячей волны одновременно проходят положения равновесия (cos wt = 0) и все они одновременно достигают максимума.
Как и в колебаниях, в стоячей волне дважды (cos wt = ± 1) за период происходит превращение кинетической энергии в потенциальную энергию и обратно.
Движение частиц среды в стоячей волне по существу не является волновым движением; в уравнении стоячей волны утрачена характерная особенность волны - конечная скорость распространения фазы. Энергия вдоль стоячей волны не переносится, а может лишь передаваться в пределах отдельных участков волны, расположенных между двумя соседними разноимёнными узлами, т. е. между узлом деформаций и узлом скоростей.
В стоячей волне кинетическая энергия сосредоточена в основном вблизи пучностей волны (где максимальна скорость u = dх/dt - колеблющихся частиц), а потенциальная энергия сосредоточена в основном вблизи узлов волны, где находятся максимумы деформаций dr/dх. Таким образом, максимумы в стоячей волне для кинетической и потенциальной энергий разнесены не только во времени (на четверть периода Т/4), но и в пространстве (на l/4). Энергия переходит от узла (где она - потенциальная) к пучности (где она - кинетическая) и обратно. Средний же по времени поток энергии в любом сечении волны равен нулю, т. е. стоячая волна энергии не переносит, вектор Умова для неё равен нулю.
В случае свободных колебаний струн, стержней и столбов воздуха в трубах в них устанавливаются стоячие волны, причем на длине L колебательной системы с закрепленными (закрытыми) концами укладывается целое число полуволн: L = ml/2, где m = 1, 2, 3,... Собственные частоты колебаний таких распределённых систем соответственно принимают следующие дискретные значения: nm = u/l = um/2L.
Частота основного тона (m = 1) натянутой струны равна n1 = (1/2L)Ö(F/rS), так как скорость поперечных волн в струне u = Ö(F/rS), где F - сила натяжения струны, r и S - плотность
материала струны и площадь её поперечного сечения.
Для стержней, один конец которых закреплён, а другой свободен, и для труб, закрытых
с одного конца и открытых с другого, l = (2m - 1)l/4 и собственные частоты колебаний
nm = (2m - 1)u/4l.
30. Понятие идеального газа. Основные газовые законы. Уравнение состояния идеального газа. Универсальная газовая постоянная.
Идеальный газ – газ размерами молекул к-рого можно пренебреч; между молекулами отсутствуют силы взаимодействия; столкновение молекул друг с другом и со стенками сосуда считаются абс.упругими.
Основными величинами, характеризующими поведение и свойства газа, являются объём V, давление Р и температура Т. Первые две характеристики переходят в физику теплового движения из механики. Например, механический смысл давления - удельная (на единицу площади) сила нормального давления: Р = F^/S [Н/м2 = Па; Паскаль]. Последняя же величина - температура Т является новой для механики и специфической характеристикой именно теплового движения. В эмпирическом подходе температура является мерой некоторого интуитивно представляемого свойства нагретости тел. Существует две наиболее распространённые шкалы температуры - термодинамическая /шкала Кельвина/ и Цельсия. Связь между ними выражается соотношением: Т = t° + 273 /К/.
Эмпирически было установлено, что названные выше три характеристики многочастичной системы, её теплового движения являются взаимосвязанными. Их связь, называемая уравнением состояния идеального газа или уравнением Менделеева - Клапейрона, имеет следующий вид: РV = (m/М)RT, где m - масса газа, М - молярная масса газа и
R = 8,31Дж/(моль×К) - молярная газовая постоянная. Так как она постоянна для всех газов,
ее еще называют универсальной газовой постоянной.
Молярной массой называют массу одного моля, т. е. единицы количества вещества. Моль любого вещества содержит число частиц /структурных или просто, каким либо образом выделенных, специфицированных единиц вещества/, равное числу Авогадро NА = 6,02×1023 моль-1.
Отношение массы m газа к его молярной массе М равно числу n молей, т. е. количеству вещества: m/М = n. Единица количества вещества - моль, относится к основным единицам в СИ, наряду с секундой, метром, килограммом.
Количество вещества n является аддитивной характеристикой, то есть nS = n1 + n2 + … + nk = (m/М)1 + (m/М)2 + … + (m/М)k Из РV = (m/М) RT следует, что при одинаковых давлениях и температурах молярные (m/М = 1) объемы Vм различных газов одинаковы и, в частности, при нормальных условиях: Vм = RТ/Р = Vм о = RТо/Ро = 22,4 л – закон Авогадро. На практике употребляется ещё одна форма уравнения состояния идеального газа, выражаемая для давления и использующая другую константу, называемую постоянной Больцмана: Р = (m/МV)×RT = NmоRТ/VNАmо = NRТ/VNА = nkТ,
где mо - масса одной молекулы газа; N - полное число молекул газа; n =N/V - концентрация молекул газа/их число в единице объёма/; k = R/NА - постоянная Больцмана: k = 1,38×10-23 Дж/К. Согласно опытному закону Дальтона, если газ включает в себя смесь из k различных газов, давление, которое он оказывает на стенки сосуда, равно сумме давлений, оказываемых отдельными газами (сумме так называемых парциальных давлений): Р = Р1 + Р2 + . .+ Рk
31. Молекулярно-кинетический и термодинамический подходы в молекулярной физике. Основные положения молекулярно-кинетической теории строения вещества и их опытное подтверждение. Основное уравнение
молекулярно-кинетической теории.
Основные положения МКТ:
Все тела состоят из мельчайших частиц
Молекулы в-ва находятся в непрерывном хаотическом движении называемым тепловым
Между молекулами в-ва существ силы взаимодействия
Осн. У-ние МКТ: P=mn<v2>/3; n=N/l3- концентрация молекул
P=(2/3)nm<v2>/2 = (2/3)n<Ek>
32-36 Отсутствуют
37. Распределение Максвелла по абсолютному значению скорости. Характерные скорости молекул: средняя и средняя квадратичная, наиболее вероятная. Их вычисления. Экспериментальная проверка закона
распределения Максвелла.
Распределение Максвелла (функция распределения молекул идеального газа по скоростям).
Максвелл исходил из естественного предположения о том, что число молекул dNu, скорости которых попадают в интервал от u до u + du, пропорционально общему числу N молекул и ширине интервала du скоростей, зависит от значения скорости u, вблизи которой берется интервал du, то есть: dNu = f(u)×N×du, где f(u) - коэффициент пропорциональности, зависящий от значения скорости и называемый функцией распределения вероятностей молекул по значениям скорости. Он имеет смысл вероятности, отнесённой к ширине интервала значений величины (в данном случае – скорости): f(u) = dNu/Ndu = dР/du, где: dР = dNu/N - вероятность того, что скорость молекулы находится в интервале значений от u до u + du. Функция же распределения f(u) = dР/du есть плотность вероятности, т. е. удельная
(в расчёте на единичный интервал значений величины) вероятность, уже не зависящая от ширины интервала, и являющаяся функцией только значений самой величины (скорости, применительно к распределению Максвелла). В состоянии термодинамического равновесия функция распределения не зависит от времени и выражает устойчивое распределение вероятностей тех или иных значений статистической величины, характеристики макросистемы.
Для функции распределения справедливо условие нормировки, формально заключающееся в равенстве единице интеграла от неё по всей области задания её аргумента: 
Это условие выражает собой вероятность достоверного события, а именно того, что соответствующая величина (в распределении Максвелла это скорость) хотя бы каким то значением обладает. Естественно, что вероятность такого события равна 100 %, т. е. единице.
Так как наглядный геометрический смысл интеграла от функции - площадь фигуры между графиком функции и осью ее аргумента, то условие нормировки требует, чтобы эта площадь при всех изменениях, происходящих с функцией распределения, оставалась неизменной.
Максвеллом были получены следующие выражения для функций распределения молекул идеального газа по скоростям их теплового /хаотического/ движения:
а/ по проекции скорости: f(uх) = (mо/2pkТ)1/2× 
б/ по модулю скорости: f(u) = (mо/2pkТ)3/2×× 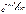 ×4pu2
×4pu2
где: mо - масса молекулы, k = 1,38×10-23 Дж/К - постоянная Больцмана.
Абсолютная температура Т играет роль параметра функции распределения.
Для разных температур кривые функции распределения Максвелла по проекции и по модулю скорости имеют следующий вид:
В силу равноправия положительного и отрицательного направлений движения вдоль
любой оси функция распределения Максвелла, по проекции скорости оказывается симметричной относительно нулевого значения проекции (у нас – uх), на которое и приходится её максимум. Это объясняется вкладом, большого числа молекул, движущихся вдоль двух других осей (Z и U), т. е. перпендикулярнооси Х, c uх = 0.
Максимум функции распределения Максвелла по модулю скорости приходится на значение, называемое наивероятнейшей скоростью uнв, которое можно определить исходя из условия экстремума функции распределения: при u = uнв, df/du = 0 Þ uнв = Ö(2kТ/mо) = Ö(2RТ/М).
Наивероятнейшая скорость однозначно определяется температурой, будучи пропорциональной ей. Температура здесь выступает в роли параметра, определяющего характерные черты функции статистического распределения молекул идеального газа по скоростям их теплового движения. Интуитивное представление о температуре как мере "нагретости" тела приобретает здесь следующую конкретизацию: температура и "нагретость" тела определяются наиболее вероятными значениями скоростей внутреннего хаотического движения молекул, будучи пропорциональными им. Более нагретое тело обладает в среднем более быстро движущимися молекулами. График функции распределения вероятностей скоростей теплового движения у более нагретого тела сдвинут вправо, в область больших скоростей.
В целом рост температуры приводит к понижению обеих функций распределения (по проекции и по модулю скорости) по максимуму (высоте) и одновременному расширению, расплыванию максимума, так что площади под кривыми для разных температур должны оставаться неизменными (в силу условия нормировки). Температура, таким образом, выступает здесь и мерой разброса (дисперсии) значений скорости во всё большем интервале значений. При нулевой температуре, согласно классической статистике Максвелла, тепловое движение прекращается, функция распределения стягивается в вертикальную линию с единственно допустимым нулевым значением скорости: uх = 0 и u = 0 [f(u) = d(u) = 0, при u ¹ 0].
Функция статистического распределения важна тем, что с её помощью можно
вычислять средние (статистически усредненные) значения любых величин, являющихся функциями её аргумента. Так, распределение Максвелла по модулю скорости позволяет определять такие важные статистические (усреднённые) характеристики теплового движения молекул, как среднюю арифметическую <u> и среднюю квадратичную uкв скорости молекул:
<u> = (u1 + u2 + … + uN)¤N = (1¤N)  = (1¤N)
= (1¤N)  =
=  = Ö(8kТ¤pmо) = Ö(8RТ¤pМ),
= Ö(8kТ¤pmо) = Ö(8RТ¤pМ),
uкв2 = (u12 + u22 + … + uN2)¤N = (1¤N)  = (1¤N)
= (1¤N)  =
=  = (3kТ¤mо) = (3RТ¤М) Þ uкв = Ö<u2> = Ö(3kТ¤mо) = Ö(3RТ¤М).
= (3kТ¤mо) = (3RТ¤М) Þ uкв = Ö<u2> = Ö(3kТ¤mо) = Ö(3RТ¤М).
Как видно из выражений для наивероятнейшей, средней арифметической и среднеквадратической скоростей молекул идеального газа: uнв = Ö(2kТ/mо), <u> = Ö(8kТ¤pmо) и uкв = Ö(3kТ¤mо) их значения соотносятся как uнв : <u> : uкв = 2 : 8/p : 3 = 1 : 1,13 : 1,22. Несовпадение максимума распределения с его средним значением говорит о несимметричности функции распределения. Тот факт, что среднее значение скорости смещено вправо (в область больших значений) по сравнению с наиболее вероятным (приходящимся на максимум функции распределения), говорит о том, что больше молекул движутся со скоростями превышающими наивероятнейшую, то есть площадь под функцией распределения справа от максимума больше, чем слева.
Полученное выражение для квадрата среднеквадратичной скорости uкв2 = (3kТ¤mо) позволяет дать температуре трактовку меры средней кинетической энергии молекул идеального газа. Действительно, из него следует, что mо<u2>/2 = 3kТ/2 – средняя кинетическая энергия молекулы (её поступательного движения), зависит только от температуры газа.
С приведённым выше соотношением можно связать и такой важный закон классической статистики, как закон равномерного распределения энергии по степеням свободы движения (ЗРРЭСС). Т. к. в поступательном движении имеется 3 степени свободы движения (под степенями свободы здесь понимаются элементарные, то есть простейшие, неразложимые далее движения) - вдоль трёх взаимно-перпендикулярных осей, то на одну степень свободы приходится энергия равная kТ/2.
В общем случае не одноатомной молекулы она может обладать ещё и степенями свободы вращательного движения как целого и колебательного, если её атомы связаны упругими, нежёсткими силами. И тогда её полная кинетическая энергия, согласно ЗРРЭСС, выразится формулой: Ек = ikТ/2, где i - полное число степеней свободы движения молекулы. Для одного моля: ЕкМ = iRТ/2.
Для одноатомной молекулы (материальной точки) i = 3 - три степени свободы поступательного движения молекулы вдоль осей Х, U, Z.
Для двухатомной молекулы с жёстко связанными атомами к трём степеням свободы поступательного движения добавляются ещё две степени свободы вращательного движения -
вокруг осей перпендикулярных оси молекулы. Относительно оси молекулы - направления,
соединяющего её атомы, её момент инерции равен нулю, ибо атомы считаем точечными, и она не запасает кинетической энергии Ек = Jw2/2. Соответственно у жесткой трёхатомной молекулы имеют место по 3 степени свободы как поступательного, так и вращательного движений. Если же связи между атомами молекулы носят нежёсткий, упругий характер, то нужно дополнительно учитывать ещё и степени колебательного движения атомов относительно её центра масс.
В отличие от молекул идеального газа, молекулы реальных газов запасают наряду с кинетической энергией еще и потенциальную энергию.
В 1920 г. Штерн осуществил экспериментальную проверку распределения Максвелла
по модулю скорости. В качестве объекта исследования он взял пары атомов серебра, излучаемые нагреваемой электрическим током платиновой посеребренной проволочкой L, расположенной на оси двух коаксиальных цилиндров А и В. При синхронном вращении цилиндров на внутренней поверхности наружного цилиндра В изображение щели а, вырезанной во внутреннем цилиндре А и создаваемое пучком летящих атомов серебра размывалось, что говорило о наличии в пучке атомов, летящих с разными скоростями. Пока атом серебра, летящий со скоростью u, проходит зазор между цилиндрами, равный R – r, они успевают повернуться на угол j = wt = w(R – r)/u. Смещение отпечатка-полоски серебра на поверхности наружного цилиндра на расстояние l = Rj = wR(R – r)/u оказывается зависящим от скорости атомов серебра.
По степени размытости отпечатка щели и толщине осаждаемого слоя атомов Штерн оценил распределение молекул /атомов/ по скоростям и получил хорошее согласие с распределением Максвелла.
В настоящее время вскрыт ограниченный характер справедливости выводов классической статистики Максвелла и, в частности, закона равномерного распределения энергии по степеням свободы движения молекул и прекращения движения молекул при охлаждении тела до нулевой абсолютной температуры Т = 0 К. Обобщение классической статистики на эту и другие ситуации будет проведено в рамках квантовой механики. В ней вскрывается статистическая природа закономерностей движения не только макро коллективов, но и отдельных микрочастиц.
38. Функция распределения молекул по координатам. Функция
распределения Больцмана. Барометрическая формула.
Полное статистическое описание теплового движения требует знания функции распределения частиц (молекул) не только по скоростям, но и по координатам. В состоянии равновесия, т. е. в отсутствие внешних возмущающих воздействий, хаотически движущиеся молекулы идеального газа распределены по предоставленному им пространству равномерно, т. е. равновероятны любые их местоположения, любые значения координат молекул. Фактически, однако, молекулы всегда находятся в возмущающем поле силы тяжести, нарушающем их равномерное пространственное распределение. Больцманом было установлено, что для произвольного поля потенциальных сил, задаваемого потенциальной энергией Еп (х, у, z) распределение концентрации частиц подчиняется следующему экспоненциальному закону:
n = nо×е-Еп/kТ - распределение Больцмана,
где nо - равновесная концентрация молекул, соответствующая отсутствию возмущающего внешнего поля, то есть Еп (х, у, z) = 0.
Концентрация молекул экспоненциально убывает с ростом их потенциальной энергии; молекулы «стремятся» занимать места с наименьшей потенциальной энергией.
При Т ® ¥, n ® nо – высокая температура равномерно разбрасывает молекулы.
Согласно экспоненциальному распределению Больцмана, молекулы идеального газа распределяются с большей плотностью там, где их потенциальная энергия меньше. Тепловое же движение стремится "разбросать" молекулы равномерно по всему пространству, выровнять их концентрацию во всём доступном им объёме. Распределение Больцмана позволяет, в частности, дать интерпретацию устойчивости земной атмосферы и получить известную из опыта барометрическую формулу. Т. к. в поле земного тяготения Eп = mоgh, то для молекул воздушного (атмосферного) столба распределение по высоте будет экспоненциально убывающим:
n = nо×е-m gh/kТ, где nо - концентрация молекул воздуха на уровне моря, при h = 0 и Еп (h) = 0.
Поле силы тяжести и тепловое движение – два конкурирующих фактора, обусловливающих в своём противодействии динамически уравновешенное устойчивое состояние нашей атмосферы. Поле силы тяжести препятствует выбросу под действием теплового движения молекул в космос. Тепловое же движение не позволяет силе тяжести собрать все молекулы
на "дне воздушного океана". В итоге и создаётся некоторое неравномерное (экспоненциальное) распределение молекул по высоте.
Барометрическая формула Р = Рое-mgh/kТ, эмпирически описывающая экспоненциальный характер убывания атмосферного давления по мере увеличения высоты h от уровня моря, легко получается из распределения Больцмана, если вспомнить уравнение состояния идеального газа Р = nkТ. Для изотермических условий, т. е. при Т = const, законы изменения Р и n должны быть одинаковыми. Таким образом, из распределения Больцмана n = nо×е-Еп/kТ - следует барометрическая формула Р = Рое-mgh/kТ.
Экспериментальная проверка распределения Больцмана была проведена в опыте Перрена (1909 г), который исследовал распределение по высоте сосуда мельчайших частиц (размер ~ 0,3 мкм)смолы гуммигута, взвешенных в воде /эмульсии/.
Фотографируя картины распределения частиц и подсчитывая по снимкам их концентрацию на разных высотах, Перрен получил: n = nо×е-ah, где a = 1/Т. Он вычислил исходя из распределения n = nо×е-mgh/(RТ/N) число Авогадро NА = RТ/m - и получил NА = 6,8×10-23 моль, т. е. достаточно довлетворительное согласие с истинным значением.
39. Число столкновений и средняя длина свободного пробега моле-
кул. Эффективный диаметр молекул.
Физическая кинетика изучает неравновесные макросистемы, у которых параметры термодинамического состояния (давление Р, температура Т, концентрация n) имеют значения, различные в разных частях макросистемы. Имеющиеся при этом градиенты (перепады) давления, температуры и концентрации обусловливают направленные потоки частиц, переносящих энергию (теплоту), импульс и массу и выравнивающих (уравновешивающих) параметры состояния по всему объёму (пространству) макросистемы. Здесь как бы имеет место тепловая упругость, возвращающая неравновесную макросистему в состояние термодинамического равновесия.
Статистический подход к анализу кинетических явлений и, в частности, неравновесных процессов переноса, основывается на использовании таких усреднённых микроскопических
характеристик, как среднее число столкновений и средняя длина свободного пробега молекул.
Молекулы газа находятся в непрерывном тепловом движении, взаимодействуя друг с другом путём столкновений. Обозначим среднее число столкновений молекулы за 1 секунду с другими молекулами за Z. Тогда под средней длиной свободного пробега молекулы понимают величину l, равную l = Sli /Z, где li - расстояние, проходимое молекулой между (i -1) - ым и i - ым столкновениями.
За единицу времени молекула пройдёт путь равный средней скорости <u>; <u > = l Z, отсюда l = <u>/Z или l = <u>t, где t = 1/Z - среднее время свободного пробега молекул.
От чего зависят приведённые выше усреднённые макроскопические кинетические характеристики молекул? Прежде, от размеров молекул, которые обычно характеризуют эффективным диаметром d, равным минимальному расстоянию, на которое могут сблизиться молекулы. Эта характеристика - табличная для молекул.
При своём движении молекула столкнётся за единицу времени со всеми молекулами,
которые находятся вдоль её траектории в цилиндрическом объёме с площадью основания S = pd2 и высотой <u >. Если условно считать все молекулы неподвижными, то средняя частота столкновений Z = pd2<u>n, где n - концентрация молекул:
Если же учесть тепловое движение молекул, как бы увеличивающее сечение рассеяния (эффективный диаметр молекул), то число столкновений будет в Ö2 раз больше, т. е.
Z = Ö2pd2<u>n. Откуда l = <u>/Z = 1/Ö2pd2<u>n.
40. Явления переноса в газах. Диффузия. Коэффициент диффузии.
Общая характеристика явлений переноса. Коэффициенты явлений переноса.
При выведении макросистемы из состояния термодинамического равновесия, т. е. при
нарушении однородности в пространственном распределении параметров макросистемы - концентрации n, давления Р, температуры Т, в ней возникают направленные потоки, соответственно - вещества /массы/, импульса и теплоты, стремящиеся выровнять распределение параметров по объёму макросистемы, вернуть её в состояние термодинамического равновесия. Можно
назвать три наиболее характерных явления переноса в термодинамически неравновесных системах:
1. Диффузия - перенос массы под действием градиента концентрации /плотности/.
2. Теплопроводность - перенос теплоты (внутренней энергии) под действием градиента температуры.
3. Вязкость /внутреннее трение/ - перенос импульса под действием градиента скорости направленного движения
При малых отклонениях от состояния равновесия возникающие потоки переносимых величин прямо пропорциональны соответствующим градиентам и описываются феноменологическими уравнениями следующего вида:j = - К×grad X , где: j - плотность потока переносимой величины /теплоты - в теплопроводности, импульса
в вязкости, массы в диффузии/, т.е. вектор, численно равный количеству величины, переносимой за единицу времени через единичную нормальную к направлению переноса площадку;
Х - величина (температура - в теплопроводности, давление (скорость) - в вязкости, концентрация - в диффузии), пространственная неоднородность которой и обусловливает неравновесность состояния макросистемы;
К - коэффициент пропорциональности, мера интенсивности того или иного явления переноса.
Задачей статистического подхода является вскрытие микроскопической природы соответствующих явлений переноса и получение выражений для коэффициентов /диффузии, теплопроводности и вязкости/, через микроскопические характеристики, такие как средняя длина свободного пробега молекул, средняя скорость их теплового движения и др.

Проанализируем с помощью статистического подхода одно из явлений переноса - диффузию. Для простоты рассмотрим одномерный случай. Неравновесность состояния здесь задаётся наличием градиента концентрации dn/dх.
Выберем при некоторой координате х нормальную к ней площадку dS.
Слева направо и справа налево будет перемещаться по 1/6 от общего числа молекул. Соответственно за время dt площадку dS пересечёт 1/6 часть молекул, содержащихся в объёме цилиндра высотой <u>dt, где <u> - средняя тепловая скорость молекул.
Слева направо: dN1 = n1<u>dt dS/6Справа налево: dN2 = n2<u>dt dS/6

В итоге за время dt через площадку dS будет
направленно перенесено число молекул dN, равное:
N = dN1 - dN2 = (n1 – n2)<u>dt×dS/6.
Разность концентраций n1 – n2 можно выразить через градиент концентрации: n1 – n2 = - (dn/dх)2l, где l - длина свободного пробега молекулы. Поверхности dS беспрепятственно достигают молекулы, отстоящие от неё не более чем на расстояние, равное длине свободного пробега l. Знак "минус" отражает тот факт, что dn/dх < 0, а n1 > n2.
Для dN получаем: dN = -(1/3)<u>l (dn/dх) dS dt . Учтя, что n = r/mо, имеем:
dN = - (1/3mо)<u>l (dr/dх) dS dt, или, т. к. mоN = m - полная масса газа, окончательно
получаем: dm/dt = - (1/3)<u>l (dr/dх) dS - закон Фика. Выражая из него плотность потока переноса массы:
jm = dm/(dS×dt) = - (1/3)<u>l×(dr/dх) = -D×grad rх, где D = (1/3)<u>l - коэффициент диффузии.
Диффузия /выравнивание концентрации/ происходит тем интенсивнее, чем выше средняя тепловая скорость молекул <u> = Ö(8kТ/pmо) и длина l их свободного пробега.
Вязкость - внутреннее трение - нагляднее воспринимается на примере неоднородного распределения скоростей u направленного движения молекул в газе, т. е. наличия в нём слоев, перемещающихся с различной скоростью. Так, например, в газопроводе слои, примыкающие к трубе, движутся с меньшей скоростью, чем слои, удалённые от неё. Межмолекулярное взаимодействие и тепловое движение приводят к переходу молекул из слоя в слой, т. е. к обмену молекулами между слоями, движущимися с разной скоростью. В результате происходит некоторое выравнивание скоростей движения разных слоев. Механически это интерпретируется как наличие трения между соседними слоями газа, направленно движущимися с различными скоростями u.
Плотность потока импульса jр, переносимого при переходах молекул из слоя в слой,
записывается в общем виде: jр = - h grad u, где h = Dr = (1/3)<u>l r - коэффициент вязкости (динамическая вязкость) или коэффициент внутреннего трения.
41. Первое начало термодинамики. Количество теплоты. Работа и теплота. Внутренняя энергия системы.
Основной энергетической характеристикой и однозначной функцией состояния теплового движения макросистемы является её внутренняя энергия Внутренняя энергия совпадает с полной энергией для неподвижного тела, не подверженного действию внешних полей. Для идеального газа внутренняя энергия есть кинетическая энергия U = Ек. Для одноатомного газа, в соответствии с законом равномерного распределения энергии по степеням свободы движения молекул: U = Ек = 3RТn/2 = 3РV/2.
В общем случае многоатомного идеального газа U = i3RТn/2 = iРV/2.
Изотермический процесс есть процесс без изменения внутренней энергии.
В механике единственным способом и одновременно мерой изменения состояния движения тела /и его функции - кинетической энергии/ служила работа силы. В термодинамике
добавляется специфический "тепловой" канал неупорядоченного изменения состояния теплового движения – теплообмен и его количественная мера – теплота (количество теплоты).
Работа совершается при изменении внешних параметров системы (в отсутствии внешних силовых полей – при изменении объема и формы системы). Теплообмен происходит между разнонагретыми телами или их частями (с разной температурой). Работа и теплообмен являются двумя содержательно различными, но количественно эквивалентными способами изменения внутренней энергии макросистем. Их количественные меры - работа и количество теплоты измеряются в одних и тех же - энергетических единицах - джоулях.
Известное из механики выражение для работы А, как произведение силы на перемещение, в термодинамике заменяется произведением давления на изменение объёма. Например, для поршня, действующего на газ в сосуде, элементарная работа dА = Fdr = рS×dr = р×dV;
dА = р×dV Þ А = òр dV.
В основу термодинамики как феноменологической физической теории теплового движения положены два закона, называемых началами термодинамики и являющихся результатами творческих обобщений опыта.
Первое начало термодинамики представляет собой обобщённый (Майер 1842 г и Джоуль 1843 г) на тепловое движение закон сохранения энергии в механике. Оно устанавливает количественную эквивалентность работы и теплоты как двух способов изменения внутренней энергии макросистем. Второе же начало термодинамики вскрывает их качественное различие,
заключающееся в возможности необратимых тепловых процессов, в отличие от всегда обратимых механических процессов.
Первое начало термодинамики в дифференциальной форме имеет следующий вид и трактовку: dU = dА¢ + dQ – элементарное приращение внутренней энергии U макросистемы равно сумме совершённой над ней внешними телами работы dА¢ и сообщённого ей количества
теплоты d Q.
Полные работа А и количество теплоты Q, в отличие от внутренней энергии U, не являются однозначными функциями термодинамического состояния макросистемы, а представляют собой функции процесса. Это значит, что:
1) значения работы А и теплоты Q зависят от вида, характера процесса между начальным и конечным состояниями системы;
2) не имеют смысла понятия "запас работы А или теплоты Q" в макросистеме, в каком-либо её состоянии. Они представляют собой изменения внутренней энергии, соответственно,
в упорядоченном (механическом) и массово-хаотическом (тепловом) способах, процессах воздействия на макросистему и имеют смысл только в связи с процессом изменения состояния системы.
42.Адиабатический процесс.Уравнение Пуассона. Работа газа при адиабатическом процессе.
Адиабатный (теплоизолированный) процесс: dQ = 0, dU = - dАÞ А12 = - DU = U1 – U2 = (m/М)СмV(Т1 – Т2) - работа совершается газом за

счёт убыли его внутренней энергии или - вся работа газа расходуется на изменение его внутренней энергии. Теплоёмкость в адиабатном процессе Сад = dQ/dТ = 0 и её, как и изотермическую теплоемкость CТ, не используют в качестве характеристики газа.
В отличие от изотермических - медленных процессов, адиабатные процессы являются быстро протекающими процессами. Условия тепловой изоляции проще осуществить на малых временах.
Получим уравнение адиабатного процесса, т. е. свяжем параметры состояния для этого процесса, например, параметры Р и V. В соотношении dA = РdV = - (m/М)СМVdTизбавимся от dТ с помощью уравнения Менделеева-Клапейрона: из PV= (m/М)RT Þ(m/М)RdT= PdV + VdP и РdV =- (m/М)СМVdT= - СМV(PdV + VdP)/ R Þ РRdV = - СМVРdV - СМVVdР Þ РRdV = - СМРРdV + RРdV – СМVVdР Þ СМР РdV + СМVVdР = 0 Þ (СМР/СМV)(dV/V) + dР/Р = 0 - дифференциальное уравнение адиабаты. Проинтегрируем его: СМР/СМV = g; g òdV/V + òdР/Р = 0 Þ g×lnV + lnР = const Þ
Р×Vg = const - уравнение адиабаты, называемое ещё уравнением Пуассона В переменных V-Т и Р-Т уравнение адиабаты, как нетрудно убедиться, используя уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) имеет следующий вид: V×Т1/(g - 1) = Т×Vg - 1 = const и Р×Тg / (g - 1) = const.Адиабата на графике в координатах P-V идёт круче изотермы, ибо показатель адиабаты g = СMP/СMV больше 1, т. е. больше, чем у изотермы. Увеличение (изменение) давления здесь обусловлено не только уменьшением объёма газа, но ещё и увеличением его температуры.
Выражая из уравнения Майера молярную теплоемкость при постоянном объеме: СМV = СМР – R и подставляя её в выражение для работы и изменения внутренней энергии, получим: А12 = -DU = (m/М)СмV(Т1 – Т2) = (m/М)iR(Т1 – Т2)/2.
44. Работа, совершаемая газом в различных изопроцессах.
Первое начало термодинамики в дифференциальной форме имеет следующий вид и трактовку: dU = dА¢ + dQ – элементарное приращение внутренней энергии U макросистемы равно сумме совершённой над ней внешними телами работы dА¢ и сообщённого ей количества
теплоты d Q.
1Изохорный процесс: V = const; dV=0; dA = РdV = 0.
В изохорном процессе газ не совершает работы (условие механической изоляции).
dQ = dU = (m/М)СмVdT и СмV = dUм/dT = d/dT(iRТ/2) = iR/2
Q12 = DU = U2 – U1 = (m/М)СмV(Т2 – Т1) = (m/М)iRТ/2
Вся сообщаемая в изохорном процессе теплота идёт на изменение внутренней энергии газа. Изохорный - механически изолированный процесс. Первое начало термодинамики можно записать через молярную теплоемкость при постоянном объеме: dQ = (m/М)СмVdT + РdV
2Изобарный процесс: Р = const; dQ = (m/М)СмРdT;
Q12 = (m/М)СмР(Т2 – Т1)
Из уравнения Менделеева-Клапейрона РV = (m/М)RT следует: dA = РdV = (m/М)RdT. Отсюда, в частности, вытекает трактовка молярной постоянной R = dА/(m/М)dT - как работы изобарного расширения одного моля идеального газа при единичном изменении его температуры. Для полной работы А12 газа в изобарном процессе получаем: А12 = òРdV = Р(V2 – V1) или А12 = (m/М)R(T2 – Т1)
Подставляя dA = РdV = (m/М)RdT в первое начало термодинамики, получаем:
m/М)СмРdT = (m/М)СмVdT + (m/М)RdT Þ СмР = СмV + R =iR/2+R=(i + 2)R/2–уравнение Майера.
Молярная теплоёмкость газа при постоянном давлении больше чем при постоянном
объёме на величину молярной газовой постоянной R. При постоянном объёме газ не совершает работы, и вся подводимая к нему теплота полностью расходуется на изменение его внутренней энергии, на изменение температуры. При изобарном же процессе часть подводимой теплоты уходит на совершение работы, и для того же изменения температуры тела к нему нужно подвести больше теплоты, чем в изохорном процессе.
3Изотермический процесс: Т = const, dU = (m/М)СмVdT= const, dQ = dA - вся

сообщаемая газу теплота в изотермическом процессе расходуется на совершение работы против внешних сил.
Q12 = A12 = ò РdV =(m/М)×RT òdV/V = (m/М)RT ln(V2/V1), где подставлено Р = (m/М)RT/V из уравнения Менделеева – Клапейрона. Изотермичными являются процессы кипения, плавления, кристаллизации.
При изотермическом расширении газа V2 > V1 Þ А12 > 0 и Q12 > 0, т. е. к газу нужно подводить теплоту, а при сжатии V3 < V1 и Q13 < 0 - от газа нужно отводить теплоту. Изотермическая теплоёмкость СТ = dQ/dТ формально равна бесконечности, поэтому она практически не используется как характеристика системы.
Изотермические процессы всегда связаны с передачей теплоты, то есть с массово-хаотическим способом изменения внутренней энергии системы, и потому они являются медленными, инерционными. Теплота должна иметь время на "миграцию", распространение по системе теплового (массово-хаотичного) возбуждения.
4Адиабатный (теплоизолированный) процесс: dQ = 0, dU = - dА Þ А12 = - DU = U1 – U2 = (m/М)СмV(Т1 – Т2) - работа совершается газом за

счёт убыли его внутренней энергии или - вся работа газа расходуется на изменение его внутренней энергии. Теплоёмкость в адиабатном процессе Сад = dQ/dТ = 0 и её, как и изотермическую теплоемкость CТ, не используют в качестве характеристики газа.
В отличие от изотермических - медленных процессов, адиабатные процессы являются быстро протекающими процессами. Условия тепловой изоляции проще осуществить на малых временах.
Получим уравнение адиабатного процесса, т. е. свяжем параметры состояния для этого процесса, например, параметры Р и V. В соотношении dA = РdV = - (m/М)СМVdTизбавимся
от dТ с помощью уравнения Менделеева-Клапейрона: из PV= (m/М)RT Þ (m/М)RdT= PdV + VdP и РdV = - (m/М)СМVdT= - СМV(PdV+VdP)/ R Þ РRdV = - СМVРdV - СМVVdР Þ РRdV = - СМРРdV + RРdV – СМVVdР Þ СМР РdV + СМVVdР = 0 Þ (СМР/СМV)(dV/V) + dР/Р = 0 - дифференциальное уравнение адиабаты. Проинтегрируем его: СМР/СМV = g; g òdV/V + òdР/Р = 0 Þ g×lnV + lnР = const Þ
Р×Vg = const - уравнение адиабаты, называемое ещё уравнением Пуассона
В переменных V-Т и Р-Т уравнение адиабаты, как нетрудно убедиться, используя уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) имеет следующий вид: V×Т1/(g - 1) = Т×Vg - 1 = const и Р×Тg / (g - 1) = const. Адиабата на графике в координатах P-V идёт круче изотермы, ибо показатель адиабаты g = СMP/СMV больше 1, т. е. больше, чем у изотермы. Увеличение (изменение) давления здесь обусловлено не только уменьшением объёма газа, но ещё и увеличением его температуры.
Выражая из уравнения Майера молярную теплоемкость при постоянном объеме:
СМV = СМР – R и подставляя её в выражение для работы и изменения внутренней энергии,
получим: А12 = -DU = (m/М)СмV(Т1 – Т2) = (m/М)iR(Т1 – Т2)/2.
45. Графическое изображение термодинамических процессов и рабо-
ты. Равновесные и неравновесные процессы, обратимые и необратимые
процессы. Циклы. Цикл Карно. КПД тепловой машины.
Одним из характернейших отличий тепловой формы движения от механической является наличие в ней необратимых явлений и процессов. Отличие обратимых процессов от необратимых заключается в том, что они могут быть обращены, т. е. проведены в обратном направлении без компенсации - без того, чтобы в окружающих телах произошли какие-либо изменения.
На практике обратимые процессы - это обычно достаточно медленные, так называемые квазистатические процессы, при которых в изолированной макросистеме в каждый момент успевает
устанавливаться равновесное состояние.
Примером необратимых процессов являются процессы переноса: теплопроводность, диффузия, вязкость, а также расширение газа в пустоту, движение с трением и др. Перенос
теплоты самопроизвольно всегда осуществляется от областей с более высокой температурой
к областям с более низкой температурой, перенос массы - от областей с повышенной концентрацией частиц к областям с пониженной концентрацией и т. д. Такая однонаправленность протекания процессов природы требует в научном плане отражения её в особом фундаментальном законе, каковым является второе начало термодинамики. Оно имеет несколько качественных формулировок, например, в виде утверждения о самопроизвольном характере переноса теплоты только от более нагретых тел к менее нагретым, но не наоборот /Клаузиус, 1850 г/, или о невозможности таких тепловых процессов, единственным конечным результатом которых было бы отнятие от некоторого тела определённого количества теплоты и полное превращение её в работу /Томсон 1851 г/, или о невозможности построения вечного двигателя второго рода.
Циклом или круговым /замкнутым/ процессом называется такая совокупность термодинамических процессов, в результате которых система возвращается в исходное состояние,
и изменение ее внутренней энергии DU = 0. Тело, совершающее круговой процесс и обменивающееся энергией с другими телами, называется рабочим телом. Обычно им является газ.
Одним из идеализированных модел